不同淋巴结转移潜能口腔鳞癌细胞株snail基因及蛋白表达的研究
申叶春 李立恒 蔡艳霞 张凡
·论著·
不同淋巴结转移潜能口腔鳞癌细胞株snail基因及蛋白表达的研究
申叶春 李立恒 蔡艳霞 张凡
目的探讨口腔鳞癌细胞株snail基因及蛋白表达与淋巴结转移关系。方法复苏传代口腔鳞癌高、低淋巴结转移潜能细胞株,流式细胞术和RT-PCR检测培养12、24、36、48、60、72 h时间节点snail基因及蛋白表达差异。结果流式细胞术检测结果显示:高淋巴结转移细胞株snail蛋白的阳性表达率为(48±4)%,低淋巴结转移株为(20±4)%,高转移细胞株明显低于低转移细胞株,差别有统计学意义(P<0.05)。RT-PCR扩增结果显示:snail mRNA在高淋巴结转移口腔鳞癌细胞株中6个不同培养时间节点均存在高表达,而在低转移组细胞株中呈低表达,差异有统计学意义(P<0.05)。结论snailmRNA及蛋白的表达在不同淋巴结转移潜能的口腔鳞癌细胞株间存在明显的差别,高表达该基因及其蛋白可能是口腔鳞癌淋巴结转移的分子基础。
口腔鳞癌; snail; RT-PCR;流式细胞术;淋巴结转移潜能
口腔鳞癌的细胞形态学改变是其脱离原发灶,间质浸润和远处淋巴结转移的基础,而上皮间质转换在其中发挥重要作用。上皮细胞来源的恶性肿瘤在其外形改变的同时细胞表面的表型也发生变化,上皮表型表达减弱,间质细胞表型增加,snail是上皮间质转换的调节因子,下调E-cadherin表达的同时上调间质表型表达,同时因此本实验利用细胞培养、流式细胞术和RT-PCR检测口腔鳞癌不同淋巴结转移潜能细胞株snail基因及蛋白的差异,从形态和分子机制对口腔鳞癌淋巴结转移机制进行研究。
1 材料与方法
1.1 实验材料及设备 口腔鳞癌淋巴结高转移细胞株(SCC-LH)、低转移细胞株(SCC-LL)由北京大学医学部口腔医学院惠赠。RPMI-1640细胞培养基(lnvin’ogen公司);新生小牛血清(杭州四季青生物工程有限公司);胰蛋白酶A、青霉素、链霉素(华北制药股份有限公司);二甲基亚砜(DMSO)(美国Sigma公司);snail-FITC检测试剂盒(南京凯基生物);CO2培养箱(科俊仪器有限公司);低温高速离心机D-78532 (德国 Hettich Zentrifugen 公司) FAC Sort 流式细胞仪(美国BD公司)。
1.2 细胞复苏 实验室常规消毒,紫外照射40 min,培养液(DMEM)、0.25%胰蛋白酶(Trypsin)恒温水浴箱37℃预热20 min,从液氮保存罐中取出冻存管,立即放入40℃水浴中,快速摇晃,直至冻存液完全融化,将细胞悬液移入15 ml离心管,缓慢加入4 ml培养液,离心(1 000 r/min,5 min),用培养液悬液混悬沉淀细胞,调整细胞浓度,放培养箱中培养。
1.3 细胞传代培养 紫外线照射超净工作台30 min,用75%乙醇擦拭双手,预热培养液,两种细胞株均在含10%小牛血清、青霉素(100 U/ml)、链霉素(100 U/ml)双抗的RPMI-1640培养液中培养,温度37℃、相对湿度90%、体积分数为5%CO2的培养箱中进行培养,定期观察细胞生长情况,每隔2~3 d用0.25%胰酶消化,进行传代培养。在倒置显微镜下观察消化细胞,当原贴壁细胞逐渐趋于圆形,细胞质回缩,细胞间不在连接成片时为合适消化程度,加入新的培养液停止消化。用弯头吸管吸取培养液,反复吹打成细胞悬液,吸出适量细胞悬液分装到2~3个培养瓶中,加入适量的培养液后旋紧瓶盖,以乙醇棉球擦拭外壁适当旋松瓶盖,放入二氧化碳培养箱中继续培养,换液及传代时间有细胞生长情况而定。
1.4 流式细胞仪检测snail蛋白在不同细胞株中的表达 各实验管中分别加入106 PBMC,1 500 r/min离心3 min,弃上清;分别加入荧光素标记的抗snail的单克隆抗体20 ml,混匀; 4℃冰箱孵育60 min, 加入细胞洗液 , 1 500 r/min离心3 min,反复洗涤3次;用细胞洗液恢复体积至0.5 ml,加入固定液20 ml,混匀;上机检测。
1.5 培养细胞总RNA制备 PBS溶液对细胞冲洗2次,弃去PBS液,加入Trizol液1 000 μl进行消化,用1 ml加样器将已消化的细胞吹匀,直至液体澄清,且无细胞团块,放置于室温内静置10 min, 加入0.2倍体积氯仿,经过15 s的振荡后再静置于室温内15 min,12 000 r/min、4℃离心15 min, 将上层无色的水样液体,转移至新的试管中,将0.5倍体积的异丙醇加入试管中后颠倒使其混匀,放置于-20℃下静置15 min,12 000 r/min、4℃离心10 min,即可有微量的RNA沉淀在管底, 小心吸取上清液丢弃,用1 ml 75%乙醇将RNA沉淀洗涤,振荡混匀后,7 500 r/min、4℃离心5 min。小心吸取上清液丢弃,将试管轻倒置在滤纸上,尽量除尽残余的上清液,在室温下适度干燥5~10 min,将其完全溶解在20 μl 0.1%DEPC水中,取1~2 μl样品测纯度与浓度,剩余的放置在-70℃保存。
1.6 逆转录合成 cDNA snail基因预产物984 bp,上游引物序列:5’-GCCATGATGGTGCATGACCGGTTAG3’,下游引物5’-AGTCCGTAAATTGGGGCCATGC3’,以小鼠β-actin为内参照,基因库序列号(NM-007393),引物名称R607,序列AGGATGGCGTGAGGGAGAGA,扩增长度517 kb,上游引物:5’-GCATGCTCTATAGGAACGCG3’,下游引物:5’-CGATGGCAATCCTTACGTAAC3’。按照RT-PCR试剂盒说明逐步建立逆转录反应体系,本研究建立25 μl体系:将试剂盒内的试剂溶液全部置于冰槽中,使其全部融化后,预热PCR仪至50℃。以上试剂融化后涡旋振荡2 s后再经微型离心机瞬时离心5 s,放置于冰槽内。见表1。

表1 RCR反应体系
PCR产物-20℃冰箱保存。PCR产物8 μl加5×Loading Buffer 2 μl 2%琼脂糖凝胶电泳120 V,100 mA 30 min溴化乙锭染色,凝胶成象仪成象并保存结果,采用基因公司凝胶成像分析系统成像并进行数据分析。

2 结果
2.1 不同培养时间不同细胞株的形态学观察 高淋巴结转移细胞株呈梭形排列,粘附性较差,随传代时间的延长,细胞异型性更加明显、且梭形变较突出;低转移细胞株呈圆形或卵圆形,细胞粘附性差,体积较小,细胞异型性不明显。见图1~4。
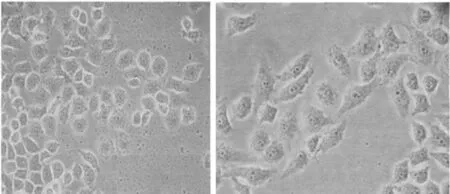
图1 高转移细胞株传代培养12 h(EB×100)图2 高转移细胞株传代培养36 h(EB×100)
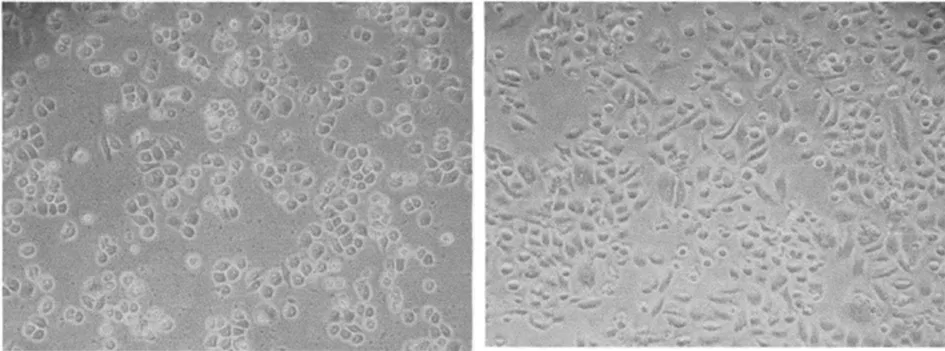
图3 低转移细胞株传代培养12 h(EB×40) 图4 低转移细胞株传代培养36 h(EB×40)
2.2 流式细胞术检测两种细胞株snail蛋白表达结果 高淋巴结转移细胞株snail蛋白的阳性表达率在不同培养时间节点的表达率为54%~47%,平均(48±4)%,低淋巴结转移株原型表达率为16%~23%,平均(20±4)%,高转移细胞株snail蛋白阳性表达明显高于低转移细胞株,差异有统计学意义(P<0.05)。见图5、6。

图5 流式细胞仪检测低淋巴结转移细胞株Snail蛋白散点图 图6 流式细胞仪检测高淋巴结转移细胞株Snail蛋白散点图
2.3 两种细胞株不同培养时间的snail基因检测结果 两种细胞株均存在snail基因的表达,且随培养时间的延迟表达均较为恒定;但是高淋巴结转移细胞株的表达水平明显高于高转移细胞株表达水平。见图7、8。
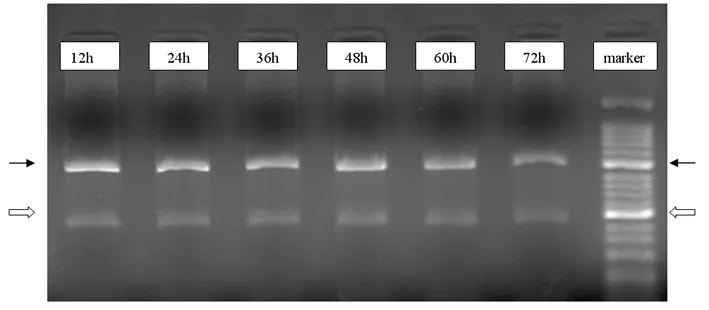
图7 低淋巴结转移细胞株不同培养时间snail基因检测结果

图8 低淋巴结转移细胞株不同培养时间snail基因检测结果
3 讨论
口腔鳞癌恶性程度大小主要取决于局部侵袭和远处转移。同样的口腔鳞癌患者在局部复发和远处转移等方面存在明显差异,导致不同的预后,与肿瘤细胞自身不同的异质性和基因组不稳定性密切相关[1,2]。有研究显示口腔鳞癌浸润前沿的肿瘤细胞出现去分化,低表达上皮细胞表型,细胞出现梭形变,更具侵袭性,而中央区域的肿瘤细胞容易出现坏死,分化程度高[3,4],因此该肿瘤的淋巴结转移始动因素与浸润前沿的细胞表面的粘附分子改变以及细胞形态变异密切相关。
上皮间质转换是胚胎时期器官发育的关键环节,在多种生理过程中出现,与肿瘤局部浸润和侵袭力密切相关,上皮细胞关键分子E-cadherin的表达降低具有代表性,而snail基因是调节前者表达的关键转录因子。Raz等[5]报道鼠皮肤癌的侵袭前脚细胞高表达snail,对人类肿瘤研究表明乳腺癌、胃癌、肝癌、结肠癌都高表达snail,并与乳腺癌的组织学分级、淋巴结转移密切相关。Battle等将反义snail转染入人结肠癌细胞株HT-29,观察到细胞株伪足缩短,细胞变园,呈间质细胞样表型向上皮表型转化的特征[6]。我们的实验通过传代培养口腔鳞癌细胞株证实:不同淋巴结转移潜能的细胞株细胞外形存在明显差别,高淋巴结转移细胞株细胞粘附性差,外形梭形变明显,低淋巴结转移细胞株外形圆形比率较高,说明高转移细胞株的梭形变和粘附力降低是恶性程度增加的形态学基础,提示参与上皮间质转换为间质浸润提供表面分子表型改变。
我们通过对不同淋巴结转移潜能细胞株12~72 h培养后检测snail蛋白表达发现,高淋巴结转移株存在该蛋白的高表达,而低淋巴结转移组存在该蛋白的低表达,差别具有统计学意义;他人实验研究还显示:高表达snail蛋白的细胞株增殖活性较高,且凋亡受到明显的抑制[7-9],说明snail蛋白在口腔鳞癌细胞株的表达不仅参与淋巴结转移,而且与肿瘤细胞的抗凋亡异质性和细胞周期蛋白的表达密切相关。RT-PCR检测结果显示:高淋巴结转移细胞株存在snail基因的高表达,而低淋巴结转移细胞株存在低表达,说明snail基因的高表达导致细胞免疫表型的改变,恶性程度增加,表型向间质细胞转化,更具侵袭性,进入淋巴管和血液循环系统的能力增加。
淋巴结转移过程中涉及的关键因子众多,而上皮间质转换还包括其他关键因子的共同作用,有关的信号通路的研究尚需今后的深入研究,这将有利于探索恶性肿瘤淋巴结转移发生的奥秘,为进一步治疗肿瘤奠定基础。
1 Mizrahi T,Heller J,Goldenberg S,et al.Zeev Arad Cell Stress Chaperones.The heat shock response in congeneric land snails(Sphincterochila) from different habitats.Cell Stress chaperones,2012,17:639-645.
2 Mizrahi T,Heller J,Goldenberg S,et al.Heat shock proteins and survival strategies in congeneric land snails(Sphincterochila) from different habitats.Cell Stress Chaperones,2012,17:523-527.
3 Hanington PC,Forys MA,Loker ES.A Somatically Diversified Defense Factor,FREP3,Is a Determinant of Snail Resistance to Schistosome Infection.PLoS Negl Trop Dis,2012,6:e1591.
4 Stepan H,Pabst M,Altmann F,et al.O-Glycosylation of snails.Glycoconj J,2012,29:189-198.
5 Raz S,Schwartz NP,Mienis HK,et al.Graham.Fluctuating Helical Asymmetry and Morphology of Snails(Gastropoda) in Divergent Microhabitats at ‘Evolution Canyons I and II’,Israel.PLoS One,2012,7:e41840.
6 Marshall DJ,McQuaid CD.Warming reduces metabolic rate in marine snails: adaptation to fluctuating high temperatures challenges the metabolic theory of ecology.Proc Biol Sci,2011,278:281-288.
7 Howell A,Mugisha L,Davies J,et al.Bovine fasciolosis at increasing altitudes: Parasitological and malacological sampling on the slopes of Mount Elgon.Uganda.Parasit Vectors,2012,5:196.
8 Massobrio P,Giachello G,Ghirardi M,et al.Selective modulation of chemical and electrical synapses of Helix neuronal networks during in vitro development.BMC Neurosci,2013,25:481-485.
9 Nica DV,Bura M,Gergen I,et al.Bioaccumulative and conchological assessment of heavy metal transfer in a soil-plant-snail food chain.Chem Cent J,2012,24:98-104.
Studyontheexpressionofsnailgeneandproteininoralsquamouscellcarcinomacelllineswithdifferentpotentialsoflymphnodemetastasis
SHENYechun,LILiheng,CAIYanxia,etal.TheFirstHospitalAffiliatedtoNorthCollege,Hebei,Zhangjiakou075000,China.
ObjectiveTo investigate the correlation between expression of snail gene and protein and lymph node metastasis in oral squamous cell carcinoma cell line.MethodsThe two cell lines of oral squamous cell carcinoma with higher or lower potential of lymph node metastasis were revived and cultured,and the expression levels of snail gene and protein were detected by flow cytometry and RT-PCR at 12h,24h,36h,48h,60h,72h,respevtively.ResultsThe examination results by flow cytometry showed that the positive expression rate of snail protein in the cell line with higher potential of lymph node metastasis was(48±4)%,which was(20±4)% in the cell line with lower potential of lymph node metastasis,there was a significant difference between the two cell lines(P<0.05).The examination results by RT-PCR showed that overexpression of snail mRNA existed in cell line with higher potential of lymph node metastasis in 6 different time points,however,low-expression of snail mRNA existed in cell line with lower potential of lymph node metastasis,there was a significant difference between the two cell lines(P<0.05).ConclusionThe expression of snail mRNA and protein exists significant differences among oral squamous cell carcinoma cell lines with different potentials of lymph node metastasis,and overexpression of snail gene and protein may be the molecular basis of lymph node metastasis in oral squamous cell carcinoma.
oral squamous cell carcinoma; snail;RT-PCR;flow cytometry; potential of lymph node metastasis
10.3969/j.issn.1002-7386.2014.11.005
075000 河北省张家口市,河北北方学院附属第一医院
R 739.85
A
1002-7386(2014)11-1617-04
2013-12-11)

