化合物T44的抗肿瘤活性研究
张 晶,张智慧,刘 伟,陈云雨,王艳宏,司书毅*(.中国医学科学院医药生物技术研究所国家新药(微生物)筛选实验室,北京 00050;.黑龙江中医药大学药学院药剂教研室,黑龙江 哈尔滨 50040)
·论著·
化合物T44的抗肿瘤活性研究
张 晶1,张智慧2,刘 伟1,陈云雨1,王艳宏2,司书毅1*
(1.中国医学科学院医药生物技术研究所国家新药(微生物)筛选实验室,北京 100050;2.黑龙江中医药大学药学院药剂教研室,黑龙江 哈尔滨 150040)
目的评估化合物1-[4′-((3R,5R)-金刚烷基)苯基)]正丁胺盐酸盐(T44)的体外抗肿瘤活性,并初步探索可能的分子机制,为这种化合物的综合应用提供实验依据。方法四甲基偶氮唑蓝比色法检测T44对细胞的体外生长抑制作用;细胞形态观察法研究T44对细胞形态的影响;流式细胞仪法检测T44作用下肿瘤细胞周期和凋亡率的变化;蛋白印迹法检测T44对不同周期蛋白表达的影响;细胞划痕实验检测T44对肿瘤细胞迁移能力的影响。结果T44对检测的11株肿瘤细胞的增殖均有抑制效果,对正常细胞人胚肺成纤维细胞也具有一定的增殖抑制作用,半数抑制浓度值为(16.58±3.49)μmol/L,高于受测的大部分肿瘤细胞;T44能导致肿瘤细胞凋亡和周期阻滞;T44能影响周期蛋白的表达并能降低HCT116细胞的迁移能力。结论T44主要通过促进细胞凋亡来发挥抗肿瘤作用。
抗肿瘤药;细胞增殖;细胞周期;细胞凋亡
癌症的主要特征为细胞无限增殖[1],这主要是由细胞周期、代谢紊乱等一系列病理变化致使细胞增殖失控、凋亡障碍所导致,已成为影响人类健康的一大主要难题。据美国癌症协会(AmericanCancerSociety,ACS)最新公布的一份统计报告称,在2012年有约1 640 000例新发癌症病例被确诊,因癌症而离世的美国人达到577 000例,约1 500例/d[2]。我国肿瘤登记中心发布的《2012中国肿瘤登记年报》统计,我国每年新发肿瘤病例约为3 120 000例,每分钟有6例被诊断为癌症[3]。抗肿瘤药物作为肿瘤治疗的重要形式在肿瘤的临床治疗中发挥着关键性作用,需求越来越大。目前在抗肿瘤药领域中生物药物、小分子药物、激素及相关药物发展势头迅猛,占有较大的市场份额[4]。因此,寻找高效、低毒的抗肿瘤小分子化合物新药仍是我国乃至世界药物学家研究的一个迫切课题。本研究利用一系列的细胞生物学和分子生物学等技术手段检测了新型小分子化合物T44的抗肿瘤活性,并对其作用效果作初步探讨。
1 材料与方法
1.1 实验药物和细胞株:1-[4′-((3R,5R)-金刚烷基)苯基)]正丁胺盐酸盐(T44),北京百灵威科技有限公司提供。人肺癌细胞(A549),人宫颈癌细胞(Hela),人乳腺癌细胞(MCF-7),人骨肉瘤细胞(U2OS),人肝癌细胞(HepG2),人成骨肉瘤细胞(MG63),人结直肠腺癌细胞(HT-29),人前列腺癌细胞(PC3),人结直肠腺癌细胞(HCT116),人肝癌细胞(Bel-7402),中国仓鼠卵巢癌细胞(CHO),均由本实验室保存。人胚肺成纤维细胞(MRC-5)购自中国医学科学院基础医学研究所基础医学细胞中心。
1.2 主要试剂和仪器:周期蛋白D1、A、B1一抗(南京生物世界科技有限公司),四甲基偶氮唑蓝(methylthiazolyltetrazolium,MTT,Sigma公司),RNA酶A(RNaseA,Sigma公司),碘化丙啶(propidiumiodide,PI,Sigma公司),AnnexinV-FITC/PI双染试剂盒(北京四正柏生物科技有限公司)。流式细胞仪(BeckmanCoulter),EnVision全自动酶标仪(PerkinElmer),凝胶成像仪(Bio-Rad),倒置显微镜(Nikon)。
1.3MTT法检测细胞生长抑制率:取对数生长期细胞,调整细胞密度为2×104~5×104个/mL,接种于96孔培养板中。贴壁后加样,同一浓度设双复孔。培养48h,加入MTT孵育4h,再加入DMSO振荡15min使生成的甲簪晶体充分溶解。酶联免疫检测仪测定570nm波长处吸收值。计算公式,细胞抑制率(%)=1-[(OD受试药组-OD空白组)/(OD正常组-OD空白组)]×100%应用GraphPadPrism5计算T44对细胞生长的半数抑制浓度(halfmaximal(50%)inhibitoryconcemtration,IC50)。
1.4 显微镜观察细胞形态:以1×106细胞数/孔接种HCT116于6孔培养板,待细胞贴壁后,加入T44(6.24μmol/L),继续培养48h,100×倒置显微镜下观察细胞形态。
1.5Westernblotting检测周期蛋白的表达:收集T44孵育后的细胞,BCA法检测蛋白浓度,十二烷基磺酸钠聚丙烯酰胺凝胶(sodiumdodecylsulfatepolyacrylamidegelpolyacrylamidegel,SDS-PAGE)电泳,并转至硝酸纤维膜上,5%脱脂牛奶室温封闭2h,加入一抗(稀释比1∶1 000)4℃过夜,三羟甲基氨基甲烷吐温缓冲液(trisbufferedsalinetween,TBST)洗膜,加入二抗(稀释比1∶5 000),室温孵育1h,洗膜,加入化学发光液后曝光,观察结果。
1.6 流式细胞仪检测细胞周期和凋亡:收集T44孵育后的细胞,以70%冰冷乙醇固定,4℃储存过夜。PBS洗涤、重悬细胞,加入RNaseA37℃恒温孵育30min后,室温下加入PI孵育30min,PBS洗涤,于1h内上流式细胞仪检测,以ModFitLT软件分析结果。收集T44孵育后的细胞,用4℃预冷的PBS洗2次,结合缓冲液悬浮细胞,调节其浓度为1×106个/mL,加入AnnexinV/FITC孵育30min,上机前5min再加入PI,流式细胞仪检测,以ModFitLT软件分析结果。
1.7 划痕实验检测细胞迁移能力:6孔培养板接种HCT116细胞,待细胞贴壁后,用灭过菌的牙签在平板底部垂直划水平细痕,PBS洗去划落的细胞,T44组浓度为6.24μmol/L,对照组含有相应DMSO的培养基,0、6、24、48h后镜下拍照,计算相对迁移率。

2 结 果
2.1T44抑制肿瘤细胞增殖:T44可抑制多种肿瘤细胞系的增殖,随着剂量的增加,细胞抑制率逐渐增加,呈剂量依赖效应,IC50值均在μmol/L水平,且随细胞系不同抑制作用也呈现差异,其中对HCT116和Bel-7402的抑制效果最明显,IC50值相当,分别为(1.19±0.06)μmol/L和(1.20±0.04)μmol/L,后续的实验选取HCT116细胞系进行。同时又检测了化合物对正常细胞MRC5的毒性,其IC50值为(16.58±3.49)μmol/L,高于大部分受检的肿瘤细胞。见表1。
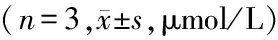
CelllinesIC50CelllinesIC50HCT1161.19±0.06MCF⁃710.05±0.58MG636.76±0.04PC33.08±0.05HT⁃2921.58±3.00Bel⁃74021.20±0.04HepG235.35±1.40U2OS5.91±0.12Hela27.17±1.10CHO6.69±1.88A54919.50±3.47MRC516.58±3.49
2.2 T44影响细胞形态:显微镜下观察,对照组细胞贴壁生长大小均匀,胞体圆整,胞质透亮,折光性好,增殖旺盛,形态规则,轮廓清晰(图1A)。T44(6.24μmol/L)处理后大部分细胞形态发生变化,呈圆形皱缩,单个散在细胞间距明显变大,胞体缩小,并从培养皿壁上脱落,细胞间连接消失,数量较对照组细胞数明显减少(图1B)。

图1 T44对HCT116细胞形态的影响( ×100)
A.对照细胞;B.T44作用下的HCT116细胞
Figure 1 The influence of T44 on HCT116 cellular morphology( ×100)
A.Control;B.HCT116 cells after treatment with T44
2.3 T44促进肿瘤细胞凋亡:Annexin V/FITC-PI双染法结果显示,T44能促进HCT116细胞的凋亡。在12h和24h,随着T44剂量增大,细胞凋亡(包括早期凋亡和晚期凋亡)均呈现显著的增长趋势,最高浓度24.96μmol/L作用下,显示出明显的促凋亡作用;24h死亡细胞的比例明显增长,24.96μmol/L作用下促凋亡作用转向杀伤作用。见表2。


GroupsApoptosis12h24hControl11.93±1.5012.41±2.616.24μmol/L34.77±2.88∗29.15±3.33∗12.48μmol/L39.55±2.58∗31.43±2.50∗24.96μmol/L85.28±3.35∗#△45.47±3.25∗#△ F28.20963.370 P<0.01<0.01
*P<0.01vscontrol #P<0.01vs6.24μmol/L △P<0.01vs12.48μmol/L byqtest
2.4 不同浓度T44对肿瘤细胞周期的影响:流式检测结果显示,作用48h随着T44剂量增加,G0/G1期细胞比例逐渐降低,6.24μmol/L浓度组较对照组明显降低(P<0.05),12.48μmol/L浓度组则较其他各组均降低(P<0.05);S期细胞变化均不太明显,各浓度组与对照组比较差异无统计学意义(P>0.05);G2/M期呈逐渐增高趋势,1.56μmol/L组低于对照组,3.12μmol/L组和6.24μmol/L组高于1.56μmol/L组,12.48μmol/L高于对照组和1.56μmol/L组(P<0.05)。见表3。

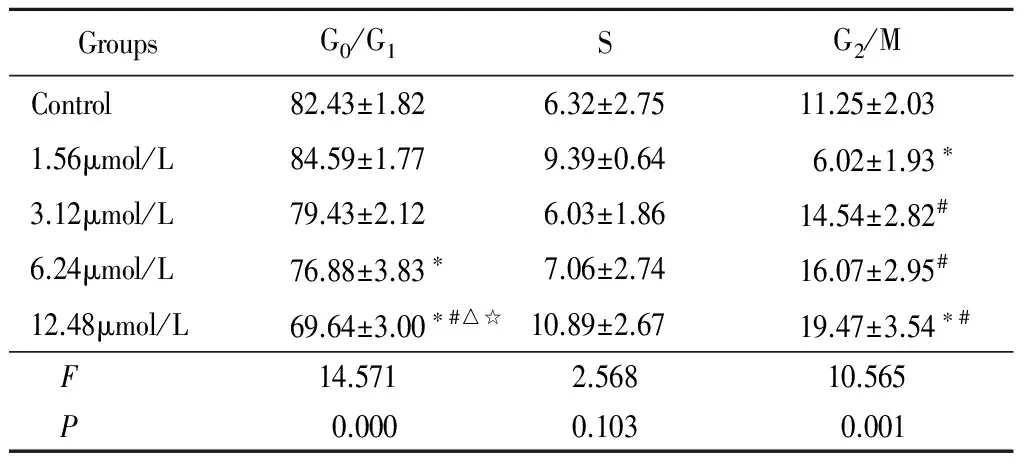
GroupsG0/G1SG2/MControl82.43±1.826.32±2.7511.25±2.031.56μmol/L84.59±1.779.39±0.646.02±1.93∗3.12μmol/L79.43±2.126.03±1.8614.54±2.82#6.24μmol/L76.88±3.83∗7.06±2.7416.07±2.95#12.48μmol/L69.64±3.00∗#△☆10.89±2.6719.47±3.54∗# F14.5712.56810.565 P0.0000.1030.001
*P<0.05vscontrol #P<0.05vs1.56μmol/L △P<0.05vs3.12μmol/L ☆P<0.05vs6.24μmol/L byqtest
2.5 T44作用不同时间对肿瘤细胞周期的影响:流式检测结果显示,对照组和6.24μmol/L浓度组细胞比例随着T44作用时间的增加均逐渐增加,特别是6.24μmol/L组在72h G0/G1期的细胞比例高于24、36、48和60h(P<0.05);对照组和6.24μmol/L浓度组S期细胞比例随着T44作用时间的增加逐渐减少,对照组培养36、48、60和72h S期细胞的比例明显低于24h,6.24μmol/L浓度组则48、60和72h明显低于24h和36h(P<0.05);对照组不同培养时间G2/M期细胞比例差异无统计学意义(P>0.05),6.24μmol/L浓度组36h和48h G2/M期细胞的比例高于24h(P<0.05),60h G2/M期细胞的比例低于36h(P<0.05),72h G2/M期细胞的比例低于24、36、48和60h(P<0.05)。见表4。


TimeG0/G1Control6.24μmol/LSControl6.24μmol/LG2/MControl6.24μmol/L24h49.90±3.1149.83±5.2540.13±4.7443.72±7.759.97±1.766.44±2.06 36h71.25±3.36∗66.64±5.1810.38±3.76∗19.29±3.69∗18.37±0.5614.07±2.63∗48h80.29±6.68∗#76.66±3.30∗#6.09±2.27∗9.04±0.99∗#13.62±1.7814.31±0.68∗60h85.20±7.39∗#84.13±2.39∗#5.38±3.55∗5.75±0.41∗#9.42±1.6710.11±2.94#72h86.66±1.64∗#92.08±3.68∗#△☆5.68±1.79∗5.28±1.75∗#7.66±0.562.64±0.91∗#△☆F27.81547.67867.41150.3481.60817.922P0.0000.0000.0000.0000.2470.000
*P<0.05vs24h #P<0.05vs36h △P<0.05vs48h ☆P<0.05vs60h byqtest
2.6 T44影响周期蛋白的表达量:与对照组比较,T44作用24h后3种周期蛋白的表达无差异;48h时Cyclin D1表达量降低,Cyclin A和Cyclin B1表达量升高,随着作用浓度的升高,Cyclin D1表达量降低,Cyclin A和Cyclin B1表达量升高。见图2。
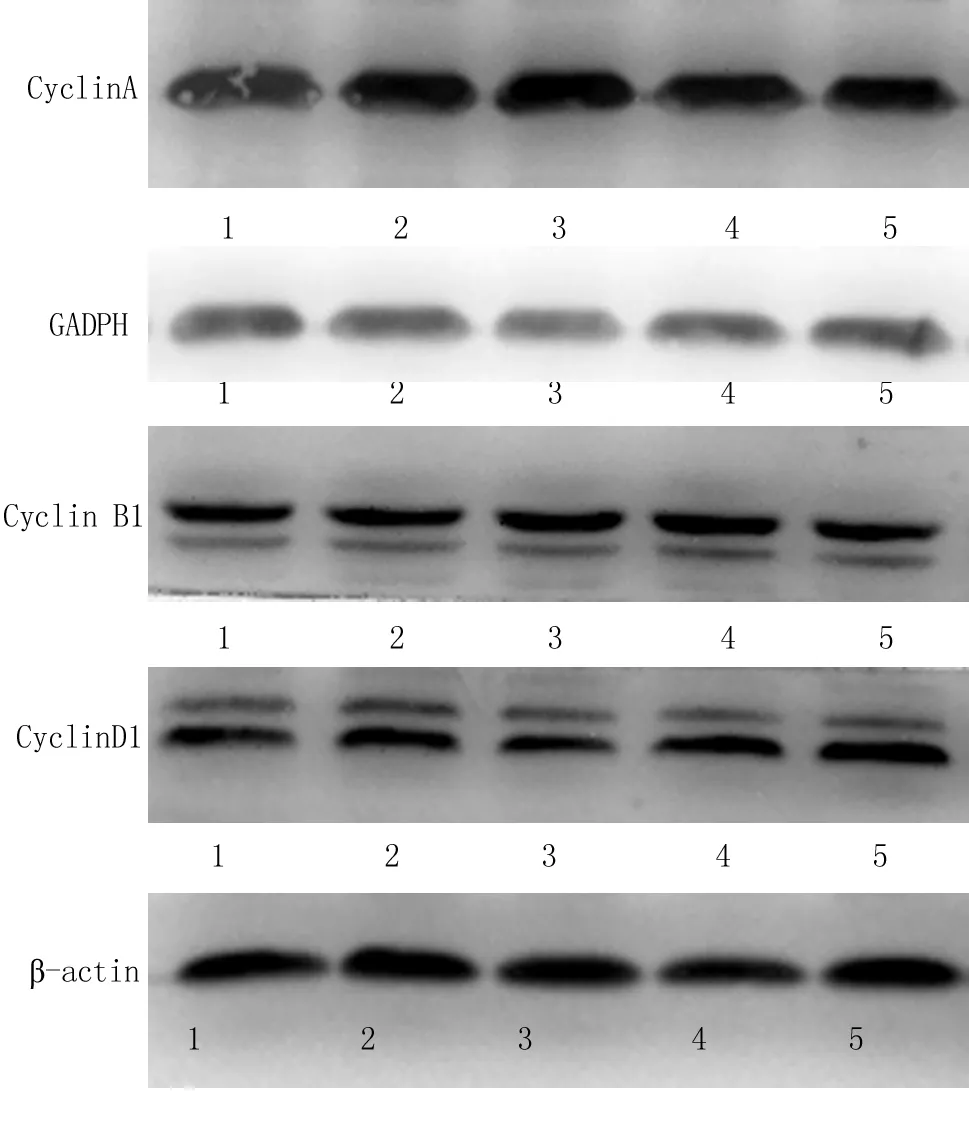
图2 T44对不同周期蛋白表达的影响
1.48h,对照;2.48h,3.12μmol/L;3.48h,6.24μmol/L;4.24h,对照;5.24h,3.12μmol/L
Figure 2 The influence of T44 on different cyclins
1.48h,control;2.48h,3.12μmol/L; 3.48h,6.24μmol/L;4.24h,control; 5.24h,3.12μmol/L
2.7 T44降低肿瘤细胞的迁移率:100×显微镜下的细胞迁移实验结果显示,与对照组相比,加药组(6.24μmol/L)细胞的迁移能力显著减弱。6h 2组相对迁移率接近,随着时间延长,加药组的迁移抑制作用愈加明显,48h 2组细胞的相对迁移率相差了一倍以上。见图3。
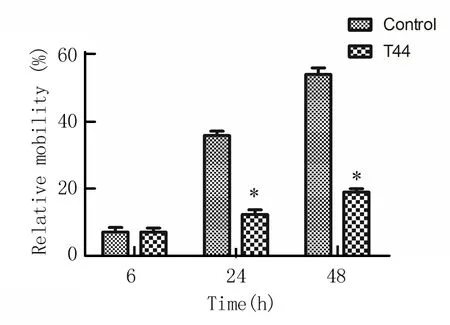
图3 T44对HCT116细胞相对迁移率的影响
Figure 3 The influence of T44 on migration ability of HCT116 cells
3 讨 论
在我国,恶性肿瘤已成为影响人民健康的最大危险因素之一,对肿瘤防治机制的研究,是现代医学特别是临床非常重要的课题[5]。在过去的5~10年时间里,抗肿瘤药物的研发始终是创新药物研发最为活跃的领域,大约占所有国家食品药品监督管理局受理申报的创新药1/3左右。
本实验室致力于寻找新型的具有抗肿瘤活性的先导小分子化合物,得到了化合物T44。从本研究结果分析,T44能抑制肿瘤细胞的增殖,且对不同细胞系的抑制活性不同,其中对HCT116和Bel-7402的抑制作用最为明显,MG63、PC3、U2OS和CHO的作用稍次,而对HT-29、HepG2、Hela、A549、MCF-7和正常细胞MRC-5的抑制作用相当,有可能与此化合物作用的靶点蛋白在这几种细胞系中的表达量不同有关,这也就决定了对细胞系的敏感性不同。本研究结果还表明T44对肿瘤细胞系的增殖抑制作用有可能是通过促进周期阻滞和凋亡来完成的,其中促凋亡作用更加显著。本研究中值得一提的是,T44在导致HCT116细胞的周期阻滞时在量效和时效上出现了不同的效应,随着作用时间的延长,与自身相比,HCT116细胞的G0/G1期比例增加;而随着化合物作用浓度的增大,与自身相比,HCT116细胞呈现出不同的周期阻滞,即G0/G1期比例减少,这其中可能的原因在于化合物T44的是多靶点抑制剂,在延长时间和增加给药量的情况下,不同的靶点蛋白活性受到了抑制,因此导致出现不同的周期阻滞,也可能正是由于多靶点的作用,使得T44的促凋亡作用非常明显。肿瘤的发生发展是多步骤的过程,恶性肿瘤形成以后细胞经过不断的突变和选择,其恶性行为逐步升级,涉及许多基因的激活并参与作用,因此肿瘤的治疗也需要多角度进行[6]。目前单一靶点的小分子化合物类药物的抗肿瘤治疗范围窄,难以达到理想的阻断恶性肿瘤细胞赖以发生、发展的相关信号通路网络,多靶点药物简化了治疗程序,成为一个新的研究趋势[7]。接下来我们又检测了3种与细胞周期密切相关的周期蛋白在T44作用下的蛋白表达情况。Cyclin A是细胞周期进入S期所必须的调节蛋白[8],它的过表达将导致处于S期的细胞明显增多,促进细胞增殖。Cyclin B1活性的发挥对细胞能否通过G2/M检验点进入M期起决定性作用[8]。G1期的启动是细胞周期的关键,Cyclin D1是G1/S期调控点重要的正向调控因子[9]。Western blotting结果与此相符。转移是恶性肿瘤细胞的重要特征之一。细胞迁移是恶性肿瘤侵袭和转移中的关键步骤之一,具有侵袭性的肿瘤细胞有较强的运动性,肿瘤细胞的无限增殖是肿瘤生长和迁移侵袭的前提条件,肿瘤转移至远处器官后,最终发生多器官受累加速患者死亡[10]。接下来我们检测了T44对HCT116细胞增殖和迁移能力的影响。结果显示T44作用后HCT116细胞的增殖和迁移活性显著降低,加药组的细胞划痕面积较对照组显著减少,证实T44具有降低肿瘤迁移能力的作用,能抑制体外培养的人结直肠腺癌的转移。
总之,本研究首次验证了T44的体外抗肿瘤活性,结合前期研究工作,提示具有较好的抗肿瘤研究和开发前景,表明该化合物具有进一步研究的价值。下面的工作主要考虑从两个方面进行:一是对化合物进行结构改造来进一步提高其抗肿瘤指标;另一方面是从与周期、凋亡和迁移有关的蛋白入手来确定T44的作用靶点。由于其促凋亡作用非常显著,考虑先从与凋亡相关的靶点蛋白入手,目前发现的凋亡相关蛋白主要包括凋亡促进因子如Bax、Bak等及凋亡抑制因子如Bcl-2等[11],其确切机制尚需进一步研究。本研究为新的抗肿瘤药物的发现和改造奠定了基础。
[1] TEICHER BA,LINEHAN WM,HELMAN LJ.Targeting cancer metabolism[J].Clin Cancer Res,2012,18(20):5537-5545.
[2] SIEGEL R,NAISHADHAM D,JEMAL A.Cancer statistics[J].CA Cancer J Clin,2013,63(1):11-30.
[3] 李秋萌.全国每分钟有6人被确诊为癌症[N].京华时报,2013-01-10(A05).
[4] 田红,肖桂芝,刘永贵.抗肿瘤药物市场分析[J].现代药物与临床,2013,28(3):424-427.
[5] 李国慧,颉玉欣,郭晓华.苦参碱抑制人卵巢癌细胞株A2122 增殖与诱导凋亡的实验研究[J].河北医科大学学报,2008,29(3):367-369.
[6] 李海峰,刘铁军,刘海波,等.COX-2及Survivin在涎腺腺样囊性癌中的表达[J].河北医科大学学报,2008,29(5):694-696.
[7] 郑军,范松青.靶向抗肿瘤小分子化合物类药物的研究[J].国际肿瘤学杂志,2012,39(3):172-175.
[8] 魏秀梅,白杨,叶龙,等.细胞周期调控与卵巢癌[J].吉林医药学院学报,2013,34(3):205-207.
[9] 陈艳昕,刘庆滨,顾涛.细胞周期素D1、S期激酶相关蛋白2与p27kip1在结直肠癌中的表达及相关性研究[J].临床荟萃,2012,27(15):1335-1337.
[10] 陈科全,陈学清,翟国栋,等.Syndecan-1对结肠癌细胞增殖、迁移和侵袭的影响[J].胃肠病学,2013,18(7):406-410.
[11] 冉广宇,杨彦彪.盐酸小檗碱对人乳腺癌MCF-7细胞增殖及凋亡的影响[J].临床荟萃,2013,28(6):683-685.
(本文编辑:许卓文)
RESEARCHONANTI-TUMOREFFECTSOFCOMPOUNDT44
ZHANGJing1,ZHANGZhihui2,LIUWei1,CHENYunyu1,WANGYanhong2,SIShuyi1*
(1:InstituteofMedicinalBiotechnologyAcademy,MedicalSciences&PekingUnionMedicalCollege,theNational
LaboratoryforScreeningNew(Microbial)Drugs(LSMD),Beijing100050,China;2.DepartmentofPharmaceutics,
CollegeofPharmacy,HeilongjiangUniversityofChineseMedicine,HeilongjiangProvince,Haerbin150040,China)
ObjectiveInordertoprovideexperimentalevidenceforthecomprehensiveapplicationofcompoundT44,weexploredthepossiblemechanismsofitsanti-tumoreffects.MethodsMTTassaywasusedtomeasurecellproliferation.Transitionofcellcycleandapoptosisweretestedbyflowcytometer,respectively.Capacityofcellmigrationwasdetectedbyscratchassay.Westernblottingwasappliedfordeterminingtheexpressionofdifferentcyclins.DetectionofcellmorphologychangewasutilizedtoobservetheinfluenceonHCT116cells.ResultsTheproliferationof11kindsoftumorcelllinesweredecreasedmarkedlyascomparedwiththoseofcontrolcells,andtheyshoweddistinctsensibilitywithoneanother.Halfmaximal(50%)inhibitoryconcemtrationofhumanlungfibroblastswas(16.58±3.49)μmol/L,higherthanmostofthetumorcelllines.T44treatedHCT116cellsdecreasedcellmigrationandalteredcyclinsexpression,aswell.T44couldalsoleadtocellcycleblockandapoptosis.ConclusionT44participatedintothecontroloftumorproliferationprobablybymodulationofcellcycleandinductionofapoptosis.
antineoplasticagents;cellproliferation;cellcycle;cellproliferation
2014-02-22;
2014-04-20
国家自然科学基金青年科学基金(81001387)
张晶(1981-),女,河北石家庄人,中国医学科学院医药生物技术研究所助理研究员,医学博士,从事抗肿瘤药物筛选及活性评价研究。
*通讯作者。E-mail:sisyimb@hotmail.com
R979.1
A
1007-3205(2014)05-0517-05
10.3969/j.issn.1007-3205.2014.05.009

