心脏核磁共振成像对缺血后处理急性ST段抬高型心肌梗死后心室重塑的影响
陈德华, 郑仕杰, 周敬群, 向常清
(三峡大学第二临床医学院, 1. 放射科; 2. 心内科, 湖北 宜昌, 443001)
急性心肌梗死(AMI)治疗的目的是尽早恢复和保护心肌细胞的血液供应,常见的方法有溶栓和经皮冠状动脉介入治疗,但其会影响缺血心肌细胞的再灌注损伤。研究[1]表明,缺血后处理可以减少心肌组织氧化损伤及再灌注损伤,抑制心室重塑。然而,随着AMI病死率的下降,缺血后处理的评价倾向于患者后期心室重塑的改善。最近的研究[2]表明,心脏核磁共振成像(CMR)可以作为一种准确预测心室重塑的无创性影像学手段,以判断心肌梗死患者心室重塑的风险性。本研究旨在探索CMR对缺血后处理的ST段抬高心肌梗死(STEMI)术后患者左心功能变化及心室重塑的影响,现报告如下。
1 资料与方法
1.1 一般资料
选择2010年9月—2012年7月本院住院部心内科收治的缺血后处理的STEMI患者32例作为实验组,所有患者均符合2001年12月中华医学会心血管病分会提出的诊断标准[3],入院12 h内行冠状动脉造影,缺血后处理冠状动脉支架植入术,其中男20例,女12例,年龄51~70岁,平均(61±9)岁。同时选取12例健康志愿者作为对照组,年龄52~69岁,平均(61±8)岁。2组患者分别于术后6个月行CMR检查,其中根据延迟强化面积比,以24%为分界值,将实验组患者又分为无重塑组≤24%(n=14)和重塑组>24%(n=18)。CMR检查前,所有患者均签署临床知情同意书,且实验设计方案得到本院伦理委员会批准。
1.2 方法
1.2.1 缺血后处理:术前,所有患者均行常规血液生化检查及治疗,包括抗凝、抗血小板、他汀类降脂药物、血管紧张素转换酶抑制剂、硝酸酯类、β受体阻滞剂、抑酸护胃及支持治疗,采用常规标准技术行冠状动脉造影,病变血管狭窄程度由2名心内科介入医生共同判断。实验组用球囊预扩张梗死相关动脉(IRCA), 实现再灌注1 min后,减压充盈球囊使IRCA关闭20 s, 然后充盈30 s, 再关闭20 s, 如此实现再灌注/再闭塞3次后持续再灌注,放置支架。介入治疗成功指冠状动脉造影示IRCA有效开通,残余狭窄<20%, 且远端血流达心肌梗死溶栓(TIMI)3级。
1.2.2 CMR成像检查及心功能测量:所有患者于术后6个月行CMR常规扫描、灌注成像(PWI)、延迟增强(DCE)扫描。核磁共振成像(MRI)检查使用1.5 T高场磁共振,扫描序列包括: TIR、DIR、FIESTA、PWI及DCE。PEI扫描在FIESTA序列完成后进行,按照0.2 mmol/kg静脉团注对比剂Gd-DTPA。DCE使用心电图触发的反转恢复-快速梯度回波序列(IR-FGR), TR-6.Imsec, TE=2.Imsec,选择合适的反转时间(TI=180~240 msec)将正常心肌抑制成无信号,行短轴面、二腔心面和四腔心面扫描。扫描结束后,在Siemens Syngo Leonardo后处理工作站利用Argus软件对扫描图像进行分析,主要观察及测量项目如下: ① 观察左室壁各节段收缩-舒张活动度情况。将左室短轴位电影序列导入Argus软件,利用软件电影播放功能,观察左心室各节段室壁运动情况;利用软件自动分析功能,测量出心功能相关的参数值。左室心功能指标包括:舒张末期容积(EDV)、收 缩末期容积(ESV)、每搏输出量(SV)、射血分数(EF); ② 在TSE_T2W序列上观察左室心肌各节段信号,观察是否存在由于水肿造成的心肌内异常高信号; ③ 在延迟强化图像上判断心肌延迟强化的有无,并计算心肌梗死面积的百分比。
2 结 果
2.1 CMR测定心脏左室形态学及信号强度的变化
对照组舒张末期正常外侧壁厚度平均为(8.65±1.32) mm, 心室轮廓规则;实验组梗死部位室壁厚度平均为(5.57±1.43) mm, 心室轮廓不规则,部分可见局部外凸或内陷。CMR结果可见左室多壁段收缩活动异常19例;室壁瘤形成5例;无室壁收缩运动异常8例。DCE扫描见梗死部位心肌呈明显强化,其中灶状强化13例,心内膜下强化10例,透壁强化9例。
2.2 CMR测定心功能参数
与对照组比较,无重塑组与重塑组患者的EDV、ESV和SV均明显增加(P<0.05或P<0.01), 而EF、PER和PFR均有不同程度的下降,其中重塑组下降的幅度更为显著(P<0.01)。见表1。
根据各参数间回归线性关系分析,结果显示:ESV与EDV的增大呈线性关系(P<0.05);PFR、PER和EF均随EDV的增大而呈线性下降趋势(P<0.01)。见图1~4。

表1 CMR测定的心功能参数结果
与对照组比较,*P<0.05,**P<0.01。
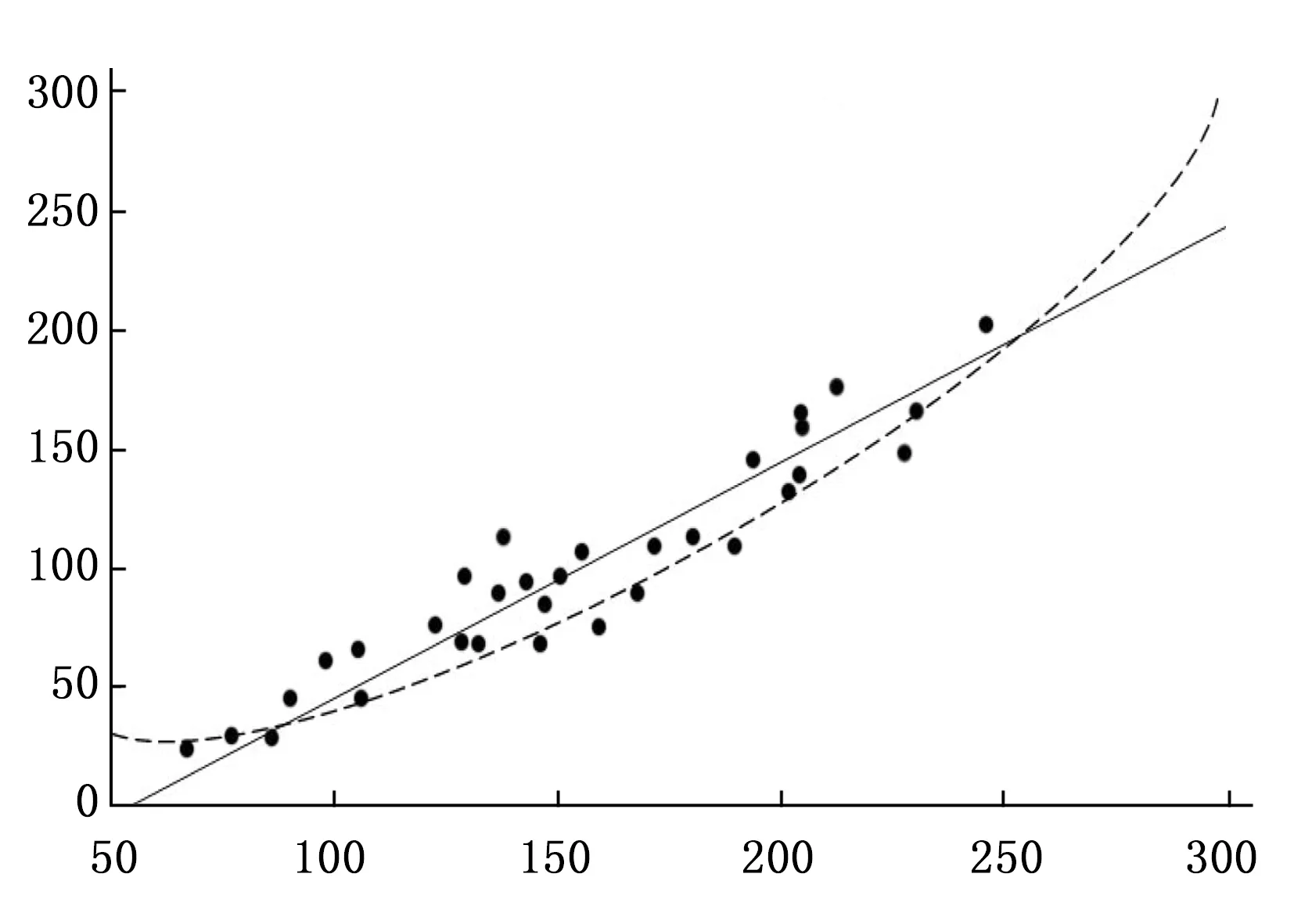
图1 ESV值与EDV变化趋势图
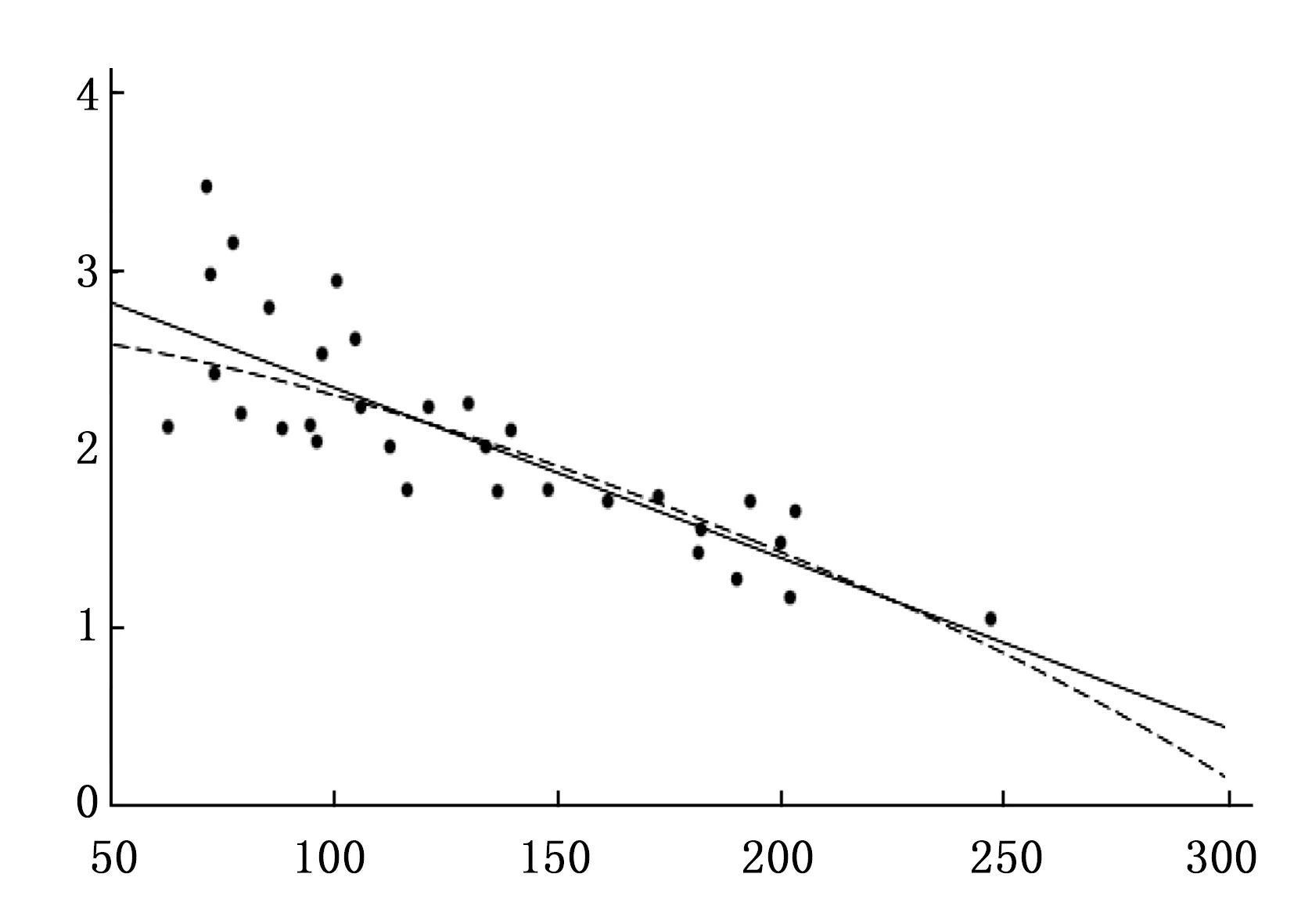
图2 PFR值与EDV变化趋势图

图3 PER值与EDV变化趋势图
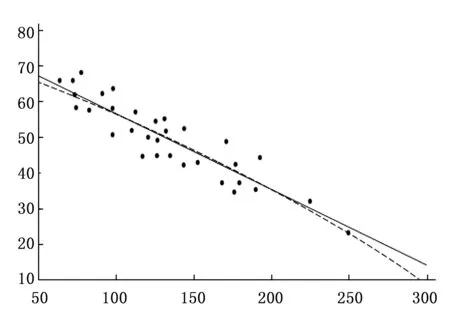
图4 EF值与EDV变化趋势图
2.3 受试者工作特征(ROC)曲线分析结果

图5 PFR、PER和EF值预测心室重塑的ROC曲线
在以心肌梗死面积所占比例为24%为分界,各心功能参数对心室重塑的预测效能见图5~6; 各参数经ROC曲线分析显示,EDV、ESV、EF和PFR的曲线下面积分别为0.741、0.764、0.713和0.743(P<0.05)。见表2。
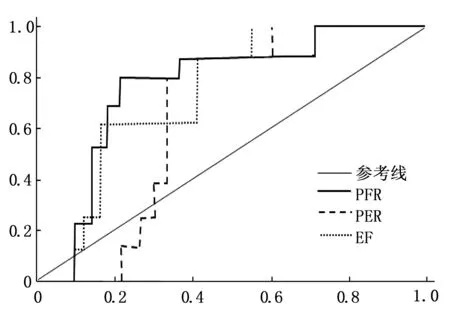
图6 ESV、SV和EDV值预测心室重塑的ROC曲线
表2心功能各参数值的ROC曲线分析结果

ROC曲线EDVESVSVEFPERPFR峰下面积0.7410.7640.6390.7130.6370.743P0.0360.0210.2250.0630.2330.029
3 讨 论
Liao等[4]动物实验表明,大鼠AMI后心肌细胞结构随时间变化,发生相应的改变,包括左室心肌质量的变化、疤痕组织的收缩及非梗死区域心肌细胞的代偿性肥厚,这样的心室重构可能是急性心肌损伤后激活心肌细胞增殖,最终影响到大鼠的左室收缩功能及其生存。Otto等[5]研究发现,心肌梗死发生后,左心室扩大的程度取决于心肌损害的严重程度及正常心肌细胞的代偿性肥厚程度,进而影响患者的生存质量。目前,CMR作为一种预测心室重塑的无创性影像学手段,可以准确的评价左室容积和功能,并且判断心肌梗死患者心室重塑的风险性[2]。
EF、EDV、PER、PFR等参数的变化是从心室的血流动力学方面反映心肌梗死后的变化。心肌梗死后,心力衰竭可依据EF分成收缩性心力衰竭和舒张性心力衰竭,EF主要是反映左室的整体功能,但不能区分是收缩功能还是舒张功能的异常。研究[6]发现,在舒张性心力衰竭患者中,EF可以保持在正常水平。因此,EF值的降低不是评估心力衰竭的唯一标志性因素,而PER和PFR却能从收缩和舒张两个不同角度描述心脏功能。本研究结果表明,与对照组比较,无重塑组与重塑组患者的EDV、ESV和SV均明显增加,而EF、PER和PFR均有不同程度的下降,其中重塑组下降的幅度更为显著。本研究结果表明,心肌梗死后的EF值正常并不能代表心功能正常,提示EF不能作为独立因子预测心室重塑,这与Veselova等[7]研究结果类似。此外,PER和PFR均在心肌梗死进程中表现为持续下降,其中PFR可作为独立预测心室重塑的参数。大量研究[8-9]结果表明,梗死面积的百分比与左室重塑呈明显的线性关系。Iund等[10]研究发现,将梗死面积分界值设定为24%时,敏感性、特异性和准确率分别为92%、93%和93%。本研究多元回归分析提示,梗死面积可以独立预测心室重塑,且结果较为可靠。
综述所述,根据延迟强化面积百分比,对STEMI患者进行分组,当梗死面积百分比>24%时存在心室重塑。经ROC分析结果显示,PFR、ESV和EDV均可作为单独的因子预测心室重塑。
[1]郑仕杰, 周敬群, 向常清, 等. 缺血后处理对急性ST段抬高型心肌梗死术后患者生存质量的随访研究[J]. 中国医师进修杂志, 2013, 36(25): 20.
[2]WANG Jing, ZHANG Hao. Study progress of cardiac MRI technology in assessment of myocardial viability after myocardial infarction[J]. International Journal of Medical Radiology, 2013, 36(3): 237.
[3]中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 急性心肌梗死诊断和治疗指南[J]. 中华心血管病杂志, 2001, 29(12): 710.
[4]Liao ZL, Wang BY, Liu F. Myocardial proliferation/regeneration in rats with experimental acute myocardial infarction. Zhonghua Xin Xue Guan Bing Za Zhi, 2013, 41(11): 950.
[5]Otto Beitnes J, Oie E, Shahdadfar A, et al. Intramyocardial injections of human mesenchymal stem cells following acute myocardial infarction modulate scar formation and improve left ventricular function[J]. Cell Transplant, 2012, 21(8): 1697.
[6]Danilouchkine MG, Westenberg JJ, de Roos A, et al. Operator induced variability in cardiovascular MR: left ventricular measurements and their reproducibility[J]. J Cardiovasc Magn Reson, 2005, 7(2): 447.
[7]Veselova TN, Merkulova IN, Iarovaia EB, et al. The role of multispiral computed tomography in assessment of viability of the myocardium and prognostication of left ventricular remodeling in patients with ST-elevation myocardial infarction[J]. Kardiologiia, 2013, 53(2): 10.
[8]Lonborg J, Vejlstrup N, Kelbik H, et al. Final infarct size measured by cardiovascular magnetic resonance in patients with ST elevation myocardial infarction predicts long-term clinical outcome: an observational study[J]. Eur Heart J Cardiovasc Imaging, 2013, 14(4): 387.
[9]樊国亮, 修宗谊, 谷天祥, 等. EPO对糖尿病兔心肌梗死后心肌间质重塑的影响[J]. 中国心血管病研究, 2011, 9(5): 386.
[10]Lund G K, Stork A, Muellerleile K, et al. Prediction of left ventricular remodeling and analysis of infarct resorption in patients with reperfusedmyocardial infarcts by using contrast-enhanced MR imaging[J]. Radiology, 2007, 245(1): 95.

