纳米药物晶体的制备技术及其应用
王廉卿,戎欣玉,2,刘 魁,胡 易,高 倩,赵树春,2,李校根,张于驰
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北省药物化工工程技术研究中心,河北石家庄 050018;3.河北科技大学理学院,河北石家庄 050018)
纳米药物晶体的制备技术及其应用
王廉卿1,戎欣玉1,2,刘 魁3,胡 易1,高 倩1,赵树春1,2,李校根1,张于驰1
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北省药物化工工程技术研究中心,河北石家庄 050018;3.河北科技大学理学院,河北石家庄 050018)
纳米药物晶体技术是一种新颖的增加难溶性药物溶解度的药剂学途径,通过该技术制备的纳米药物晶体粒径小、载药量高,适用于多种给药途径,可显著提高药物溶解度和溶出速率,日益受到药剂工作者和研究人员的关注。通过查阅国内外文献,对纳米药物晶体的特点、増溶机理、制备方法、制备过程中使用的稳定剂以及市场应用等方面的研究情况进行了综述。
纳米药物晶体;难溶性药物;溶解度;溶出速率;制备方法;市场应用
近年来,随着组合化学、高通量筛选技术在药物研发中的广泛应用,难溶性药物数量持续增加。文献报道,约40%的候选药物存在溶解度差的问题,约60%的全合成药物为难溶性药物[1]。溶解度差的药物(如水溶性<10 mg/mL)表现为不完全或不稳定的吸收[2],药物的难溶性不仅限制了药物制剂开发和临床试验,阻碍了具有药物活性新化合物的筛选,也造成药品治疗费用与疗效比例的严重失调。因此,如何改善难溶性药物的溶解度,促进药物吸收,提高药物生物利用度成为药剂学领域亟待攻克的难题。
目前,国内外制药领域改善药物溶解性能常用的传统方法是将药物成盐[3]或制成前药[4],常用的制剂方法包括使用混合溶剂[5]、采用包合技术[6]、制备载体类纳米制剂[7]以及将药物微粉化[9]等。但是常用的传统方法诸如将药物成盐的方法应用范围较窄,只适用于一些难溶性弱酸或弱碱类药物,制成前药开发的产品常存在生物利用度低、不稳定等问题[9];同样,常用制剂方法也存在局限性[10-11]。因此,急需开发一种通用而有效的新方法来增加药物的溶解度,改善药物的吸收。
纳米晶体技术,即制备纳米药物晶体,是一种新颖的增加难溶性药物溶解度的药剂学途径。根据Noyes-Whitney和Freundlich-Ostwald方程[12-13],通过降低药物粒径至纳米级,可显著增加药物饱和溶解度和溶出速率。
1 纳米药物晶体的特征
纳米药物的粒径范围一般为1~1 000 nm,依据纳米粒子存在的形式可分为纳米药物晶体和纳米药物载体。与纳米药物载体不同,纳米药物晶体仅含有少量稳定剂,不含任何基质材料,是药物本身的纳米化,可认为是粒径小于1 μm的“纯”药物固体粒子。纳米药物晶体通常要分散于液体介质中制备,得到由纳米晶体药物、稳定剂和分散介质组成的纳米混悬液[14]。分散介质包括水、亲水溶剂或非水溶剂(如液体聚乙二醇或油)。
纳米药物晶体具有粒径小(1~1 000 nm)、载药量高(含药量可接近100%)、适于多种给药途径(如口服给药、注射给药、肺部给药、眼部给药、皮肤黏膜给药以及靶向给药等)、可显著提高药物溶解度和溶出速率、易于生产扩大化等特点[10,15],已逐渐成为国际药学领域提高难溶性药物,尤其是生物药剂学分类系统(BCS)Ⅱ类药物(低溶解度、高渗透性)的溶解度、改善药物吸收的前沿性热点课题。
2 纳米药物晶体溶出速率和饱和溶解度增加的机理
溶出速率和溶解度的增加是纳米药物晶体的2个重要特征,也是改善药物吸收、提高生物利用度的根本原因,其溶出速率和饱和溶解度增加的机理如下。
2.1溶出速率的增加
药物粒子的粒径减小,粒子表面积将随之增大。研究显示[16],粒子粒径从100 μm减小至10 μm,表面积增加10倍;从10 μm减小至100 nm,表面积增加1 000倍,如图1所示。
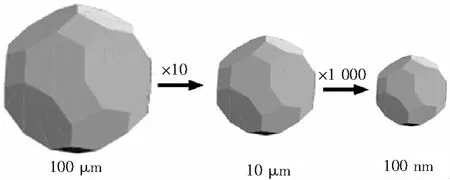
图1 表面积随着粒径减小而增大的示意图Fig.1 Sketch diagram of surface area increasing with the decreasing particle size
根据Nernst-Brunner/Noyes-Whitney方程[12]可知,药物溶出速率与药物的表面积成正比:
式中:dX/dt为溶出速率;Xd为药物溶解量;A为粒子的表面积;D为扩散系数;V为溶出介质体积;Cs为药物饱和溶解度;h为边界层厚度。随着粒子粒径的减小,粒子表面积增大,药物溶出速率随之增加。例如:阿瑞匹坦,粒径为120 nm的纳米晶体与粒径为5.5 μm的药物混悬液相比,由于粒径的减小,使得其表面积增加,进而增加了溶出速率和生物利用度[17]。
2.2饱和溶解度的增大
在溶剂和温度不变的情况下,药物的饱和溶解度通常被看作是常数,但这只适用于药物粒径在微米级以上的情况。当药物粒径小于1 000 nm时,随着粒径的减小,药物的饱和溶解度将显著增大,正如Freundlich-Ostwald方程[13]所述:
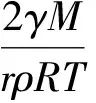
式中:S为小粒径药物的饱和溶解度;S∞为大粒径药物的饱和溶解度;γ为固液间的界面张力;M为药物的分子质量;r为粒子半径;ρ为固体药物的密度;R为气体常数;T为绝对温度。有研究人员报道,当将一种水难溶性抗菌化合物的粒径从2.4 μm减小到800 nm或300 nm后,其溶解度增加了1倍[12]。
另外,根据Kelvin公式,液滴粒径减小,表面曲率增加,饱和蒸汽压增大。同样情况也适用于固相(纳米晶)分散于液相(分散介质),随着粒径的减小,药物的溶解压力增加,饱和溶解度随之增大[16,18]。
3 纳米药物晶体制备方法
目前,纳米药物晶体制备方法主要可以归纳为2类:“Bottom-up”(从小到大)技术和“Top-down”(从大到小)技术[19]。前者是通过溶液中的分子结合,形成细小的纳米粒子沉淀或结晶而析出的方法,主要包括沉淀法、乳化法等。后者是将大的药物颗粒分散成小颗粒的方法,主要包括介质研磨法、高压均质法等。
3.1沉淀法
沉淀法始于20世纪80年代,由SUCKER等开发的水溶胶技术,该技术是一个典型的沉淀过程,称为“via humida paratum(VHP)”过程。该法的基本过程是先将难溶药物溶于溶剂(有机溶剂)当中,然后将此溶液加入可混溶的药物反溶剂(水溶剂)当中,搅拌,导致药物浓度过饱和,随之药物沉淀得到纳米药物晶体[16],如图2所示。
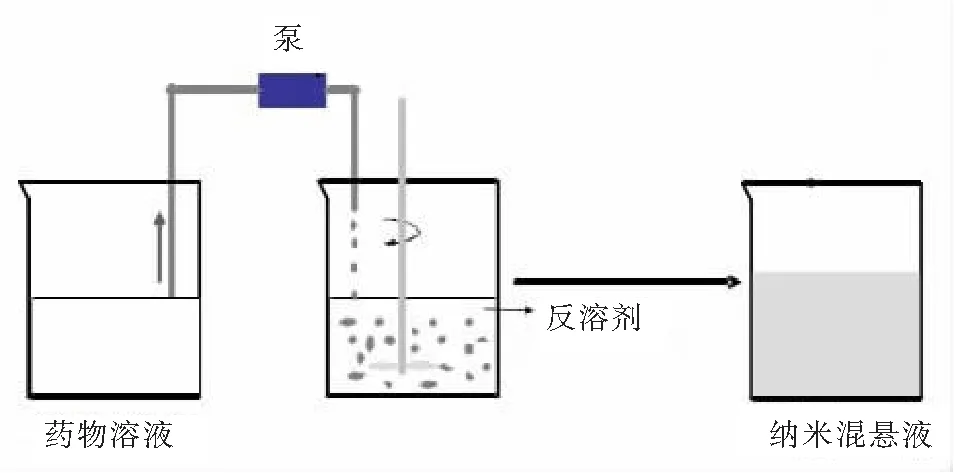
图2 沉淀法示意图Fig.2 Sketch diagram of precipitation technology
沉淀法制备过程中,随着搅拌速度的增加,两相之间的微观混合程度加强,使药物在两相之间的扩散程度增加,进而增加了药物在溶液中过饱和速度以及生成粒子的晶核数量[20]。增加反溶剂与溶剂体积比也可以增加药物的过饱和程度,加快药物成核。药物浓度的大小同样影响沉淀过程,过高的药物浓度会增加溶液的黏度,阻碍药物在两相间的扩散,导致药物浓度过饱和不均匀,使得到的药物颗粒粒径不均匀;另一方面,高浓度的药物会增加粒子之间聚集的机会,导致粒子长大[21]。
温度降低则饱和溶解度降低,药物的过饱和现象容易达到。此外,药物的成核过程是自由能降低和热量释放的过程,低温有利于成核过程。沉淀法晶核形成和生长的速度不易控制,纳米粒子易长大至微米级粒子,需加入稳定剂防止纳米粒子聚积长大。需要控制的主要工艺参数如下:1)搅拌速度;2)反溶剂与溶剂的体积比;3)药物浓度;4)温度;5)稳定剂及用量。
沉淀法的优点:1)过程简单,成本低,与介质研磨法和高压均质法相比,不需要昂贵的设备;2)能量消耗少,避免了高能量引入造成的药物变性或晶型改变;3)制备过程中,常常形成无定型状态药物,有利于增加药物的溶解度和溶出速率。
沉淀法的缺点:1)药物至少要溶于一种溶剂,不适用于油水均不溶药物;2)粒子形成过程需要严格控制,粒子易长大至微米级;3)由于有机溶剂的使用,存在溶剂残留问题,易引起产品污染。
由于存在以上问题,所以至今仍未见该法生产的产品上市。但沉淀法可作为高压均质前的预处理步骤,如Baxter 公司的Nanoedge技术[22]。
3.2介质研磨法
介质研磨法是一类典型的湿法研磨技术(wet milling)。20世纪90年代初,Nano System 公司(现为Elan公司))首先申请专利,将介质研磨法用于纳米药物晶体的制备,称之为“纳米晶体技术(nanocrystal technology)”[23]。目前该技术已成功上市了多个FDA认证产品。介质研磨法是将研磨介质和含有稳定剂的药物粗混悬液一起置于封闭的研磨室中,见图3,利用球磨机的高速转动,使药物颗粒、研磨介质和器壁之间产生强烈的相互碰撞和剪切力,以致固体颗粒粒径逐渐减小至纳米级别,最终得到纳米药物晶体。

图3 介质研磨法示意图Fig.3 Sketch diagram of media milling technology
研磨过程中会对粒子产生2种相反的效应:颗粒破碎成小粒子和粒子二次聚集长大。为得到纳米级粒子,应尽量减小粒子间相互碰撞的概率以避免粒子二次聚集长大。药物浓度和研磨时间是产生这两种相反效应的主要影响因素。药物浓度过高以及长时间的研磨会增加药物过多的碰撞机会,导致破碎的粒子二次聚集,所以应选择合适的药物浓度和研磨时间。研磨速度也应合理选择,过快的研磨速度会导致粒子聚集。
在研磨体系中,研磨介质越多,与药物的接触点越多,但是过多的研磨介质将增加设备的负重和能耗。同样质量的研磨介质,粒径越小,研磨珠与药物颗粒间的接触点就越多,使得药物和珠子间的碰撞频率增大,提高了研磨效果[24-25]。
纳米药物晶体属于热力学不稳定体系,纳米粒子的巨大比表面积将带来很高的表面能,使得纳米粒子间有相互聚集而降低体系表面能的趋势。因此,选择合适的稳定剂及浓度对于保持粒子聚集稳定性至关重要。此外,短暂的冷却步骤对粒径和粒径分布有重要影响。有研究显示,低温研磨会减慢粒子聚集过程并提高研磨效率。低温还可以增加粒子的易碎性,减小体系热量,利于体系研磨。在许多情况下,通过向研磨腔中通入液氮来降低温度[26]。
介质研磨法需要控制的主要工艺参数如下:1)药物浓度;2)研磨的时间和速度;3)研磨介质的大小和用量;4)稳定剂种类和用量;5)温度。
介质研磨法的优点:1)适用于油水均不溶药物的纳米晶体制备;2)易于实现生产规模扩大化,且批与批之间变异性较小;3)制备的纳米化产品粒度分布较窄;4)该法药物用量灵活,浓度范围大(1~400 mg/mL),可制备多种浓度的纳米混悬液[24]。
介质研磨法的缺点:1)制备过程中研磨介质的磨损和溶蚀造成产品污染;2)产品在研磨系统中表面黏附,造成药物损失;3)受研磨室体积限制,不易大批量生产[27-28]。
3.3高压均质法
高压均质法同样是用于制备纳米药物晶体的常用方法,主要包括微射流技术和活塞-裂隙(piston-gap)均质技术[20]。
1)微射流技术 通过喷射气流的方式,将药物混悬液加速通过特制的均质室,在管腔内经多次改变方向,导致微粒碰撞和剪切,从而减小粒径。同时,在高压和高速运动的气流作用下,也将产生空穴效应,使粒子不断减小。SkyePharma公司已运用该技术制备难溶性药物的亚微米级粒子[15]。该技术的主要缺点是耗时且效率不高,循环需多达50~100次,常得到微米级粒子,不利于生产扩大化。
2)活塞-裂隙均质技术 该过程可概述为3步:首先,将微粉化的原料药于含有稳定剂的溶剂中高速搅拌分散,制成药物粗混悬液;然后将药物粗混悬液低压均质循环适当次数,进行均质预处理;最后将预处理好的药物混悬液通过狭缝进行10~25次高压均质循环,直到符合粒度要求[29]。根据均质温度和分散介质的不同,该技术可以分为水相均质法(Dissocubes技术)和非水相-水相混合均质法(Nanopure技术)[15]。
Dissocubes技术是1998年由MULLER开发的专利技术(现为Skye Pharma公司拥有),主要是在水溶液中制备纳米晶体药物,目前采用该法上市的产品有非诺贝特片剂[30]。该法是将含稳定剂的药物粗混悬液在管道中高压推进,然后高速通过均质机的狭缝,经过多次均质循环后形成纳米晶体混悬液,如图4所示。粒子破裂细化主要是由于高压均质过程中产生的高剪切力、粒子间的碰撞以及空化效应。空化效应的形成是由于混悬液被高压泵导入均质机的狭缝时,横切面积大幅度减小,根据伯努利方程,液体的动压随管径减小而急剧增加,静压则急剧下降,液体在裂隙中沸腾并形成气泡,当混悬液离开裂隙时,静压力增至正常的大气压,气泡破裂,形成振荡波,破碎颗粒[31]。Dissocubes技术在制剂开发中得到了广泛应用,但也存在缺陷,如水敏感性药物易发生水解、热不稳定或低熔点药物的后续干燥过程成本昂贵[15]。

图4 活塞-裂隙均质技术示意图Fig.4 Sketch diagram of piston-gap homogenization technology
Nanopure技术是1999年由MULLER等开发的另一种高压均质方法,此项专利技术目前归PharmaSol公司所有,与Dissocubes技术不同,Nanopure技术是在非水溶媒或与水混溶的有机溶媒中制备纳米晶体。其分散介质包括PEG400,PEG600及乙醇-水或水-甘油等。相比Dissocubes技术,该技术有如下特点:1)适于水不稳定性药物的纳米化;2)对于在非水介质中制备得到的药物纳米混悬液可以直接灌注于软胶囊中;3)增加药物储存稳定性以及避免药物水解,如在熔融固体介质(PEG2000)中制备纳米晶体[32];4)将纳米混悬液转为固体产品时,由于分散介质含水量少,因而降低了蒸发所需能量,方便后续蒸发干燥过程,同时有利于温度敏感药物的制备。
增大均质压力,利于粒子粒径减小。均质过程中,压力越大,流体的动能越大,根据能量守恒定律,流体的静压能则越低,这就使得液体产生的气泡增多,最终导致破碎粒子的能量增大。
流体瞬间通过均质狭缝,即使在1.5×108Pa(1 500 bar)的高压下也难以将全部药物粒子粉碎成均匀的纳米晶体,这就需要增加均质的循环次数,提供更多的能量充分破碎药物。根据药物的硬度和粒度要求,高压均质需要设置3~10次或更多次循环。研究显示[11],均质循环次数与粒子粒径成反比关系。
均质循环次数不只影响药物粒径大小,还影响粒度分布。流体流速由管道中心向管壁方向逐渐减小,不同区域的流速不同,造成均质裂隙中能量分布不均,最终导致粒子粒度分布不均。增加循环次数将增加大粒子通过高能量区域的机会,使大粒子进一步破碎成小粒子,从而改善粒度分布[33]。
对于热敏感药物,温度是制备药物纳米晶体的重要影响参数。在高压均质过程中,体系温度会有所增加,不利于热敏感纳米药物晶体的制备,可在均质阀前设置热量转换器进行降温,样品温度可降至10 ℃以下。与介质研磨法类似,制备过程中需加入稳定剂以维持纳米体系的稳定。
高压均质法需要控制的主要工艺参数如下:1)均质压力;2)均质的循环次数;3)温度;4)其他参数,如药物浓度、稳定剂的种类及用量。
活塞-裂隙均质技术的优点与介质研磨法类似。缺点:1)需要对原料药进行微粉化;2)在高压均质之前,需要对药物混悬液进行高速搅拌分散和低压均质预处理。
3.4乳化法或微乳法
该类方法系将药物作为分散相溶于易挥发的有机溶剂或与水部分混溶的溶剂中制备成乳剂,然后对乳剂进行蒸发、搅拌、萃取等处理得到纳米药物晶体。该法主要包括以下2种方法。
第1种方法是将药物溶于有机溶剂或混合溶剂,分散于含有表面活性剂的水相中制成O/W型乳剂,再将乳剂通过升温减压或超声破碎等方式挥发有机溶剂,使药物沉淀形成纳米晶粒子。通过控制乳滴大小可以控制药物粒径大小。通常该法有机溶剂为丙酮、二氯甲烷、氯仿和相对安全的乙酸乙酯、甲酸乙酯等。
第2种方法是利用与水部分混溶的溶剂,如乳酸丁酯、苯甲醇、甘油醋酸酯等作为分散相,制成乳剂,然后加水稀释,使乳剂内相向外相扩散,从而析出药物,最后通过超速离心分离得到药物的纳米晶体[29]。对乳剂的稀释可以采用高压均质或磁力搅拌方法,前者效率更高。
影响粒子大小的因素有乳化剂、相比例、搅拌速度和蒸发速度等[15]。该法的优点:1)能量消耗低;2)易于通过控制乳滴大小来控制粒子粒径大小;3)制备过程简单。缺点:1)不适于油水均不溶纳米药物晶体的制备;2)需要高浓度的表面活性剂或稳定剂;3)有机溶剂残留,造成产品污染[34]。
3.5联用方法
联用方法是指将“Bottom-up”和“Top-down”2种方法联用,以其中某一方法作为预处理步骤,随后采用另外一种方法制备纳米药物晶体。1)Nanoedge技术是由Baxter公司开发的,是将沉淀法和高压均质法相结合,制备纳米药物晶体。该过程在沉淀法预处理得到的混悬液中加入高能量(如高剪切力),进一步破碎粒子,以避免沉淀法中粒子的生长。2)SmartCrystal技术被认为是第2代的纳米晶体制备方法。SmartCrystal技术是由PharmaSol公司开发的,2007年归Abbott公司所有,该技术是一系列联合方法的集合,可作为优化纳米晶体制备方法的“工具箱”[35]。例如:H96过程是将冷冻干燥法与高压均质法相结合,对药物冷冻干燥可以使原料药变得易碎[36];H42是将喷雾干燥与高压均质技术联用;此外还有介质研磨法、Nanopure与高压均质相结合的方法[12]。
3.6其他方法
其他制备方法包括超临界流体快速膨胀法(RESS)、流体喷雾冷冻法(SFL)、气溶胶溶剂萃取(ASES)等。RESS法是指溶有溶质的超临界流体超音速通过喷嘴时,流体瞬间减压膨胀,产生极高的过饱和度和高速扰动,使得溶质在极短时间内形成大量晶核,并生长形成微粒的过程[37]。SFL法是将药物分散在溶剂中制成纳米混悬液,再喷入液氮等低温液体进行雾化,最后经冷冻干燥制得纳米级粉末微粒[38]。ASES法是指超临界流体CO2与溶液经喷嘴进入预先装有超临界流体CO2的沉淀釜内,通过在沉淀釜中超临界CO2对溶剂的萃取吸收作用和溶剂分子向CO2的扩散作用,使溶质达到过饱和而沉淀析出[39]。
4 纳米药物晶体制备过程中使用的稳定剂
纳米药物晶体的制备通常是将药物分散于一定的介质(通常为水)中,该体系一般是由药物、分散介质、稳定剂组成的药物粗混悬液。在制备过程中,随着药物粒径的减小,粒子的表面自由能显著增大,粒子间产生相互聚集以降低表面自由能的趋势,同时纳米粒子强烈的布朗运动加剧了粒子间不断地相互碰撞[38],很容易发生聚集、结块、晶体生长或晶态改变等现象。因此,可在制备过程中加入1种或2~3种稳定剂混合使用,以解决粒子聚集或结块等问题。稳定剂主要分为离子型稳定剂(如阴离子型表面活性剂)和非离子型稳定剂(如非离子型表面活性剂、高分子聚合物)。离子型稳定剂主要通过静电排斥作用保持纳米体系稳定;非离子型稳定剂主要通过提供空间阻碍作用保持纳米体系稳定。
常用的非离子型表面活性剂是泊洛沙姆(如P188,P407等)和吐温80,阴离子型表面活性剂是十二烷基硫酸钠(SDS)。另外,天然的稳定剂如卵磷脂和胆酸衍生物,高分子聚合物如纤维素类(HPMC,HPC等)、聚乙烯吡咯烷酮(PVP)和聚乙烯醇(PVA)也较为常用。目前部分文献报道使用的稳定剂及已上市纳米晶体药物产品中使用的稳定剂分别见表1和表2。
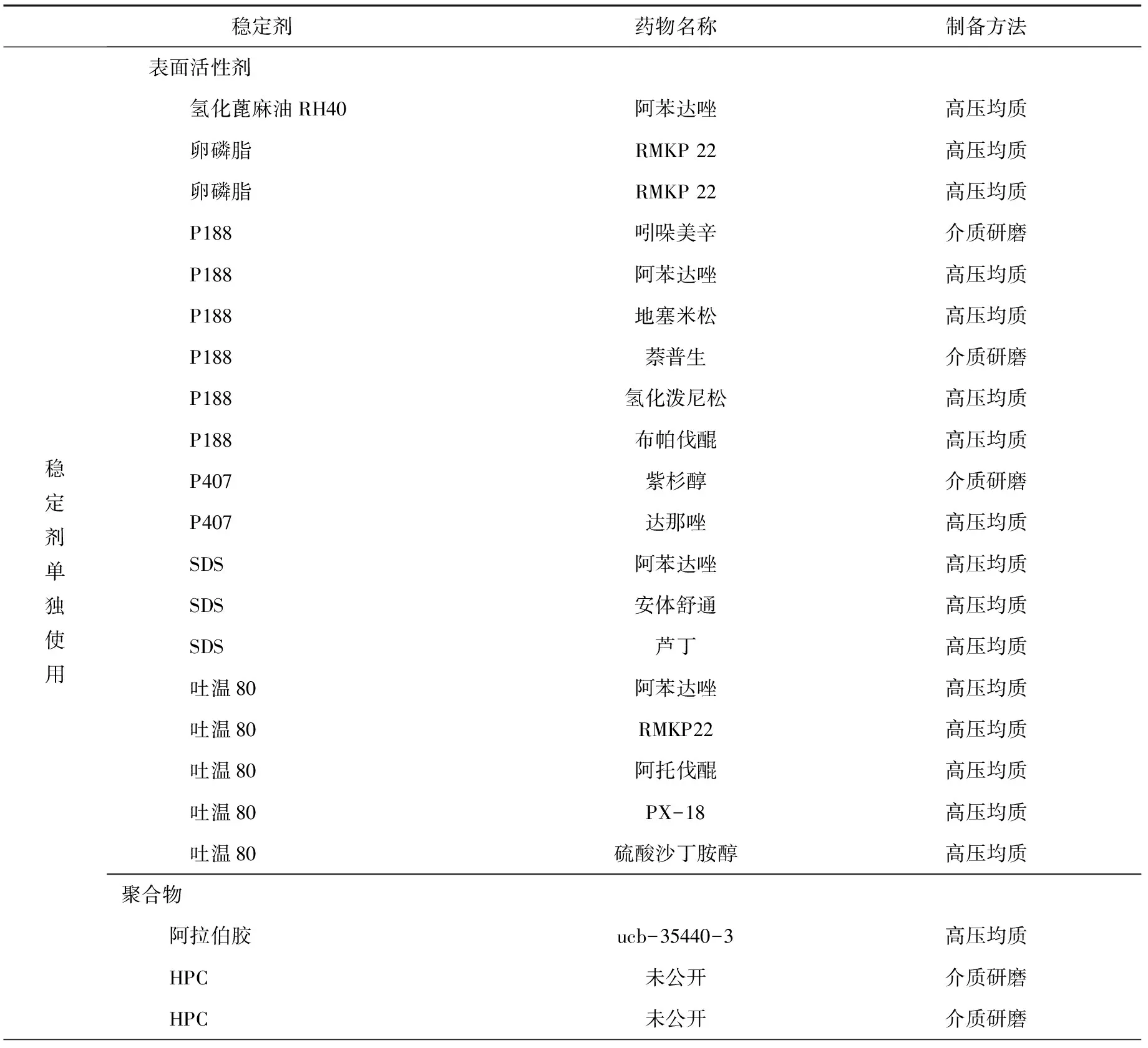
表1 部分文献报道中使用的稳定剂[40-41]Tab.1 Stabilizers mentioned in some literatures[40-41]
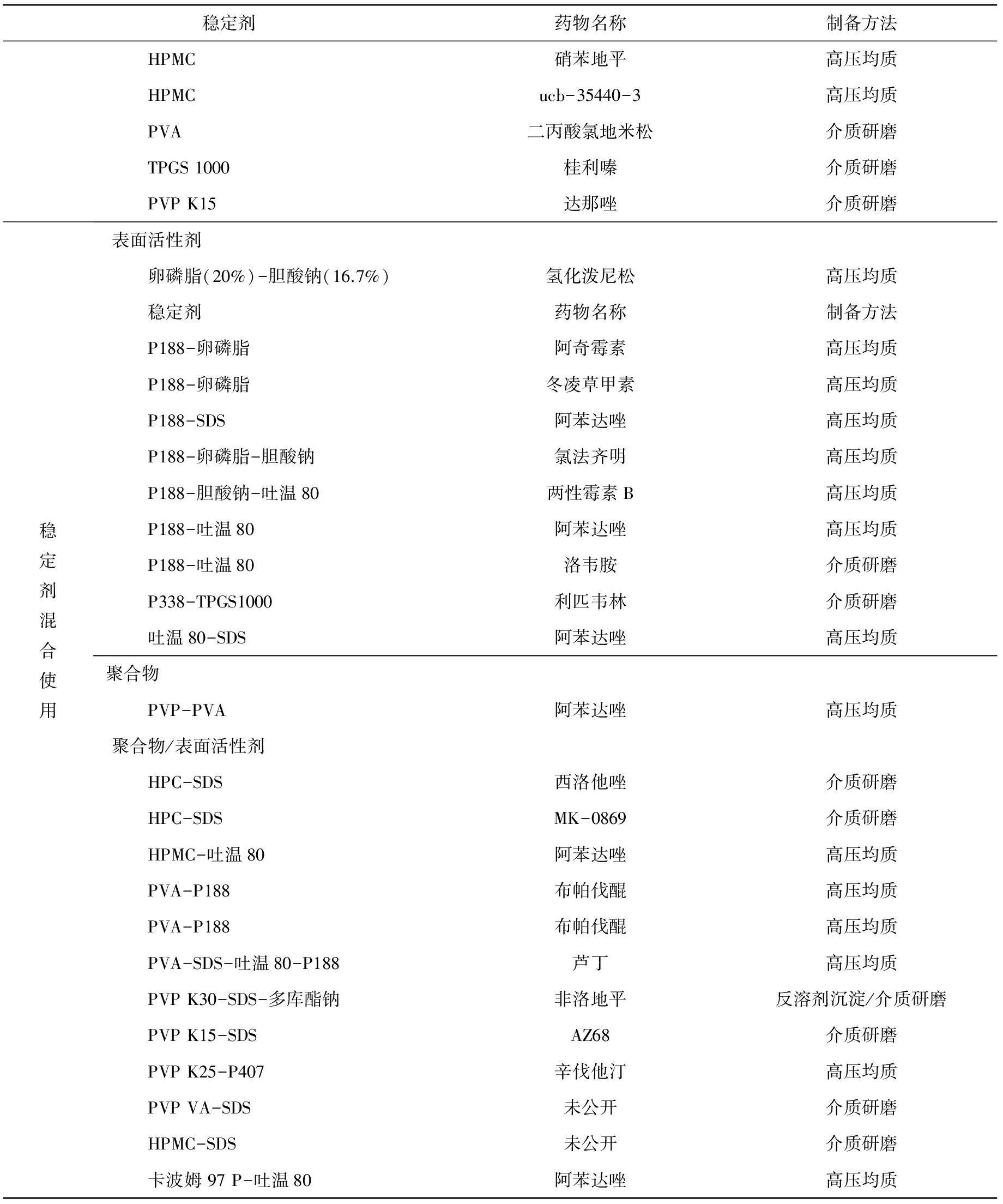
续表1
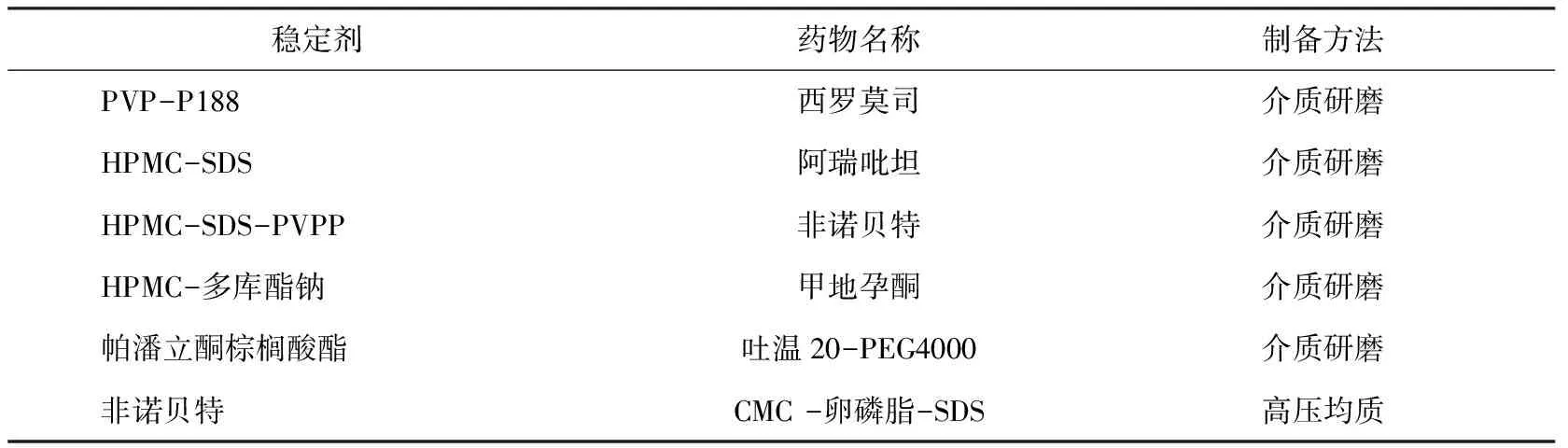
表2 已上市纳米药物晶体产品中的稳定剂[19,41]Tab.2 Stabilizers in marketed drug nanocrystals products[19,41]
5 市场应用简况
纳米药物晶体以其独特的优势应用于多种给药途径,如口服给药、注射给药、肺部给药、眼部给药、皮肤黏膜给药以及靶向给药等[42]。自20世纪90年代初提出纳米晶体药物定义至今,国外已有多个纳米药物晶体品种陆续上市或进入临床试验阶段,分别见表3和表4。

表3 部分已上市纳米药物晶体Tab.3 Some marketed drug nanocrystals

表4 部分临床实验阶段中的纳米药物晶体Tab.4 Some drug nanocrystals retained in clinical trials
第1个纳米药物晶体产品为西罗莫司片(商品名为Rapamune),2000年由惠氏公司上市,属于免疫抑制剂。该产品片重大约370 mg,每片含有1~2 mg西罗莫司,与西罗莫司原剂型口服液相比,西罗莫司不仅稳定性提高,而且方便携带和储存,同时,生物利用度比其口服液提高了至少21%[43]。
第2个纳米药物晶体产品为阿瑞吡坦胶囊(商品名为Emend),2003年由默克公司上市,属于止吐药,产品规格为80 mg和120 mg。2010年规格为40 mg的阿瑞吡坦胶囊又被批准上市,预防术后恶心呕吐。阿瑞吡坦纳米晶体以微丸为载体装于明胶硬胶囊中,在胃肠道上部快速溶出被吸收。
第3个纳米药物晶体产品为非诺贝特片(商品名为Tricor),2004年由雅培公司上市,用于降低胆固醇,规格为48 mg和145 mg。非诺贝特在进食状态下的吸收比空腹状态高35%,采用介质研磨法制备该纳米药物晶体产品,增加了药物溶解度和溶出速率,减小了食物效应对吸收的影响,降低了个体间差异[17]。此外,另一种非诺贝特片(商品名为Triglide)由Sciele Pharma Inc公司在2005年采用高压均质法制得而上市。
另一个纳米药物晶体产品甲地孕酮口服混悬液(商品名为Megace ES)于2005年由Par Pharmaceuticals公司上市,适应症为抗厌食、恶病质。甲地孕酮纳米混悬液规格为625 mg(5 mL),其原有剂型为普通口服混悬剂,规格为800 mg(20 mL)。纳米晶体技术不仅使甲地孕酮的口服给药体积量较少了3/4,还减小了食物效应的影响。Megace ES另一优势是液体黏度降低,增加了患者的顺应性[24]。
棕榈酸帕潘立酮注射液为第6个纳米晶体药物产品,于2009年由强生公司的子公司杨森制药有限公司宣布上市,用于成人精神分裂症的治疗。该产品为缓释混悬剂,可发挥长效作用,每月用药1次。
此外,已上市的纳米药物晶体产品还有硫酸吗啡、盐酸右哌甲酯、盐酸替扎尼定胶囊[43]。
6 结 语
纳米晶体技术是使药物本身纳米化,不受载体材料和包封率的限制。该技术制备的纳米药物晶体粒径小,能显著增加难溶性药物的饱和溶解度和溶出速率,并且适于多种给药途径,易于规模生产,日益受到药剂工作者和制药公司的关注,逐渐成为国际药学领域改善难溶性药物吸收、提高生物利用度的前沿性热点课题。目前发达国家已开发上市了多个纳米药物晶体制剂品种,并有多个品种进入临床试验阶段,显示出良好的发展前景和市场潜力。
/
[1] JENS-UWE A H,JUNGHANN S, RAINER H M. Nanocrystal technology, drug delivery and clinical applications[J]. International Journal of Nanomedicine, 2008, 3(3): 295-309.
[2] POPOVICH A A.药物剂型和给药体系[M].江志强,译.北京:中国医药科技出版社,2003. POPOVICH A A.Drug Dosage forms and Drug Delivery System[M]. Translated by JIANG Zhiqiang. Beijing: Chinese Medical Science and Technology Press, 2003.
[3] SERAJUDDIN T M.Salt formation to improve drug solubility[J]. Advanced Drug Delivery Reviews, 2007, 59: 603-616.
[4] BINDERUP E, BJORKLING F, HJARNAA P, et al. EB1627: A soluble prodrug of the potent anticancer cyanoguanidine CHS828[J]. Bioorganic & Medicinal Chemistry Letters, 2005, 15: 2491-2494.
[5] 陆 彬. 有关药物溶解度的研究现状与进展[J]. 中国药师, 2008, 11(5): 526-529. LU Bin. Research and progress of drug solubility[J]. China Pharmacist, 2008, 11(5):526-529.
[6] JONATHAN M M, ARIK D. Predicting the solubility-permeability interplay when using cyclodextrins in solubility-enabling formulations: Model validation[J]. International Journal of Pharmaceutics, 2012, 430: 388-391.
[7] SURAJIT D, KIONG N G, PARIJAT K, et al. Formulation design, preparation and physicochemical characterizations of solid lipid nanoparticles containing a hydrophobic drug:Effects of process variables[J]. Colloids and Surfaces B: Biointerfaces, 2011, 88: 483-489.
[8] XI Han, CHINMAY G, DANIEL T, et al. Simultaneous micronization and surface modification for improvement of flow and dissolution of drug particles[J]. International Journal of Pharmaceutics, 2011, 415: 185-195.
[9] ELAINE M,MERISKO-LIVERSIDGE G, LIVERSIDGE G. Drug nanoparticles: Formulating poorly water-soluble compounds[J]. Toxicologic Pathology, 2008, 36(1): 43-48.
[10] 王懿睿, 杜 光. 难溶性药物纳米混悬剂制备工艺及其应用[J]. 中国医院药学杂志, 2007, 27(11): 1573-1576. WANG Yirui,DU Guang. Preparation process and application of poorly-soluble drug nanosuspension[J].Chin Hosp Pharm J,2007, 27(11): 1573-1576.
[11] 张 熹,金 方. 纳米结晶在难溶性药物口服给药中的应用[J]. 中国医药工业杂志, 2009, 40(11): 851-855. ZHANG Xi,JIN Fang. Application of nanocrystal technology for poorly-soluble drug oral administration[J]. Chinese Journal of Pharmaceuticals, 2009, 40(11): 851-855.
[12] KESISOGLOU F, PANMAI P, WU Yunhui. Nanosizing-oral formulation development and biopharmaceutical evaluation[J]. Advanced Drug Delivery Reviews, 2007, 59: 631-644.
[13] MULLER R H, PETERS K. Nanosuspensions for the formulation of poorly soluble drugs (I):Preparation by a size-reduction technique[J]. International Journal of Pharmaceutics, 1998, 160: 229-237.
[14] GAO Lei, LIU Guiyang, MA Jianli, et al. Drug nanocrystals: In vivo performances[J]. Journal of Controlled Release, 2012, 160: 418-430.
[15] KATTEBOINAA S, CHANDRASEKHAR V S,BALAJI R.Drug nanocrystals: A novel formulation approach for poorly soluble drugs[J]. International Journal of PharmTech Research, 2009, 1(3): 682-694.
[16] MÜLLER R H, GOHLA S, KECK C M. State of the art of nanocrystals-special features, production, nanotoxicology aspects and intracellular delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2011, 78: 1-9.
[17] WU Yunhui, LOPER A, LANDIS E, et al. The role of biopharmaceutics in the development of a clinical nanoparticle formulation of MK-0869: A beagle dog model predicts improved bioavailability and diminished food effect on absorption in human[J]. International Journal of Pharmaceutics, 2004, 285: 135-146.
[18] MOSHARRAF M, NYSTROM C. The effect of particle size and shape on the surface specific dissolution rate of microsized practically insoluble drugs[J]. International Journal of Pharmaceutics, 1995, 122: 35-47.
[19] 郑爱萍, 石 靖. 纳米晶体药物研究进展[J]. 国际药学研究杂志, 2012, 39(3): 177-183. ZHENG Aiping, SHI Jing. Research progress in nanocrystal drugs[J]. J Int Pharm Res, 2012, 39(3): 177-183.
[20] DOUROUMIS D, FAHR A. Nano and micro-particulate formulations of poorly water-soluble drugs by using a novel optimized technique[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2006, 63: 173-175.
[21] ZHANG J Y,SHEN Z G, ZHONG J,et al. Preparation of amorphous cefuroxime axetil nanoparticles by controlled nanoprecipitation method without surfactants[J]. International Journal of Pharmaceutics, 2006, 323: 153-160.
[22] GMBH P, GERMANY B. Drug nanocrystals of poorly soluble drugs produced by high pressure homogenization[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2006, 62: 3-16.
[23] 夏怡然, 王 健, 朱金屏, 等. 纳米药物晶体的制备技术研究进展[J]. 中国医药工业杂志, 2010, 41(2): 134-140. XIA Yiran, WANG Jian, ZHU Jinping, et al. Progress on the preparation techniques of drug nanocrystals[J].Chinese Journal of Pharmaceuticals,2010, 41(2): 134-140.
[24] GAO Lei, ZHANG Dianrui, CHEN Minghui. Drug nanocrystals for the formulation of poorly soluble drugs and its application as a potential drug delivery system[J]. J Nanopart Res, 2008, 10: 845-862.
[25] 戎欣玉, 陈 涛, 郝小妹, 等. 介质研磨法制备阿奇霉素纳米晶[J]. 河北师范大学学报,2012, 36(5):502-508. RONG Xinyu, CHEN Tao, HAO Xiaomei, et al. Preparation of azithromycin nanocrystals by wet media technology[J].Journal of Hebei Normal University(Natural Science Editon),2012, 36(5): 502-508.
[26] PATRAVAVALE V B, DATE A A, KULKARNI R M. Nanosuspensions: A promising drug delivery strategy[J]. Journal of Pharmacy and Pharmacology, 2004, 56: 827-840.
[27] MATTEUCCI M E, MARGARET A,JOHNSTON H K P, et al. Drug nanoparticles by antisolvent precipitation:Mixing energy versus surfactant stabilization[J]. Langmuir, 2006, 22(21):8951-8959.
[28] NAYAK S, PANDA D, SAHOO J. Nanosuspension: A novel drug delivery system[J]. Journal of Pharmacy Research, 2010, 3(2): 241-246.
[29] ZHANG J, WU L B, CHAN H K, et al. Formation, characterization, and fate of inhaled drug nanoparticles[J]. Advanced Drug Delivery Reviews, 2010,62:1-15.
[30] 王 勤, 顾王文. 应用纳米技术增加难溶性药物吸收的研究进展[J]. 药学服务与研究, 2009, 9(1):48-51. WANG Qin, GU Wangwen. Advances inresearch on nanotechnology for enhancing the absorption of poorly water-soluble drugs[J]. Pharm Care & Res, 2009, 9(1): 48-51.
[31] 王胜峰, 姚 瑶, 丁劲松. 药物纳米混悬剂的形成与维持方法研究进展[J]. 解放军医学杂志, 2009, 34(10): 1257-1259. WANG Shengfeng, YAO Yao,DING Jinsong. Advances in research on formation and maintaining methods of drug nanosuspension[J]. Med J Chin PLA,2009,34(10):1257-1259.
[32] 蔡 霞, 刘春燕, 吕慧侠. 纳米药物制备工艺与设备研究进展[J]. 机电信息, 2011(8): 5-11. CAI Xia, LIU Chunyan, LYU Huixia. Research progress in nano-drug preparation technology and equipment[J]. Mechanical and Electrical Information, 2011(8):5-11.
[33] PU Xiaohui, SUN Jin, LI Mo, et al. Formulation of nanosuspensions as a new approach for the delivery of poorly soluble drugs[J]. Current Nanoscience, 2009, 5(4):417-427.
[34] 朱建芬, 吴祥根. 纳米混悬剂的制备方法及在药剂学中应用的研究进展[J]. 中国医药工业杂志, 2006, 37(3): 196-200. ZHU Jianfen, WU Xianggen. Research progress on preparation methods and application of nanosuspensions in the pharmacy[J]. Chinese Journal of Pharmaceuticals, 2006, 37(3):196-200.
[35] SALAZAR J,HEINZERLING O, RAINER H , et al. Process optimization of a novel production method for nanosuspensions using design of experiments (DoE)[J]. International Journal of Pharmaceutics, 2011, 420: 395-403.
[36] 周凯利, 易健民, 潘春跃, 等. 超临界流体快速膨胀法制备微粒的研究进展[J]. 应用化工, 2011, 40(7): 1039-1043. ZHOU Kaili, YI Jianmin, PAN Chunyue, et al. Research progress of RESS in particles formation[J]. Applied Chemical Industry, 2011, 40(7):1039-1043.
[37] 鲍 玉, 林贵梅, 栾玉霞, 等. 纳米混悬液的制备方法及其在药物输送中应用的研究进展[J]. 药物生物技术, 2011, 18(4): 364-368. BAO Yu, LIN Guimei, LUAN Yuxia, et al. Research progress on preparation methods and application in drug delivery of nanosuspensions[J]. Pharmaceutical Biotechnology, 2011, 18(4):364-368.
[38] 于文利, 赵亚平, 鹤 俊. 气溶胶溶剂萃取系统技术制备聚乳酸微细颗粒[J]. 化工学报, 2006,57(7): 1694-1697. YU Wenli, ZHAO Yaping, HE Jun. Preparation of PLA microparticles by ASES technique[J]. Journal of Chemical Industry and Engineering, 2006, 57(7):1694-1697.
[39] MÜLLER R H, SCHMIDT S, BUTTLE I, et al. SolEmuls○R-novel technology for the formulation of i.v. emulsions with poorly soluble drugs[J]. International Journal of Pharmaceutics, 2004, 269: 293-302.
[40] van EERDENBRUGH B,van den MOOTER G,AUGUSTIJNS P.Top-down production of drug nanocrystals: Nanosuspension stabilization, miniaturization and transformation into solid products[J]. International Journal of Pharmaceutics, 2008, 364: 64-75.
[41] WU L B, ZHANG J, WATANABE W. Physical and chemical stability of drug nanoparticles[J]. Advanced Drug Delivery Reviews, 2011, 63: 456-469.
[42] 张 越,徐世霞,于奕峰.PEG前药的合成研究进展[J].河北科技大学学报,2013,34(4):355-364. ZHANG YUE,XU Shixia,YU Yifeng.Study progress on the synthesis of PEG prodrug[J].Journal of Hebei University of Science and Technology,2013,34(4):355-364.
[43] SHEGOKAR R,MÜLLER R H.Nanocrystals Industrially feasible multifunctional formulation technology for poorly soluble actives[J].International Journal of Pharmaceutics, 2010,399:129-139.
Preparation technologies and applications of drug nanocrystals
WANG Lianqing1, RONG Xinyu1,2, LIU Kui3, HU Yi1, GAO Qian1, ZHAO Shuchun1,2, LI Xiaogen1, ZHANG Yuchi1
(1.School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang Hebei 050018, China; 2.Hebei Research Center of Pharmaceutical and Chemical Engineering, Shijiazhuang Hebei 050018, China; 3.School of Science, Hebei University of Science and Technology, Shijiazhuang Hebei 050018, China)
Drug nanocrystal technology is an innovative formulation approach to increase the solubility of poorly water-soluble drug. Drug nanocrystals arouse more and more attention from pharmaceutical workers and researchers because of their features such as small particle size, high drug loadings, increased saturation solubility and accelerated dissolution velocity. Based on the literature at home and abroad, the characteristics of drug nanocrystals, solubilization mechanism, preparation technologies, stabilizer used in its preparation and market applications are reviewed.
drug nanocrystals; poorly soluble drug; solubility; dissolution velocity; preparation method; market application
2014-04-14;
2014-05-09;责任编辑:张士莹
河北省自然科学基金(H2014208151);河北省人力资源和社会保障厅留学人员科技活动择优资助项目
王廉卿(1987-),男,河北邢台人,硕士研究生,主要从事药物制剂及药物质量方面的研究。
戎欣玉教授。E-mail: rongxy@163.com
1008-1542(2014)04-0339-10
10.7535/hbkd.2014yx04006
R944.9
A
王廉卿,戎欣玉,刘 魁,等.纳米药物晶体的制备技术及其应用[J].河北科技大学学报,2014,35(4):339-348.
WANG Lianqing, RONG Xinyu,LIU Kui,et al.Preparation technologies and applications of drug nanocrystals[J].Journal of Hebei University of Science and Technology,2014,35(4):339-348.

