125I标记重组融合蛋白dTMP-GH在小鼠体内分布的实验研究
, , ,,军平
(第三军医大学预防医学院全军复合伤研究所,创伤、烧伤与复合伤国家重点实验室,重庆市纳米医药工程技术研究中心,重庆 400038)
血小板减少症常见于放疗、化疗和骨髓移植患者,严重的血小板降低直接威胁到人们的生命安全[1]。目前,临床上治疗血小板减少症的主要方法为直接输注血小板,但因治疗费用昂贵导致使用受到限制。因此,寻找高效、廉价的升血小板药物就显得非常迫切和重要。我室通过基因重组技术成功将血小板生成素模拟肽(thrombopoietin mimetic peptide,TMP)和人生长激素(human growth hormone,hGH)进行融合,研制出重组融合蛋白dTMP-GH[2-3]。在此基础上,我室对该融合蛋白的发酵和纯化制备工艺进行了细致的研究,现已能获得纯度大于98%的重组融合蛋白dTMP-GH。作为一种新型升血小板因子,dTMP-GH具有显著的刺激巨核细胞增殖、分化的作用,以达到促进血小板生成的生物学活性[4],有望成为治疗造血功能障碍引起的血小板减少症的一种新方式。为了研究dTMP-GH在体内的分布情况,本研究制备了125I-dTMP-GH,并对其在小鼠体内的分布进行研究,证实dTMP-GH融合蛋白具有骨髓偏向性分布的特点,为进一步探索dTMP-GH促血小板生成作用的分子机制奠定了基础。
1 材料与方法
1.1 材料
融合蛋白dTMP-GH由本室自行制备,Na125I购自中国原子能科学研究院同位素研究所,快速薄层层析-硅胶纸(ITL-SG)购自美国Gelman公司,Sepdex 75层析柱购自美国GE公司,Iodogen(1,3,4,6-四氯3,6-二苯-甘脲)购自美国Sigma公司,偶联剂DOTA购自美国Macrocyclics公司,TRIS购自美国Angus公司,其他试剂均为国产分析纯。γ免疫计数仪 购自美国Perkin Elmer,电子天平购自沈阳龙腾电子,蛋白纯化仪AKTA prifier 10购自美国GE公司,紫外分光光度计购自BECKMAN公司。Bal b/c小鼠购自第三军医大学实验动物中心。
1.2 方法
1.2.1 dTMP-GH的制备 取dTMP-GH接种于Amp+LB平板,在37 ℃中培养18 h后挑取单克隆接种于Amp+LB液体培养基中培养过夜。将培养的dTMP-GH菌液接种到发酵罐中32 ℃扩增培养,5 h后变温至42 ℃诱导表达,诱导5 h后离心收取菌体。
1.2.2 dTMP-GH的纯化 将表达的dTMP-GH菌体按100 g/L用双蒸水重悬后进行高压匀浆破菌。破菌后,8 000 r/min离心弃去上清,沉淀用Buffer A(Tirs碱0.02 mol/L,尿素8 mol/L,pH 8.0)溶解。取dTMP-GH的溶解液过SP柱并收集穿透液,用透析法除去穿透液中的尿素。将透析完毕的dTMP-GH上Q柱,分别用浓度为0.05 mol/L、0.15 mol/L、0.5 mol/L和1 mol/L的NaCl进行洗脱,收集各洗脱组分电泳。选取电泳中纯度最高的dTMP-GH过分子筛Sepdex 75,收取目的蛋白用Bradford法测定浓度。
1.2.3125I-dTMP-GH的标记 利用氯胺-T法对dTMP-GH进行放射性碘标记。标记管中依次加入50 μl融合蛋白dTMP-GH(1.5 mg/mL),5 μl Na125I(19.6 MBq),10 μl氯胺-T(3 mg/mL,50 mmol/L PBS,pH 7.5),震荡反应5 min,加入20 μl Na2S2O3(8 mg/mL,50 mmol/L PBS,pH 7.5)终止反应。
1.2.4125I-dTMP-GH的纯化 采用Sepdex 75柱除去未结合的放射性碘。先用含1%BSA的PBS进行柱平衡过夜,再用PBS洗20个柱体积,加入样品,用PBS洗脱,分管收集,每管0.5 mL,共收集30管,分别取2 μl加入塑料测量管中用免疫计数仪测量每管放射性计数,并测定每管蛋白含量。将上述测量管中计数率高并且蛋白浓度大于20 μg/mL的混合,用PBS调整蛋白浓度至20 μg/mL,放置于4 ℃备用。
1.2.5125I-dTMP-GH生物学活性测定 将MO7e细胞培养至生长旺盛期时采取rhGM-CSF饥饿24 h后按2×105/mL浓度转接至96孔U型板中,每孔100 μl。按照10 ng/mL、20 ng/mL、50 ng/mL、100 ng/mL、200 ng/mL的药品终浓度分别加入125I-dTMP-GH和dTMP-GH每个孔6个复孔再培养48 h。培养完毕后每孔加入CCK-8试剂10 μl,再培养6 h后使用酶标仪于490 nm波长检测细胞光密度值。
1.2.6125I-dTMP-GH在小鼠体内分布 将5~7周龄20 g左右的Bal b/c小鼠随机分为3组,每组9只,腹腔注射0.1 mL 1 mg/mL的KI,其目的是抑制125I 与甲状腺的结合。30 min后按100 μg/kg的125I-dTMP-GH经小鼠尾静脉注射给药。给药后5 min、15 min、30 min、1 h、2 h、4 h、8 h、12 h、24 h断颈处死小鼠,分别取心、肝、脾、肾、股骨、甲状腺等器官,称重,测量各样品放射性计数。另取2 μg的125I-dTMP-GH作为注射总计数。
2 结果
2.1 融合蛋白dTMP-GH的纯化
收集流穿SP柱的dTMP-GH包涵体溶液,透析完毕再过Q柱,经分子筛Sepdex 75纯化后可得纯度大于98%的dTMP-GH(图1)。

图1 dTMP-GH的12%SDS-PAGE电泳图
2.2 125I-dTMP-GH的标记效果
125I-dTMP-GH标记物经Sepdex 75柱纯化后(图2),标记率为71.53%,放化纯度为96.53%,比活度为0.22 MBq/μl。

图2 125I-dTMP-GH经Sepdex 75柱纯化
2.3 125I-dTMP-GH对MO7e细胞体外增殖活性
将dTMP-GH和125I-dTMP-GH同时通过CCK-8法检测对MO7e细胞体外增殖活性作用(图3)。125I-dTMP-GH和dTMP-GH在10 ng/mL至100 ng/mL都呈现出随用药量的增加增殖效果越好,在100 ng/mL至200 ng/mL随用药量的增加增殖效果无明显变化。以100 ng/mL点为对比标记后比活性为标记前的93%,表明标记对dTMP-GH活性的影响不会影响实验结果。

图3不同浓度dTMP-GH与125I-dTMP-GH对MO7e细胞增殖效果的对比
2.4 125I-dTMP-GH在小鼠体内分布
尾静脉注射125I标记的dTMP-GH后,分别于各时间点取材、称重、检测放射性计数,并计算出每克组织含放射性计数量。如图4所示:小鼠注射125I-dTMP-GH后被迅速吸收和代谢,在30 min时股骨中放射性计数达到最高,之后随机体代谢含量逐渐降低,同时也提示肾脏是dTMP-GH主要代谢器官。
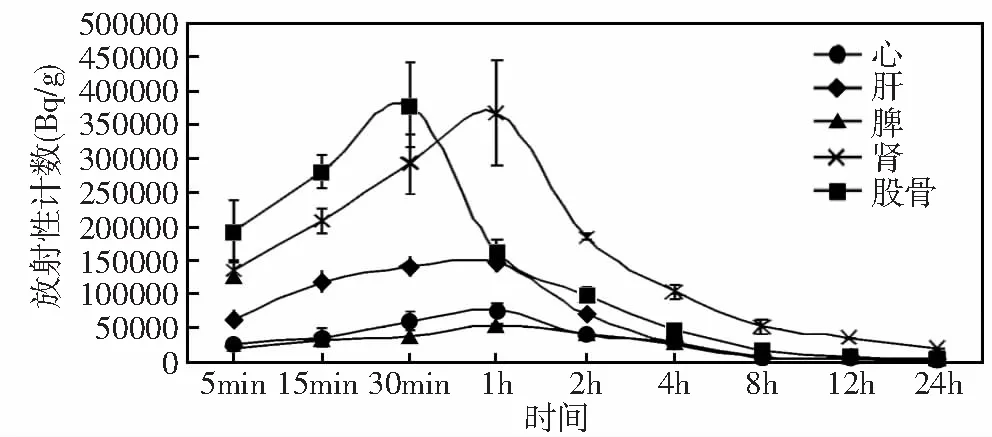
图4 125I-dTMP-GH在各组织不同时间分布
3 讨论
血小板生成素(thrombopoietin TPO),也称为巨核细胞生长发育因子(megakaryocyte growth and development factor,MGDF),是影响巨核细胞增殖、分化和血小板生成的重要细胞因子[5],可与巨核细胞的受体c-Mpl特异性结合,调节巨核细胞的分化和血小板的生成[6-9]。Cwirla等人[10]通过噬菌体表面展示技术筛选得到与天然TPO具有相似生物学活性的蛋白多肽TMP。TMP由14个氨基酸组成与天然TPO无同源序列,但可以与TPO受体(c-Mpl)高亲和力结合。已有实验证实,通过化学合成的TMP能够刺激依赖细胞株(Ba/F3/c-Mpl)的增殖分化,与rhTPO有相似生物学效性[9-12]。但由于TMP只有14个氨基酸组成,自身分子量太小,用基因工程方法制备难度较大,而进行大量的化学合成成本非常高。并且TMP是一条线性多肽,在体内循环过程中极易被降解、半衰期过短,所以TMP单体很难直接成药。本实验室在前期工作中通过基因重组技术将TMP分子与人生长激素进行融合,不仅可以增大分子量,使其能够进行基因工程制备,并使其体内半衰期得到延长。现已实现,融合蛋白dTMP-GH在成本低廉的大肠杆菌系统中高效表达,并已能获得纯度大于98%的dTMP-GH融合蛋白。本课题前期研究中已经发现dTMP-GH能够促进小鼠血小板升高,并对巨核细胞增殖作用明显[4]。
本文通过用放射性125I标记dTMP-GH的方法,进一步研究融合蛋白dTMP-GH在小鼠体内主要脏器动态分布情况。结果表明:被放射性碘标记的dTMP-GH经尾静脉注射入小鼠体内后,dTMP-GH经血液循环立即向骨髓聚集,在30 min时达到最高值(仅股骨的放射性计数就占到注射总量的10%),并随着时间推移逐渐降低。促使dTMP-GH具有骨髓偏向分布特性原因可能来自两个方面:一个方面来自dTMP-GH中的TMP,TMP是TPO的模拟物,要发挥其自身促血小板生成的生物学活性就必须要结合巨核系祖细胞表面的TPO受体c-Mpl。巨核系祖细胞是通过造血干细胞分化而来,而机体中富含造血干细胞最多的地方就是骨髓腔。另一个方面来自dTMP-GH中的GH,GH在临床主要用于烧伤患者和矮小症患者,它其中一个重要的生理功能就是能够促进骨骼生长;GH进入血液后可以高亲和结合人生长激素结合蛋白(growth hormone binding proteins,GHBP)[13-15],并通过GHBP将其运送至骨髓发挥生理功能。还有文献报道指出,rhGH对多系造血祖细胞的存活和增殖有直接作用[16],并能够促进辐射损伤小鼠骨髓造血功能重建[17],这说明GH与TPO有着相似或相关的信号通路。可能是GH通过与其受体(growth hormone receptor,GHR)的结合激活了这一生物学活性;该受体与c-Mpl为同一类细胞因子,都是巨核细胞表面受体,所以能够激活相似的信号通路。
血小板的体内生成过程主要有:造血干细胞→髓系造血祖细胞→巨核系祖细胞→前巨核细胞→成熟巨核细胞→血小板;体外实验证实,融合蛋白dTMP-GH可以促进巨核细胞生成血小板[4]。产生这一生物学效应的原因可能是:融合蛋白dTMP-GH进入机体后,通过与GHBP的结合将其运送至骨髓;在骨髓中TMP与c-Mpl结合,GH与GHR结合,而c-Mpl和GHR都是巨核细胞表面受体,二者共同刺激巨核细胞增殖、分化、产生血小板。本实验结果表明融合蛋白dTMP-GH具有显著的骨髓偏向分布特性,该特性可以提高dTMP-GH促巨核细胞增殖分化和血小板生成的生物利用度,降低使用用量和产生毒副反应危险,从一个侧面证实了前面提到的融合蛋白dTMP-GH促巨核细胞增值、产生血小板这一生物学效应的推测,并为今后深入研究dTMP-GH促血小板生成的分子作用机制提供了思路。同时,在实验中检测到在肾脏中放射性计数也比较高,肝脏的放射性计数第三,说明dTMP-GH在体内主要通过肝脏进行代谢,再由肾脏排出到体外或者部分直接由肾脏排出。通过本实验可以看出,骨髓是dTMP-GH在体内的重要靶器官之一,在体内时dTMP-GH通过肝脏进行主要的代谢,并且肾脏是其重要排泄器官。本实验为我们今后进一步研究重组融合蛋白dTMP-GH的分子作用机制奠定了基础。
[参考文献]
[1] Greenberg EM,Kaled ES.Thrombocytopenia[J].Crit Care Nurs Clin North Am,2013,25(4):427-434.
[2] Wang S,Shen M,Xu Y,et al.Rational and efficient preparation of a chimeric protein containing a tandem dimer of thrombopoietin mimetic peptide fused to human growth hormone in Escherichia coli[J].Appl Microbiol Biotechnol,2013,97(7):2885-2894.
[3] 王 崧,王军平,陈 默,等.重组融合蛋白rTMP-GH在巴斯德毕赤酵母中表达的研究[J].第三军医大学学报,2008,30(21):2037-2040
[4] 许 杨,王军平,赵景宏,等.重组融合蛋白rTMP-GH对体外培养巨核细胞增殖的影响[J].第三军医大学学报,2008,30(1):1-4.
[5] 叶祥忠,郭 强,李 朝,等.TPO模拟肽与人IgG1的Fc融合蛋白在毕赤酵母中的表达及活性鉴定[J].生物工程,2002,18(4):424-430.
[6] Tecuceanu N,Dardik R,Rabizadeh E,et al.A family with hereditary thrombocythaemia and normal genes for thrombopoietin and c-Mpl[J].Br J Haematol,2006,135(3):348-351.
[7] Cohn CS,Bussel JB.Romiplostim: a second-generation thrombopoietin agonist[J].Drugs Today (Barc),2009,45(3):175-188.
[8] Sakai R,Nakamura T,Nishino T,et al.Xanthocillins as thrombopoietin mimetic small molecules[J].Bioorg Med Chem,2005,13(23):6388-6393.
[9] Dower WJ,Cwirla SE,Balasubramanian P,et al.Peptide agonists of the thrombopoietin receptor[J].Stem Cells,1998,16(2):21-29.
[10] Cwirla SE,Balasubramanian P,Duffin DJ,et al.Peptide agonist of the thrombopoietin receptor as potent as the natural cytokine[J].Science,1997,276(5319):1696-1699.
[11] Kuter DJ.Biology and chemistry of thrombopoietic agents[J].Semin Hematol,2010,47(3):2743-2748.doi: 10.1053/j.seminhematol.2010.02.005.
[12] 袁志宏,奚永志,孔繁华.细胞因子模拟肽/非肽刺激造血的研究进展[J].中国实验血液学杂志,2002,10(1):73-76.
[13] Kratzsch J,Selisko T,Birkenmeier G.Transformed alpha 2-macroglobulin as a low-affinity growth hormone-binding protein[J].Acta Paediatr Suppl,1996,417:108-110.
[14] Lim L,Spencer SA,McKay P,et al.Regulation of growth hormone (GH) bioactivity by a recombinant human GH-binding protein[J].Endocrinology,1990,127(3):1287-1291.
[15] Woods KA,Fraser NC,Postel-Vinay MC,et al.A homozygous splice site mutation affecting the intracellular domain of the growth hormone (GH) receptor resulting in Laron syndrome with elevated GH-binding protein[J].J Clin Endocrinol Metab,1996,81(5):1686-1690.
[16] Hanley MB,Napolitano LA,McCune JM.Growth hormone-induced stimulation of multilineage human hematopoiesis[J].Stem Cells,2005,23(8):1170-1179.
[17] Carlo-Stella C,Di Nicola M,Milani R,et al.Age and irradiation-associated loss of bone marrow hematopoietic function in mice is reversed by recombinant human growth hormone[J].Exp Hematol,2004,32(2):171-178.

