固定化α-淀粉酶的制备及性能研究
耿志杰,林松柏,陈 军,许少波,刘群峰,张泽荣,张 锦
1.广东省医疗器械研究所 国家医疗保健器具工程技术研究中心,广东 广州 510500;2. 华侨大学,福建 厦门 361021;3.黎明大学,福建 泉州 362000
α-淀粉酶用于水解淀粉,切断α-1,4葡萄糖苷键产生麦芽糖、葡萄糖、寡糖和糊精等,作为一种重要的生物催化剂,具有高效、专一,反应条件温和的优良特性,广泛应用于生物医药、食品加工、啤酒酿造、石油化工等领域[1-3].但游离酶对外界环境(有机溶剂、酸碱、热等)极其敏感,易失活变性,并且在工业生产中游离酶混入产品后,分离、纯化困难,难以回收重复利用.由于游离酶存在这些缺陷,限制了其在工业生产中的广泛应用[4-5].选用合适的载体材料,采用物理或化学的方法进行酶的固定化,所得固定化酶不仅保留了酶原有的高活性、高选择性,克服了游离酶的缺点,而且有益于反应的连续化和自动化,在工业生产上具有极高的应用价值,因而具有广阔的发展前景[6].
采用传统的无机/有机复合材料或天然高分子固体材料为载体进行α-淀粉酶的固定化,由于受到载体材料的影响,实现α-淀粉酶重复利用性的同时,酶活性却大大降低.基于水凝胶具有三维网络结构,能够吸收大量的水,溶胀而不溶解的性质,能够提供酶催化反应所需的微环境,保证酶分子的活性构象运动.本文以具有生物相容性的P(DMAA-co-AM)凝胶为载体固定α-淀粉酶,提高了α-淀粉酶的使用性能.
1 主要实验试剂
丙烯酰胺(AM,广东汕头西陇化工厂);N,N-二甲基丙烯酰胺(DMAA,南通沃兰化工有限公司);α-淀粉酶(广东环凯生物科技有限公司);过硫酸铵(APS,广东汕头西陇化工厂);N,N-亚甲基双丙烯酰胺(MBA,国药集团化学试剂有限公司);可溶性淀粉(广东汕头西陇化工厂).
2 固定化α-淀粉酶的制备
分别取一定量的 N,N-二甲基丙烯酰胺(DMAA)和丙烯酰胺 (AM)溶于去离子水中,配成混合溶液,然后加入适量α-淀粉酶溶液充分搅拌,使其形成均匀的混合液,再加入一定量的交联剂(N,N-亚甲基双丙烯酰胺(MBA))和引发剂(过硫酸铵(APS)),搅拌均匀便得到反应混合液.于50 ℃水浴锅中充分反应一定时间,即可得到P(DMAA-co-AM)固定化α-淀粉酶凝胶粗样.最后用缓冲溶液充分冲洗制得的固定化α-淀粉酶凝胶粗样,把附着在固定化酶凝胶表面的游离α-淀粉酶冲洗掉,即得固定化α-淀粉酶.
3 结果与讨论
3.1 温度对固定化α-淀粉酶活性的影响
图1为温度对固定化α-淀粉酶和游离酶活性的影响.由图1可见,在30~90 ℃范围内,随着温度的升高,固定化酶和游离酶的活性均呈先升后降的趋势.游离酶的活性在50 ℃时达到最大,而固定化酶的最大活性温度提高10℃.当反应温度超过固定化酶和游离酶各自的最大活性温度后,随着温度升高,游离酶活性降低的趋势较固定化酶活性降低的趋势更显著,说明在较高温度下固定化酶较游离酶具有较好的稳定性.这是因为,α-淀粉酶被载体P(DMAA-co-AM)凝胶固定后,载体对α-淀粉酶分子构象具有一定的保护作用,使固定化酶的活性受温度的影响降低.
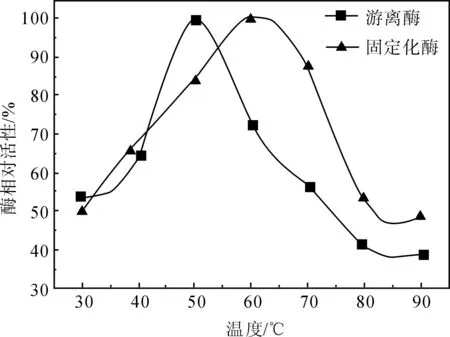
图1 温度对α-淀粉酶活性的影响
Fig.1Influence of temperature on relative activity of a-amylase
3.2 pH对固定化α-淀粉酶活性的影响
图2为pH对固定化α-淀粉酶和游离酶活性的影响.由图2可知,在pH为5.0~8.0的范围内,固定化酶和游离酶的活性随反应液pH的增大均呈先升后降的趋势,实验测得最适pH分别为6.0和6.6,但固定化酶的最适pH有所拓宽.对于游离酶,当反应液pH大于6.0后,继续增大pH,其活性明显降低;而在pH为6.6~7.6范围内,固定化酶保持较高的活性,pH超过7.6后,随pH的增大,固定化酶的活性急剧降低.这是因为,酶是一种蛋白质,构成酶分子的氨基酸残基的解离状态影响酶分子中的电荷分布,从而影响不同pH条件下的酶活性,催化产物呈现的电性也影响酶的最适pH.α-淀粉酶分解可溶性淀粉,生成以麦芽糖为主的产物,在pH<7的环境中-OH中的H易解离出来,改变溶液的pH大小,导致固定化酶的最适pH向高pH处偏移.在可溶性淀粉的分解中,α-淀粉酶的催化能力对pH很敏感,当反应液pH值高于最适pH值后,游离酶的活性明显降低,游离酶的催化能力急剧下降.而α-淀粉酶被P(DMAA-co-AM)凝胶固定后,α-淀粉酶分子结构受到凝胶网络的保护,使其在较高的pH范围仍具有较好的活性,说明固定化酶活性对pH具有很好的稳定性.

图2 pH对α-淀粉酶活性的影响
3.3 酶促反应动力学


图3 固定化α-淀粉酶和游离酶的米氏方程
Fig.3Michaelis-Menten Kinetics equation of free and immobilization a-amylase
本实验中,取适量的固定化α-淀粉酶和游离酶分别与20 mL不同浓度的可溶性淀粉溶液在各自适宜的pH和温度下精确反应20 min,计算出其反应速率,然后用双倒数作图法以1/V对1/[S]作图,得到图3.游离酶的米氏方程为:Y=0.39047+2.01403X,R=0.9976(Y代表1/V,X代表1/[S],下同);固定化α-淀粉酶的米氏方程为:Y=1.92746+2.56425X,R=0.9988.结合米氏方程,由图3求出游离酶的米氏常数(Km)和最大反应速率(Vmax)分别为5.16 mg/mL和2.56 mg/min;固定化酶的米氏常数(Km)和最大反应速率(Vmax)分别为1.33 mg/mL和0.52 mg/min.固定化α-淀粉酶的米氏常数小于游离酶的,说明固定化酶具有更好的底物亲和性.P(DMAA-co-AM)凝胶网络与α-淀粉酶分子间的物理或化学作用,促使固定化α-淀粉酶更倾向于与淀粉溶液亲和.固定化α-淀粉酶的最大反应速率小于游离酶的,是由于游离酶均匀地分散在淀粉溶液中,而固定化α-淀粉酶被束缚在P(DMAA-co-AM)凝胶网络中,与淀粉溶液的接触机会少于游离酶与淀粉溶液的接触机会,导致固定化酶的Vmax较小.
3.4 固定化α-淀粉酶的操作稳定性

图4 固定化α-淀粉酶的操作稳定性
Fig.4The operational stability of immobilization a-amylase
图4是固定化α-淀粉酶重复操作6次表现出的稳定性.在温度为60 ℃和pH=6.6的条件下,适量的固定化α-淀粉酶与20 mL质量分数1%的可溶性淀粉溶液反应,测出其酶活力,计第一次测得的酶活为100%,以重复6次反应的酶相对活性作柱状图得图4.由图4可知,固定化α-淀粉酶重复操作6次后,酶活仍可达到73%,说明固定化α-淀粉酶的操作稳定性良好.酶活下降的主要原因是,在制备固定化α-淀粉酶的过程中,为将粘附在固定化酶凝胶表面的游离α-淀粉酶除去,虽然用缓冲溶液充分洗涤,但在实际操作中仍会有部分游离酶粘附在固定化酶凝胶表面未被除掉.因此,固定化α-淀粉酶重复操作时,不可避免地会有α-淀粉酶流失,致使循环使用α-淀粉酶分解可溶性淀粉时酶活性表现出依次降低的现象.
3.5 固定化α-淀粉酶的储存稳定性
将固定化α-淀粉酶和游离酶储存在4 ℃冰箱中每隔10天分别测其酶活性,其中分别计其初始酶活为100%,固定化酶和游离酶受储存时间的影响如图5所示.从图5可以看出,储存一定时间后,固定化α-淀粉酶的活性较游离酶降低趋势平缓;储存70天后,固定化α-淀粉酶可保持近60%的酶活,而游离酶的活性已降至26%.因为游离的α-淀粉酶经储存后,酶分子构象发生变化,酶活性下降,而固定化α-淀粉酶因受载体保护,分子构象不易改变,使固定化酶活性下降趋势减缓,因此固定化α-淀粉酶的储存稳定性较游离酶明显提高.
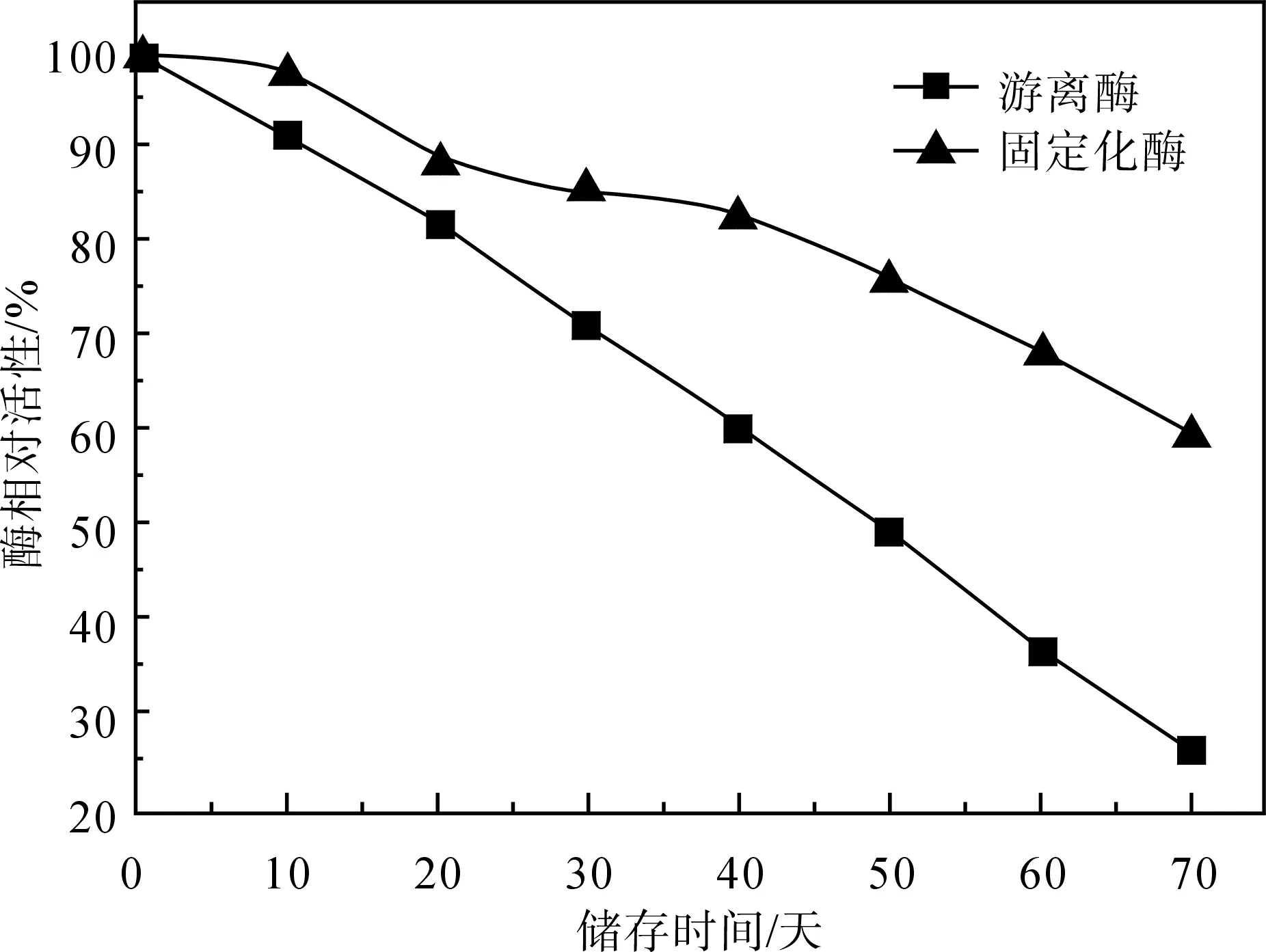
图5 游离酶和固定化α-淀粉酶的储存稳定性
Fig.5The storage stability of free and immobilization a-amylase
4 结 论
以P(DMAA-co-AM)凝胶为载体,通过原位固定法制备了固定化α-淀粉酶,改善了游离酶理化性质不稳定、易失活变性,不能重复使用等缺点.固定化酶具有更好的底物亲和性,固定化酶和游离酶的米氏常数(Km)分别为1.33,5.16 mg/mL,最大反应速率(Vmax)分别为0.52,2.56 mg/min.与游离酶相比,固定化酶具有良好的操作稳定性和储存稳定性.固定化α-淀粉酶的活性最适温度为60℃,较游离酶提高了10 ℃;固定化α-淀粉酶的酶活最适pH由游离酶的6.0提高到了6.6.α-淀粉酶经载体固定后具有更好的温度和pH稳定性,同时拓宽了α-淀粉酶的温度和pH使用范围.α-淀粉酶经过载体固定化后的性能得到明显改善,这为α-淀粉酶在工业生产中的应用提供了重要依据.
参考文献:
[1] 冯健飞.α-淀粉酶的应用及研究进展[J].现代农业科技,2010(17):354-355.
[2] 王慧超,陈今朝,韩宗先.α-淀粉酶的研究与应用[J].重庆工商大学学报,2010,27(4):368-372.
[3] 李勃,党永,马瑜,等.黑曲霉Tx-78耐酸性α-淀粉酶的分离纯化及其性质研究[J].微生物学杂志,2008,28(4):30-34.
[4] MANZANO M F G,IGARZABAL C I A.Immobilization of lipase from Candida rugosa on synthesized hydrogel for hydrolysis reaction[J].Molecular Catalysis B: Enzymatic,2011,72(1-2):28-35.
[5] 陈莉敏,李柱来,王津.固定化α-淀粉酶的研究[J].海峡药学,2006,18(5):59-61.
[6] LEE Wen-fu,HUANG Chi-tai.Immobilization of trypsin by thermo-responsive hydrogel for the affinity separation of trypsin inhibitor[J].Desalination,2008,234:195-203.

