消油剂和120#燃料油对海胆DNA损伤及甲基化影响*1
杨柏林,高亚丽,姜玲玲,刚 锰,熊德琪
(大连海事大学 环境科学与工程学院,辽宁 大连 116026)
消油剂和120#燃料油对海胆DNA损伤及甲基化影响*1
杨柏林,高亚丽,姜玲玲,刚 锰,熊德琪*
(大连海事大学 环境科学与工程学院,辽宁 大连 116026)
利用120#燃料油分散液和消油剂处理的乳化液测定海胆急性毒性和慢性DNA损伤及全基因组甲基化水平变化,确定消油剂处理的120#燃料油对海胆的毒性影响。结果表明:消油剂单独使用对海胆的影响微乎其微,经消油剂处理的燃料油乳化液中的多环芳烃质量浓度明显高于分散液中的质量浓度;乳化液和分散液对海胆都有明显的毒性作用,其96 h半数效应浓度(EC50)值分别为12.03 g/L和29.15 g/L;DNA损伤研究表明,乳化液处理的海胆肠细胞彗星拖尾情况比同质量浓度分散液中拖尾情况更加严重;全基因组甲基化水平比分散液中更低,表明乳化液的急性毒性更大,所造成的DNA损伤更加严重。结果提示消油剂的使用会增大燃料油对海胆的毒性效应。
消油剂;120#燃料油;海胆;DNA损伤;甲基化
石油泄漏对当地的植物群和动物群的影响是灾难性的[1-3]。目前,处理溢油的主要措施为物理去除和化学分散相结合的处理措施。化学分散主要凭借消油剂中的表面活性剂组分的作用,而消油剂的化学分散只会将水体表面的油膜分散成微小油滴进入水体中[4]。然而,在近岸区域消油剂的使用就不存在优点了,在近岸由于水体中的油滴不容易受到稀释,可以引起敏感生态系统短时间内暴露于高浓度石油污染之下,从而对海洋环境造成致命的损害。
目前,国外对于消油剂和溢油的联合毒性方面研究比较重视,主要研究对象为鱼类、藻类和贝类等物种,而且研究普遍认为消油剂的使用会增大溢油的生态污染,如:Shahunthala等[5]用不同盐度的海水测定化学分散原油对虹鳟鱼的影响,实验证明了化学分散原油增加了多环芳烃对鱼类的暴露机会[6],比较48 h的半数效应浓度(EC50)时,得出投加化学分散剂的原油的EC50值远远小于未投加分散剂的EC50值。 Milinkovitch[7]在化学分散油对薄嘴鲻的幼鱼的生物积累和死亡率影响的研究中发现,化学分散油相比未经消油剂处理的油滴具有更大的多环芳烃浓度,以及更高的致死率;在湍流混合区消油剂的应用会增大对水体生物的环境风险。国内目前对消油剂的研究大多为对浮游生物的研究,黄逸君等[8]、张蕾等[9]和徐会等[10]研究了消油剂及原油对桡足类和浮游植物的急性毒性效应,对底栖生物的研究也是研究轻质柴油居多[11-13],在消油剂和重质燃料油复合效应方面的研究明显不足。而仅仅少数学者认为消油剂的使用会降低石油污染的生物效应。为了确定消油剂和石油污染的毒性作用机制,评价两者的联合毒性效应,有必要做进一步的生物毒性研究。
本研究选择比较常见的船舶燃料120#燃料油,主要目的通过研究重质船舶燃料油的机械分散液和消油剂分散的乳化液对海胆的96 h急性毒性及21 d DNA损伤情况、全基因组甲基化水平,来评价重质燃料油和消油剂对底栖生物海胆的毒性影响。以便为近岸溢油处理提供理论数据,为建立近岸地区消油剂使用政策提供一个全面的框架。
1 材料和方法
1.1 材 料
1)受试生物:马粪海胆(Hemicentrotuspulcherrimus)购自大连海宝海珍品有限公司,平均直径3.5 cm,体重(11.4±0.8) g。将受试海胆在实验室内室温(18±0.5) ℃暂养一周后,选择正常健康个体,按照不同培养液浓度分组分别进行实验,每个浓度组设置3个平行组,每个平行组中3个个体。
2)待测油品: 120#船舶燃料油由大连船舶燃料油公司提供。溢油分散剂:“919”型消油剂。
1.2 方 法
1)分散液和乳化液的制备
(1)分散液的配置:
选用容量为2 L的大烧杯,放入转子,加入一定比例的燃料油和过滤海水,烧杯口用保鲜膜和锡纸密封,然后用磁力搅拌器进行恒速搅拌24 h,搅拌结束后再静止4 h,除去表面油膜即为分散液。
(2)乳化液的配置:
在水体中加入和分散液对应实验组等量的燃料油,并加入燃料油投放量20%的消油剂,其他条件和配置分散液相同。
2)急性暴露:海胆在毒性暴露前24 h停止饵料投喂,暴露过程中不进行喂食。根据预实验设定分散液质量浓度为5,10,20,40和80 g/L;乳化液质量浓度2.5,5,10,20和40 g/L。观察并记录海胆暴露96 h的状态,将附着能力下降、刺体脱落及死亡个体记为受抑制海胆。
3)慢性暴露:根据预实验设定质量浓度4.50,2.25,1.13,0.56,0.28 g/L,对海胆进行7,14和21 d的暴露实验。将实验分为3组进行:第1组为对照组(海水对照和消油剂海水对照组);第2组为海水和120#燃料油分散液实验组;第3组为海水、消油剂和120#燃料油组成的乳化液实验组。暴露过程中,每隔1 d更换一次受试溶液,并进行投饵,每天光照时间为12 h,对海胆的异常发育情况进行观察拍照。
4)DNA损伤测定(单细胞凝胶电泳SCGE):暴露7,14和21 d的海胆,将其肠组织的细胞制成单细胞悬液,然后进行制片,采用三层“汉堡式”铺片法,第1层和第3层为正常熔点的琼脂糖,中间层为含有肠组织单细胞悬液的低熔点琼脂糖。制片后,4 ℃下裂解2 h,然后解旋20 min。DNA解旋完成后进行30 min低温电泳,电泳后取片中和15 min,最后进行EB染色并在荧光显微镜下观察拍照。
5)气相色谱-质谱联用海胆组织及分散液和乳化液样品的预处理
(1)萃取:取0.05 g海胆肠组织(分散液和乳化液的预处理时,萃取体积取2 mL),用乙酸乙酯/正己烷混合液萃取3次:第1次加3 mL混合液,混匀床震荡30 min后,抽取萃取液;第2次和第3次分别加2 mL混合液,重复上述步骤。
(2)过柱:称取5.5 g硅胶、无水硫酸钠和正己烷进行装柱,用胶头滴管将萃取液加入玻璃层析柱中,放空。再加入正己烷/二氯甲烷混合液40 mL,放空。
(3)旋蒸:在旋转蒸发仪上将过柱后的样品溶液进行旋转蒸发,直至溶液残余表面直径为2.5 cm大小。用胶头滴管取出剩余溶液置于试管中,再加正己烷润洗旋蒸瓶,将剩余液也置于试管中。
(4)氮吹:将上述试管中的溶液在氮吹仪器上吹至1 mL以下,然后再用异辛烷定容至1 mL。
(5)装瓶标号:将最后定容的1 mL样品装入色谱专用瓶中,进行编号,并置于-20 ℃保存,上机测定。
6)气相色谱-质谱条件
气相色谱-质谱联用仪选用美国Agilent公司生产的7890A/5975C型气相色谱-质谱联用仪,具体条件如下:
载气:He;流量:0.8 mL/min;色谱柱:HP-5MS 30 m×0.25 mm×0.25 μm;进样方式:自动、不分流;进样量:0.2 μm;进样口温度:280 ℃;检测器温度:250 ℃;柱温程序:初始 50 ℃恒温l min后以80 ℃/min的速率升温至280 ℃恒温10 min,再以 10 ℃/min的速率升温至300 ℃,恒温保持10 min。离子化方式:EI;离子化能量:70 eV;离子化电流:300 μA;离子源温度:200 ℃;扫描范围 :50~550 amu自动调谐;质谱检索:采用NIST98谱库检索。
7)甲基化实验
(1)样品预处理:将暴露于不同污染条件下的海胆组织进行DNA提取,DNA提取方法采用经典的酚仿抽提法,为了去除RNA对DNA提取结果的影响,利用核酸酶T1和核酸酶A对DNA进行纯化,将25 μL体积分数为70%的HClO4与纯化的50 μL DNA进行混合,在水浴锅中进行水解(80 ℃),水浴时间为5 h,用 2 mol/L KOH将混合液的pH值控制在3~5,调节pH过程中,由于HClO4和KOH反应会有白色沉淀(KClO4)产生,反应结束后在低温(-20 ℃)静置12 h。将处理好的DNA在离心机中离心(转速为12 000 r/min)30 min,并提取上清液。经上述处理的DNA直接加入到高效液相色谱仪中进行样品测定。
(2)色谱条件:
液相色谱选择美国Water公司生产的Waters 2489型高效液相色谱仪,具体色谱条件如表1所示。

表1 色谱条件Table 1 Chromatographic conditions
将柱子用体积分数40%的甲醇冲洗30 min,再用体积分数10%的甲醇冲洗30 min,最后用流动相平衡基线。开始进样测定,样品的上样量为10 μL。首先用标准品确定标准溶液中两种组分:胞嘧啶(dC)和5-甲基胞嘧啶(5-dmC)的保留时间和峰面积;将未知样品进样,通过与标准品峰型作比较,确定被测溶液中所含的两种待测成份(dC)和(5-dmC)的浓度。
1.3 数据处理
1)急性毒性的实验数据通过软件Origin 8.0对急性毒性数据散点平均值进行非线性拟合,并得出拟合函数,通过相应的拟合函数计算出96 h 的EC50值。
2)用ACDSEE9.0软件将彗星照片转换为400像素×300像素大小,格式为TIFF,然后用CASP彗星图像分析软件(http:∥www.casp.of.pl)自动分析,分析指标为尾长(TL)、尾部DNA百分量(TDNA%)。
3)根据dC和5-dmC的分子量,把以上两物质的浓度转换成质量浓度,计算每个样品中5-dmC×100%/(dC+5-dmC)的比值,即为DNA甲基化水平。
2 实验结果和讨论
2.1 分散液和乳化液中燃料油水溶组分成分分析
在整个暴露过程中,空白对照组中没有检测到多环芳烃,而分散液和乳化液的水溶组分中的多环芳烃被检测到并列于表2。由表2可以看出120#燃料油的分散液和乳化液中主要包含21种多环芳烃,而其中的16种多环芳烃(包括萘、苊烯、苊、芴、菲、蒽、荧蒽、芘、苯并(a)蒽、屈、苯并(b)荧蒽、苯并(k)荧蒽、苯并(a)芘、茚并(1,2,3-cd)芘、二苯并(a,h)蒽、苯并(g,h,i)芘被美国环保局列为优先污染物。对比分散液和乳化液中组分质量浓度的变化可以发现,乳化液中多环芳烃的质量浓度比分散液中质量浓度有不同程度的增大。这些多环芳烃都是对生物造成毒性损害的潜在污染物。

表2 120#燃料油分散液和乳化液水溶组分中的多环芳烃质量浓度Table 2 Concentrations of polycyclic aromatic hydrocarbons in the dispersion and emulsion of 120# fuel oil
2.2 急性毒性试验结果
根据96 h幼海胆的状态记录,将质量浓度log值和抑制率平均值分别作为横纵坐标,绘制出120#燃料油质量浓度抑制率曲线(图1),并选择拟合率>99%的函数进行拟合,拟合结果列于表3。
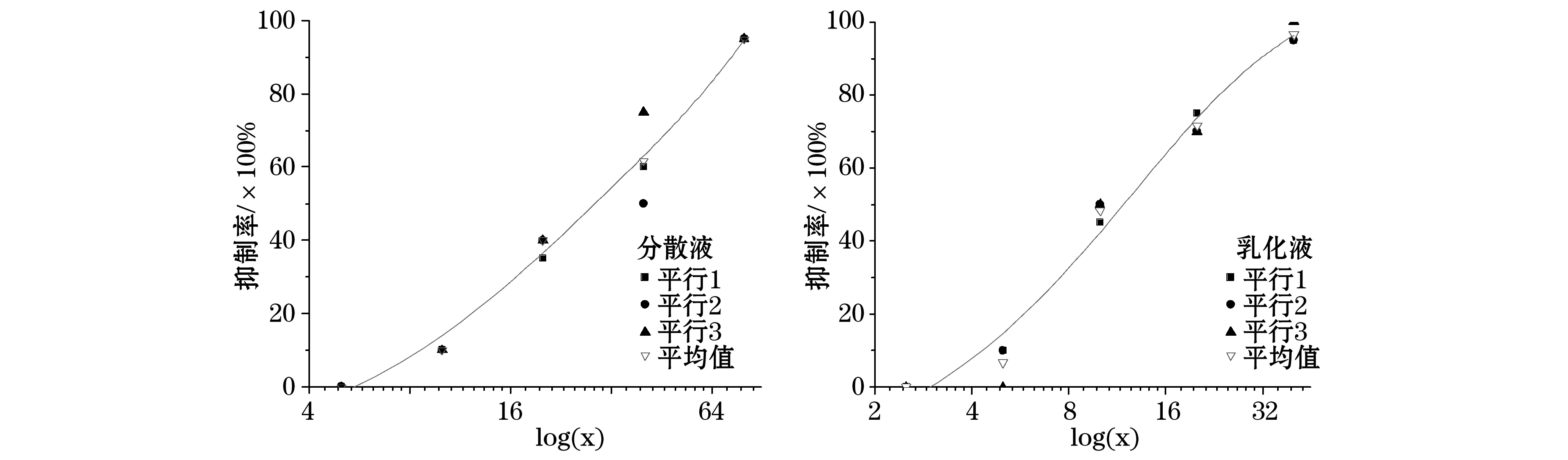
图1 120#燃料油分散液和乳化液对海胆的抑制率拟合结果Fig.1 Fitting results of inhibition rate of dispersion and emulsion of 120# fuel oil on sea urchin

表3 120#燃料油分散液和乳化液对海胆的96 h EC50值Table 3 96 h EC50 of dispersion and emulsion of 120# fuel oil on sea urchin
由表3可见,96 h 120#燃料油分散液和乳化液对海胆的EC50值分别是29.15和12.03 g/L,乳化液的EC50值比分散液的EC50值减小58.7%,说明在消油剂的作用下120#燃料油乳化液的毒性比分散液的毒性增大了1.42倍。
2.3 慢性毒性试验结果
1)表观中毒症状
暴露试验过程中,在0,7,14和21 d,分别对不同分散液和乳化液质量浓度的海胆状态进行观察:在0,7和14 d时,幼海胆本身无明显的掉刺现象,空白组表现正常;21 d后,分散液中仅在高浓度组4.5 g/L开始出现掉刺现象,然而乳化液中质量浓度在1.13,2.25和4.50 g/L组中,都分别出现不同程度的掉刺现象,而且海胆管足的附着能力也有不同程度的下降。具体形态变化情况如图2。

图2 暴露21 d海胆的形态观察Fig.2 Morphological observation of sea urchin within 21 d exposure
2)DNA损伤情况
暴露于分散液和乳化液中的海胆肠细胞的DNA损伤情况被绘于图3。由图3可以看出海胆肠细胞的DNA损伤程度随着分散液和乳化液质量浓度增大和暴露时间延长呈现明显的正增长,但是在7和14 d时,燃料油分散液和乳化液中都出现了拖尾现象,但是尾部DNA百分含量均<5%,而21 d时,分散液中最高质量浓度组4.5 g/L出现尾部DNA百分含量大于5%的情况,而乳化液中较高浓度组2.25 g/L和最高质量浓度组4.5 g/L均出现尾部DNA百分含量大于5%的损伤情况,并且质量浓度为4.5 g/L时,尾部DNA百分含量达到最大为17.28%,说明乳化液海胆肠细胞损伤程度高于分散液。
大量的研究结果得出一致结论,包括物理因素(紫外线和冷冻)和化学因素(有毒化学物质及氧化剂)等[14-15]都有可能引起 DNA 单链断裂,造成不同程度的遗传损伤。而多环芳烃具有遗传毒性,可以通过氧化还原形成活性氧(ROS)并与DNA结合形成DNA加和物,从而更能引起DNA单链断裂,造成DNA损伤。一些研究已经证明了多环芳烃可以诱导海洋生物的DNA损伤,Humphries等[16]通过检测暴露于多环芳烃中不同发育时期的贻贝的DNA损伤情况,发现贻贝暴露7 d后的DNA损伤程度随着多环芳烃浓度的增大而增大;Woo等[17]在研究多环芳烃暴露过程中牙鲆鱼血细胞的DNA损伤情况时也发现,DNA损伤情况与多环芳烃质量浓度和暴露时间密切相关。本研究中DNA损伤在120#燃料油乳化液中更为明显,可以认为主要是由于消油剂的存在使乳化液中多环芳烃质量浓度增大,从而对海胆诱导了海胆肠细胞的DNA损伤。

图3 不同质量浓度、不同暴露时间海胆肠组织DNA损伤情况Fig.3 DNA damage of intestinal tissue of sea urchins in different concentration within different exposure time
注:n=5,“a”与对照组相比,差异显著P<0.05;“aa”与对照组相比,差异显著P<0.01;“b”与分散液相比,有明显差异,P<0.05;“bb”与分散液相比,差异显著,P<0.01
3)全基因组甲基化水平
在暴露时间点7,14和21 d,分别对海胆组织的5-甲基胞嘧啶和胞嘧啶进行测定,并计算出相应的甲基化水平(图4)。空白组在不同的培养天数下,甲基化水平在14%左右;而毒性暴露7 d时,经过不同质量浓度的分散油和乳化油的暴露,除个别质量浓度外,海胆组织的整体甲基化水平呈不同程度的下降趋势,并且乳化液中海胆组织甲基化程度比分散液中更低;染毒14 d时,分散液和乳化液中海胆组织甲基化水平相较7 d时有所升高,但是乳化液中的甲基化水平依然低于分散液中的甲基化水平;染毒21 d时,分散液中甲基化水平没有明显的变化规律,而乳化液中甲基化水平相较14 d时有明显的降低。
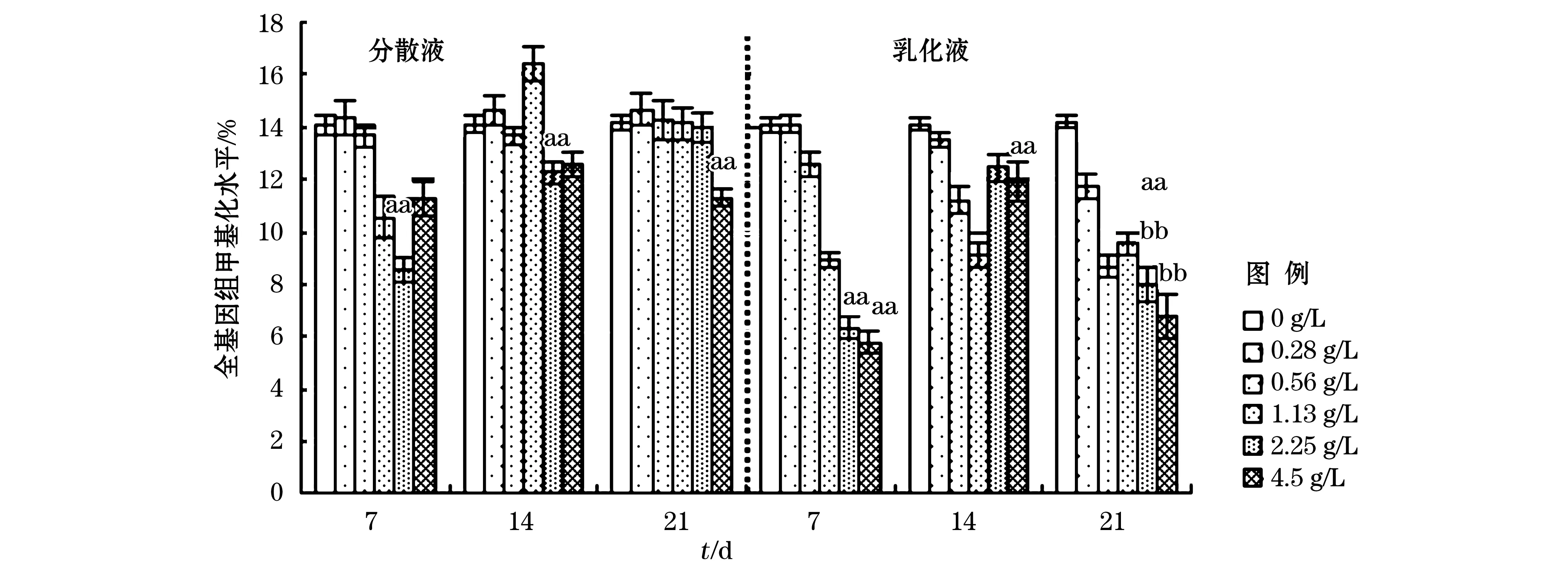
图4 不同暴露时间、不同质量浓度分散液和乳化液中海胆甲基化水平Fig.4 Whole genome-wide methylation levels of sea urchin in different concentration within different exposure time
注:n=3,“a”与对照组相比,差异显著P<0.05;“aa”与对照组相比,差异显著P<0.01;“b”与分散液相比,有明显差异,P<0.05;“bb”与分散液相比,差异显著,P<0.01
总之,DNA 甲基化水平的影响与作用时间和污染浓度有关, 120#燃料油乳化液中海胆组织细胞DNA 最终维持非正常低度甲基化,这可能与氧化胁迫下生物体的自身调控有关。有报道指出污染物达到一定质量浓度可以对水生生物甲基化水平产生影响, Aniagu等[18]证实DNA甲基化转移酶抑制剂5-Aza-CdR 可以显著降低鱼体内肝组织的甲基化水平;周新文[19]和Rossiello等[19-20]证实重金属也能引起DNA低度甲基化;Fang等[21]证实多环芳烃能够抑制甲基转移酶活力,从而影响生物发育。120#燃料油含有21种多环芳烃,海胆暴露于燃料油分散液和乳化液中21 d,进入海胆体内的多环芳烃在海胆体内积累并且抑制了甲基转移酶的活性,从而抑制了胞嘧啶的正常甲基化。分散液中暴露21 d,海胆的甲基化程度趋于正常可能与海胆自身的修复有关,而燃料油乳化液中DNA甲基化明显低于正常甲基化水平,可能由于消油剂的作用使油滴更容易渗透到海胆体内,造成海胆自身不可修复的影响。可认为DNA在石油烃影响下的低度甲基化是对水生生物基因毒性的一种机制。
DNA甲基化改变作为表观遗传学主要的研究机制之一,DNA甲基化水平异常会引起基因调控区DNA甲基化程度调控基因转录;可能产生可遗传的新表型,而降低环境适应能力。海胆的慢性中毒症状可能是由于DNA甲基化抑制防御外源污染物的相关基因表达引起的,也可能与基因突变相关。关于这一结论需要进一步的实验进行验证。
3 结 论
1)急性毒性实验:消油剂本身对海胆属于微毒性;120#燃料油分散液和乳化液对海胆的96 h EC50值分别是29.15和12.03 g/L,120#燃料油乳化液的毒性比分散液的毒性明显增大;
2)慢性毒性实验:毒性效应和甲基化水平同时表明120#燃料油分散液和乳化液对海胆有明显的毒性影响;在分散液和乳化液中海胆肠细胞都出现了一定程度的DNA损伤,并且损伤程度随着暴露时间的延长更加严重,乳化液中的DNA损伤程度高于分散液中的损伤程度,当分散液和乳化液的质量浓度均达到4.5 g/L时,分散液中彗星拖尾尾部DNA百分含量最大值是5.49%,而乳化液中的尾部DNA百分含量最高达到17.28%;海胆的全基因组甲基化水平在燃料油分散液和乳化液暴露后相比于正常发育的海胆都有明显的降低,乳化液浓度与甲基化水平呈负相关,乳化液最高质量浓度4.5 g/L时,甲基化水平达到最低为6.78%。
上述结论是在实验室条件下模拟海洋溢油时,得到的消油剂和石油烃对海洋底栖生物的污染情况。以上结论提醒我们,在消油剂使用之前必须要谨慎考虑这些数据。慢性毒性引起的甲基化水平的变化对相关基因表达的影响有待在后续实验中进一步确定。
[1] DAUVIN J. The fine sand Abra alba community of the bay of morlaix twenty years after the Amoco Cadiz oil spill [J]. Marine Pollution Bulletin, 1998, 36(9): 669-676.
[2] CLAIREAUX G, DESAUNAY Y, AKCHA F, et al. In fluence of oil exposure on the physiology and ecology of the common solea (L.): experimental and field app roaches [J]. Aquatic Living Resources, 2004, 17: 335-352.
[3] CADIOU A, RIFFAUT L, MCCOY K D, et al. Ecological impact of the “Erika” oil spill: Determination of the geographic origin of the affected common guillemots [J]. Aquatic Living Resources, 2004, 17: 369-377.
[4] LESSARD R R, DEMARCO G. The significance of oil spill dispersants [J]. Science & Technology Bulletion, 2000, 6(1): 59-68.
[5] SHAHUNTHALA D R, SWEENEY J M, HODSON V P, et al. Influence of salinity and fish species on PAH uptake from dispersed crude oil [J]. Mar Pollut Bull, 2006, 52(10): 1182-1189.
[6] RAMACHANDRAN S. Oil dispersant increases PAH uptake by fish exposed to crude oil [J]. Ecotox Environ Safe, 2004, 59(3): 300-308.
[7] MILINKOVITCH T, KANAN R, THOMAS-GUYON H, et al. Effects of dispersed oil exposure on the bioaccumulation of polycyclic aromatic hydrocarbons and the mortality of juvenile Liza ramada [J]. Science of the Total Environment, 2011, 409(9): 1643-1650.
[8] HUANG Y J, CHEN Q Z, ZENG J N, et al. Acute toxicity of crude oil and dispersant to marine copepods [J]. Chin J Appl Environ Biol, 2010,16(4):566-571.黄逸君,陈全震,曾江宁,等.原油和消油剂对海洋桡足类的急性毒性效应[J].应用与环境生物学报,2010,16(4):566-571.
[9] ZHANG L, WANG X L, HAN X R, et al. Effects of petroleum hydrocarbon on the growth of marine algae: experiment versus model. Journal of Ocean University of Qingdao, 2002, 32(5): 804-810.张蕾,王修林,韩秀荣,等.石油烃污染物对海洋浮游植物生长的影响—实验与模型[J].青岛海洋大学学报,2002,32(5):804-810.
[10] XU H, SONG D D, ZHOU A H, et al. Assessment on acute toxicity of oil spill dispersant and crude oil dispersed on marine microalgae [J]. Marine Environmental Science, 2013, 32(1): 87-91.徐会,宋丹丹,周爱华,等.溢油分散剂及其乳化原油对海洋微藻的急性毒性效应评价[J].海洋环境科学,2013,32(1):87-91.
[11] CHEN H Y,FANG J M,YIN C S,et al.Acute toxicity of chemical enhanced water accommodated fraction of dispersed oil toApostichopusjaponicasJuveniles [J]. Marine Environmental Science, 2012, 31(3): 414-417.陈皓鋆,房建孟,印春生,等. 经消油剂处理的石油水溶组分对刺参幼参的急性毒性研究[J].海洋环境科学,2012,31(3):414-417.
[12] GANG M, JIANG L L, YANG B L, et al. DNA damage of 0#diesel on sea urchin [J]. Hebei Fisheries, 2011, 12: 17-20. 刚锰,姜玲玲,杨柏林,等.0#柴油对马粪海胆细胞DNA的损伤[J].河北渔业,2011,12:17-20.
[13] YANG B L, XIONG D Q, GANG M, et al. Effect of petroleum hydrocarbons onStrongylocentyotusinternediusembryonic development and activity of four enzymes [J]. Marine Environmental Science, 2012, 32(4): 534-537. 杨柏林,熊德琪,刚锰,等.石油烃对虾夷马粪海胆胚胎发育及四种酶活力的影响[J].海洋环境科学,2012,32(4):534-537.
[14] CIERESZKO A, WOLFE T D, DABROWSKI K. Analysis of DNA damage in sea lamprey (Petromyzonmarinus) spermatozoa by UV, hydrogen peroxide, and the toxicant Bisazir[J]. Aquatic Toxicology,2005,73(2):128-138.
[15] BINELLI A, COGNI D, PAROLINI M, et al. In vivo experiments for the evaluation of genotoxic and cytotoxic effects of triclosan in zebra mussel hemocytes[J].Aquatic Toxicology, 2009, 91(3): 238-244.
[16] HUMPHRIES LR F. Effects of polycyclic aromatic hydrocarbon exposure on three life stages of freshwater mussels (bivalvia:unionidae)[D]. North Carolina State: The Graduate Faculty of North Carolina State University, 2006:1-41.
[17] WOO S, KIM S, YUM S, et al. Comet assay for the detection of genotoxicity in blood cells of flounder (Paralichthysolivaceus) exposed to sediments and polycyclic aromatic hydrocarbons[J]. Marine Pollution Bulletion, 2006, 52(12): 1768-1775.
[18] ANIAGU S O, WILLIAMS T D, ALLEN Y, et al. Global genomic methylation levels in the liver and gonads of the three-spine stickleback (Gasterosteusaculeatus) after exposure to hexabromocyclododecane and 17-beta oestradiol[J]. Environment International, 2008, 34(3): 310-317.
[19] ZHOU X W, ZHU G N, JILISA M, et al. Influence of Cu, Zn, Pb, Cd and their heavy metalion mixture on the DNA methylation level of the fish (Carassiusauratus)[J]. China Environmental Science, 2001, 21(6): 549-552. 周新文,朱国念,Jilisa Mwalilino,等.Cu、Zn、Pb、Cd 及其混合重金属离子对鲫鱼(Carassiusauratus) DNA甲基化水平的影响[J].中国环境科学,2001,21(6):549-552.
[20] ROSSIELLO M R, ARESTA A M, PRISCO M, et al. DNA hypomethylation during liver cell proliferation induced by a single dose of lead nitrate[J]. Bollettino Della Societa Italiana Di Biologia sperimentale, 1991, 67: 993-997.
[21] FANG X F, DONG W, THORNTON C, et al. Benzo[a]pyrene effects on glycine N-methyltransferase mRNA expression and enzyme activity inFundulusheteroclitusembryos[J]. Aquatic Tocxicology, 2010, 98(2):130-138.
TheEffectofDispersantand120#FuelOilonDNADamageandDNAMethylationofSeaUrchin
YANG Bai-lin, GAO Ya-li, JIANG Ling-ling, GANG Meng, XIONG De-qi
(CollegeofEnvironmentalScienceandEngineering,DalianMaritimeUniversity, Dalian, 116026, China)
The impact of 120#fuel oil and dispersants on sea urchin was studied by determining the acute toxicity, DNA damage and DNA methylation level. The results showed that: using dispersant alone had little effect on sea urchin, but the concentrations of polycyclic aromatic hydrocarbon in oil emulsion added with dispersant were significantly higher than those in oil dispersion; Oil dispersion with dispersant had obvious effect of toxicity, the 96 h EC50value was 12.03 g/L in oil emulsion compared to 29.15 g/L in oil dispersion; DNA damage in intestinal cells treated with oil emulsion was more serious than that with oil dispersion; DNA methylation in whole genome level had declined in both oil dispersion and oil emulsion, the methylation lever was lower in oil emulsion and had a higher acute toxicity. All these suggest that the application of dispersants increased the toxic effects of fuel oil on sea urchin.
Dispersant; 120#fuel oil; Sea urchin; DNA damage; DNA methylation
September 4, 2013
2013-09-04
国家自然科学基金项目——消油剂处理溢油对模式生物海胆的联合毒性效应及机制研究(41276105);中华环境保护基金会——格平绿色助学行动——辽宁环境科研教育“123”工程
杨柏林(1985-) ,男,河北秦皇岛人,博士研究生,主要从事环境规划管理方面研究. E-mail:yangbailin-peanut@163.com
*通讯作者,E-mail:xiongdq@dlmu.edu.cn
(王佳实 编辑)
X55
A
1671-6647(2014)03-0387-09

