纳米LiMn2O4的动态水热法制备及储锂性能
,,, , ,
(1.浙江工业大学 化学工程学院,浙江 杭州 310014;2.国家动力及储能电池产品质量监督检测中心,浙江 长兴 313100)
锂离子电池具有能量密度高、工作电压高、环境友好和安全等众多优点,已经广泛应用于多种便携式电子设备、混合动力或纯电动力汽车等多个领域,逐渐在市场上占据领导地位[1-3].在锂离子电池正极材料中,锰酸锂(LiMn2O4)因其低毒、廉价和安全等优点被认为是最具潜力的材料之一,近年来被广泛研究[4].但其本身较低的电导率和锂离子扩散速率以及循环过程中发生的姜泰勒效应和锰离子的溶解严重限制了其高容量的实现和循环稳定性[5-6].针对这些缺点,科研人员对其进行了改性,大体可以概括为三个方面:1) 减小LiMn2O4的颗粒尺寸;2) 掺杂金属离子,优化晶体结构;3) 在LiMn2O4颗粒表面包覆一层氧化物将LiMn2O4与电解液隔离,减少或避免锰离子的流失.传统固相法[7]合成过程中很难控制材料的晶粒生长、表面形貌和化学计量比的化学组分.软化学法(如溶胶凝胶法[8]、喷雾裂解法[9]和熔融浸渍法[10]等)也被广泛用于合成LiMn2O4,所得产物颗粒分布均匀且结晶度良好.但是,这些方法往往需要多步高温处理且合成过程复杂,导致制备成本很高,难于大规模生产.水热法是合成LiMn2O4纳米材料的最有效方法之一[11].在传统的静态水热反应过程中,反应物之间接触不充分、反应时间长且产物中往往含有杂质.为了缩短反应时间,需要加入氧化剂(H2O2)[12]或者还原剂(蔗糖)[13].相对于静态水热法,动态水热法反应过程中原料之间分散更均匀、接触更充分、反应时间更短且可大规模生产.
在之前的研究中[14],我们采用了更为简单便利的动态水热法得到了尺寸均一的LiMn2O4纳米材料,以廉价的电解二氧化锰和Mn(NO3)2溶液作为锰源制备得到了公斤级且尺寸均匀的LiMn2O4纳米材料,电化学性能良好.在此基础上,笔者采用新型动态水热法成功地合成了一系列分散均匀的LiMn2O4纳米材料.运用XRD,SEM,TEM,EIS和充放电测试等多种方法表征其晶相、形貌和电化学性能.结果表明:水热溶液中LiOH的浓度对产品性能有很大影响.当LiOH浓度为0.4 mol/L时制得的LiMn2O4材料颗粒较为均匀(40~100 nm之间),且表现出良好的电化学性能.在0.1 C倍率循环时,首次放电容量为118.4 mAh/g,50周后容量保持率为90.5%.此外,本方法避免了高温处理带来的高成本,且制备工艺简单,为规模化生产提供了可能.研究有助于加深人们对动态水热法合成锂离子电池正极材料的了解,为低成本高性能的LiMn2O4纳米材料的制备提供了新思路.
1 实验部分
1.1 材料制备
采用简单的动态水热法合成LiMn2O4纳米材料.在合成过程中,MnO2,Mn(NO3)2和过量100%的LiOH按化学计量比混合,将混合物放置于1 L的反应釜中.为了比较LiOH浓度对产物物相和性能的影响,向上述反应釜中分别加入600,300,150 mL水,对应LiOH浓度分别为0.2,0.4,0.8 mol/L(为了方便,所得产物分别标记为SA-1H,SA-2H和SA-3H).将反应釜升温到150 ℃,并持续搅拌10 h,得到产物.将产物溶液过滤,水洗几次,120 ℃真空干燥3 h,得到目标产物.
1.2 分析与表征
样品的XRD晶相分析采用PANalytical型X射线衍射仪,扫描范围从10°~80°,扫描步长为0.02°.LiMn2O4样品的表面形貌和微观结构表征分别采用Hitachi S-4700型扫描电子显微镜(SEM)和Tecnai G2 F30型透射电子显微镜(TEM).2032型扣式半电池的组装在充满氩气的system one真空手套箱(Innovative technology limited, USA)中进行.
1.3 电化学性能测试
工作电极由m(活性材料)∶m(乙炔黑)∶m(PVDF)=8∶1∶1组成.混合物与1-甲基-2-吡咯烷酮(NMP)研成浆料涂抹在铝箔上,经120 ℃真空干燥12 h后制成.用打孔器截下面积约为1 cm2的电极片为工作电极,电极活性材料厚度约为2~5 μm,质量为0.3 mg,对电极和参比电极为金属锂,隔膜为Celgard2400,电解液为1 mol/L LiPF6-EC/DMC/EMC电解液.在充满氩气的手套箱内组装成型号为CR2032的纽扣电池,采用LAND电池测试系统(CT2001A)进行充放电测试,用CHI660B电化学工作站进行交流阻抗测试.
2 结果与讨论
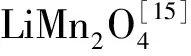
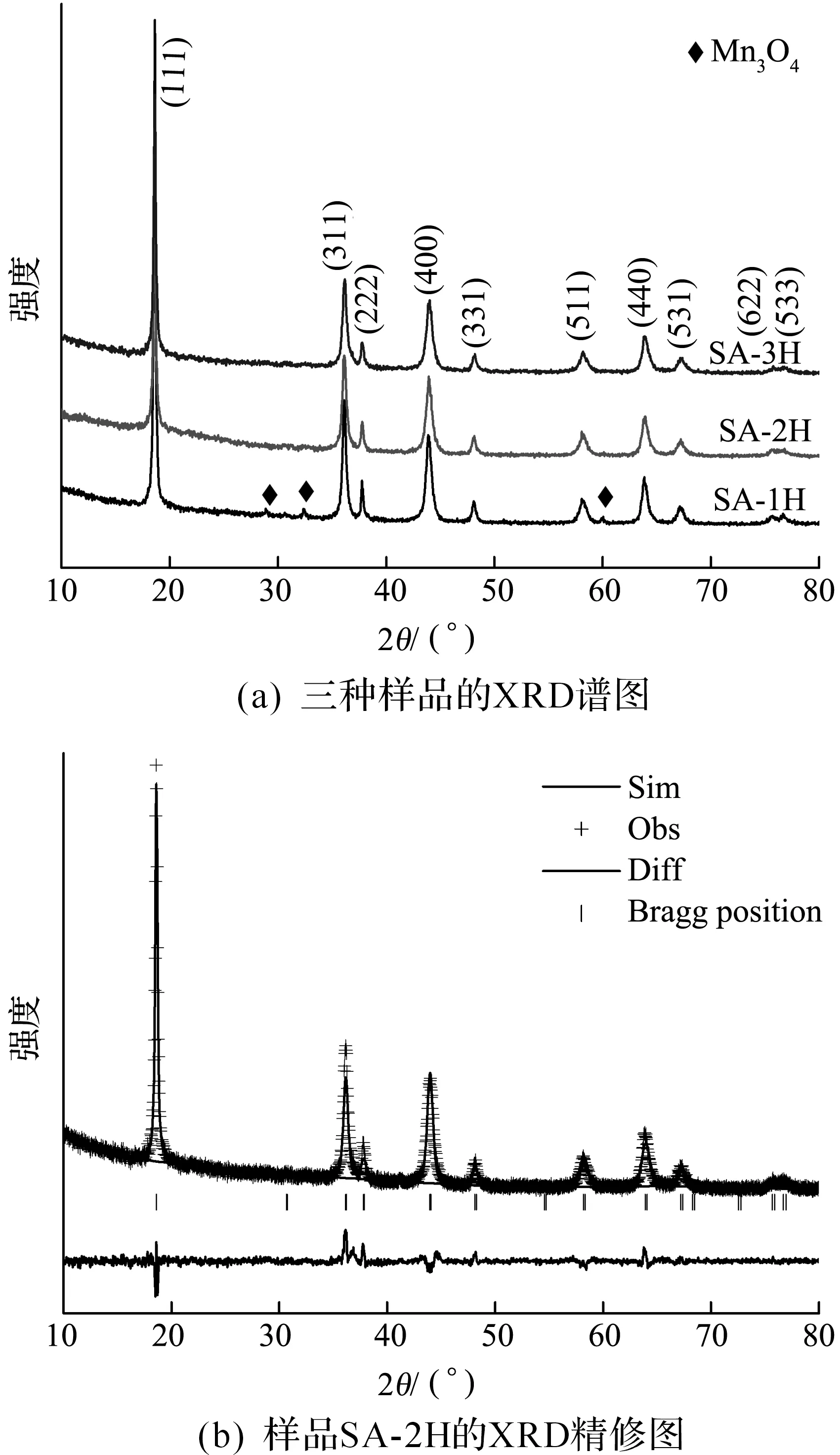
图1 不同LiMn2O4样品的XRD谱图

表1 LiOH浓度对LiMn2O4样品的晶相参数和颗粒尺寸的影响
从图2中可以看到:三个样品的颗粒在尺寸和形状方面没有明显的差异,分散性比较好,颗粒表面比较光滑,没有明显的团聚现象.颗粒大小比较均匀,形状较规整,有着均一的正八面体结构,粒径大约在40~100 nm之间.
图3(a)是三种LiMn2O4样品的首周充放电曲线.三个样品均在4 V左右出现了两个明显的平台,对应LiMn2O4两步可逆脱嵌锂反应:LiMn2O4↔Li1-xMn2O4+xe+xLi+(0≤x≤0.5),Li1-xMn2O4↔(1-x)Li++2MnO2+(1-x)e(0.5≤x≤1).样品SA-2H的首周放电比容量为118.4 mAh/g,略高于样品SA-1H(106.5 mAh/g)和SA-3H(112.3 mAh/g).图3(b)显示,三个样品循环50周后的可逆容量分别为SA-1H(81.6 mAh/g),SA-2H(107.1 mAh/g)和SA-3H(92.35 mAh/g),其中样品SA-2H的循环稳定性更好,容量保持率为90.5%.

图2 三种LiMn2O4样品的SEM和TEM谱图
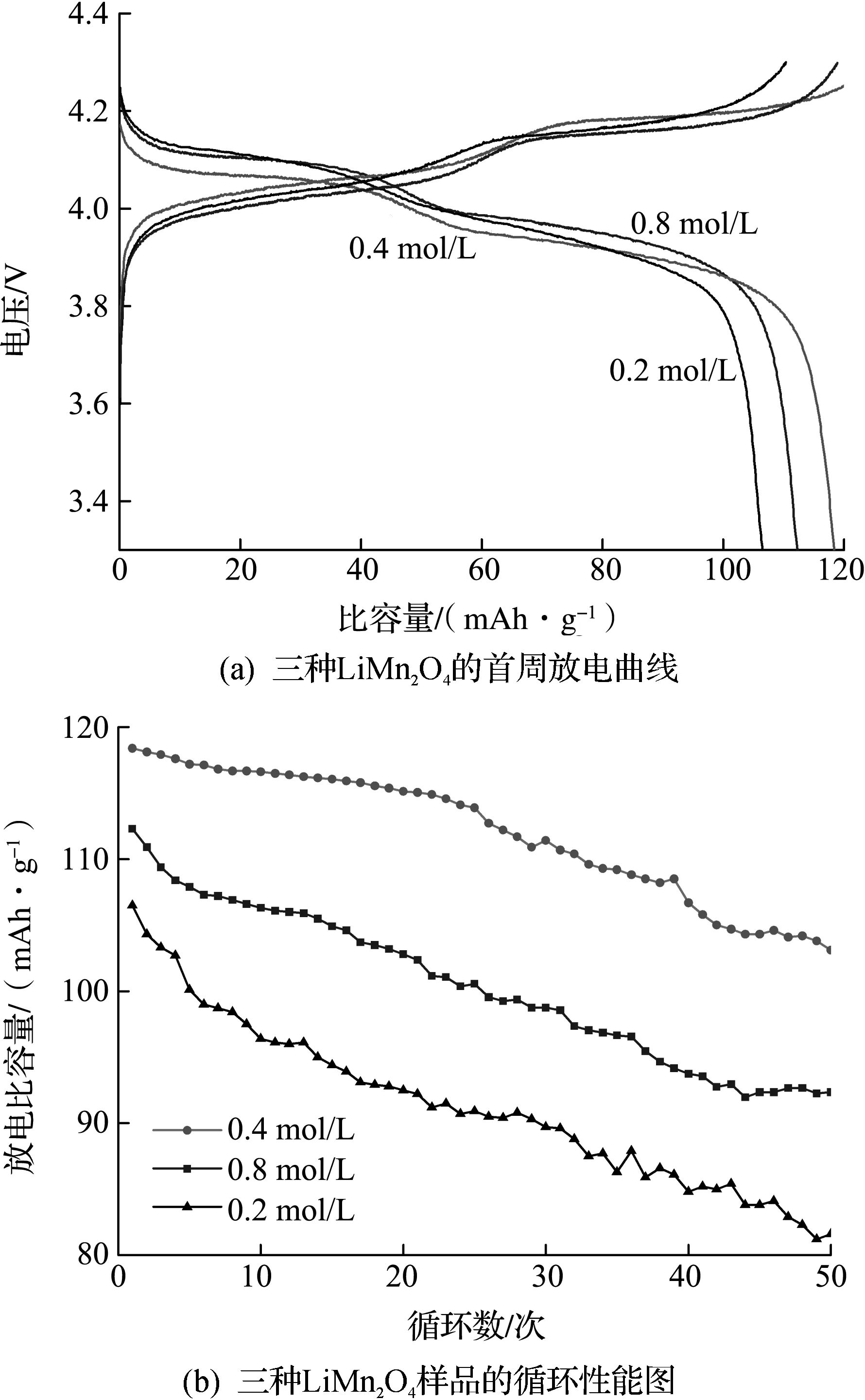
图3 三种LiMn2O4样品的充放电性能图(0.1 C)
图4 不同LiMn2O4样品的交流阻抗测试图

表2 LiMn2O4样品的动力学参数
图4(a)为三个样品的交流阻抗谱(EIS)和等效电路图,其中Rs,Rct,W和Q分别代表欧姆阻抗、电荷转移阻抗、韦伯斯特阻抗和常相位角元件[17].锂离子在电解液中的扩散速率要比在体相中快很多,所以Rct是锂离子扩散速控步.表2列出了三种样品的动力学参数,从中可以发现Rct的值差异很大,分别为729.9,66.3,251.7 Ω.由此可以计算得到交换电流密度(i0)[18].
交换电流密度(i0)、韦伯斯特系数(σ)和锂离子扩散系数(DLi)计算公式分别为
(1)
Zre=Rct+Rs+σω-0.5
(2)
(3)
其中:R,T,n,F,S,CLi,ω和σ分别为气体常数、绝对温度、转移电荷数、法拉第常数、表面积、锂离子的浓度、角频率和韦伯斯特系数.根据式(1),样品SA-1H,SA-2H和SA-3H的交换电流密度分别为35.2,387,102 μA/cm2.SA-2H拥有最小的电荷转移电阻和最大的反应活性,原因在于其颗粒结晶度好、没有杂质、比表面积大、锂离子迁移速度快且扩散路径短.由图4(b)和式(2)可以计算得到σ,进而根据式(3)可以计算出DLi[19-20].表2显示:在三个样品中,样品SA-2H的锂离子动力学性能最好,电荷转移速度最快.这些优势决定了样品SA-2H具有更高的比容量和更好的循环稳定性.
3 结 论
采用动态水热法合成了LiMn2O4纳米材料,研究了LiOH浓度对产物晶相、形貌、颗粒尺寸和电化学性能的影响.结果表明:所得到的产物结晶度良好,颗粒均匀,分散性好.当LiOH浓度为0.4 mol/L时制得的LiMn2O4材料颗粒较为均匀(40~100 nm之间).EIS分析显示,样品SA-2H拥有较大的锂离子扩散系数和交换电流密度,锂离子嵌入动力学和电荷转移是最快的,因此表现出良好的电化学性能.在0.1 C倍率循环时,首次放电容量为118.4 mAh/g,50周后容量保持率为90.5%.此外,本方法避免了高温处理带来的高成本,且制备工艺简单,为规模化生产提供了可能.本研究有助于加深人们对动态水热法合成锂离子电池正极材料的了解,为低成本高性能的LiMn2O4纳米材料的制备提供了新思路.
参考文献:
[1] 毛信表,王连邦,马淳安,等.新型锂储藏合金负极材料研究进展[J].浙江工业大学学报,2006,34(4):364-368.
[2] SU Li-wei, JING Yu, ZHOU Zhen. Li ion battery materials with core-shell nanostructures[J]. Nanoscale,2011,3:3967-3983.
[3] SU Li-wei, ZHONG Yi-ren, ZHOU Zhen. Role of transition metal nanoparticles in extra lithium storage capacity of transition metal oxides: a case study of hierarchical core-shell Fe3O4@C and Fe@Cmicrospheres[J]. Journal Mateials Chemistry A,2013,1(47): 15158-15166.
[4] ELLIS B L, LEE K T, NAZAR L F. Positive electrode materials for Li-ion and Li-batteries[J]. Journal of Materials Chemistry,2010,22:691-714.
[5] SUN Y K, MYUNG S T, PARK B C, et al. High-energy cathode material for long-life and safe lithium batteries[J]. Nature Materials,2009,8:320-324.
[6] CHO J, KIM Y J, KIM T J, et al. Zero-strain intercalation cathode for rechargeable Li-ion cell[J]. Angewandte Chemie-International Edition,2001,40:3367-3369.
[7] 王连邦,李晟,张品杰,等.低成本动力锂离子电池磷酸铁锂正极材料的合成及性能[J].浙江工业大学学报,2012,40(4):355-360.
[8] XIA Hui, RAGAVENDRAN K R, XIE Jian-ping, et al. Ultrafine LiMn2O4/carbon nanotube nanocomposite with excellent rate capability and cycling stability for lithium-ion batteries[J]. Journal of Power Sources,2012,212:28-34.
[9] TANIGUCHI I, SONG D, WAKIHARA M. Electrochemical properties of LiM1/6Mn11/6O4(M=Mn, Co, Al and Ni) as cathode materials for Li-ion batteries prepared by ultrasonic spray pyrolysis method[J]. Journal of Power Sources,2002,109:333-339.
[10] TU J, ZHAO X B, CAO G S, et al. Enhanced cycling stability of LiMn2O4by surface modification with melting impregnation method[J]. Electrochimica Acta,2006,51:6456-6462.
[11] WU H M, TU J P, YUAN Y F, et al. One-step synthesis LiMn2O4cathode by a hydrothermal method[J]. Journal of Power Sources,2006,161:1260-1263.
[12] JIANG C H, DOU S X, LIU H K, et al. Synthesis of spinel LiMn2O4nanoparticles through one-step hydrothermal reaction[J]. Journal of Power Sources,2007,172:410-415.
[13] LIANG Yan-yu, BAO Shu-juan, LI Hu-lin. A series of spinel phase cathode materials prepared by a simple hydrothermal process for rechargeable lithium batteries[J]. Journal of Solid State Chemistry,2006,179:2133-2140.
[14] YAO Jin-han, LV Long-teng, SHEN Chao-qi, et al. Nano-sized spinel LiMn2O4powder fabricated via modified dynamic hydrothermal synthesis[J]. Ceramics International,2013,39:3359-3364.
[15] KANASAKU T, AMEZAWA K, YAMAMOTO N. Hydrothermal synthesis and electrochemical properties of Li-Mn-spinel[J]. Solid State Ionics,2000,133:51-56.
[16] XIE Xiao-jun, CHENG Yong-hong, WANG Hong, et al. Structural study of cubic pyrochlores based on quantum mechanical simulation[J]. Ceramics International,2008,34:689-693.
[17] ZHUANG Quan-chao, WEI Tao, DU Li-li, et al. An electrochemical impedance spectroscopic study of the electronic and ionic transport properties of spinel LiMn2O4[J]. The Journal of Physical Chemistry C,2010,114:8614-8621.
[18] ZHU Yan-rong, YIN Long-cheng, YI Ting-feng, et al. Electrochemical performance and lithium-ion intercalation kinetics of submicron-sized Li4Ti5O12anode material[J]. Journal of Alloys and Compounds,2013,547:107-112.
[19] SHENOUDA A Y, LIU H K. Electrochemical behaviour of tin borophosphate negative electrodes for energy storage systems[J]. Journal of Power Sources,2008,185:1386-1391.
[20] MUNAKATA T, ITO T, OHSAWA Y, et al. Chemical diffusion of Li+ion in orthorhombic-LiMnO2[J]. Journal of Materials Science Letters,2002,21:117-119.

