黄精有效成分的提取及其氧化活性的检测
刘小阳
宿州学院生物与食品工程学院,安徽宿州,234000
黄精有效成分的提取及其氧化活性的检测
刘小阳
宿州学院生物与食品工程学院,安徽宿州,234000
依次利用石油醚、乙酸乙酯、正丁醇进行萃取,再用大孔树脂进行分离,获得黄精的有效成分。然后利用体外无细胞体系,对黄精的不同萃取物进行无细胞体系抗氧化活性检测。不同有机相提取物中的自由基(DPPH)和超氧阴离子(O2-)的清除能力以及黄嘌呤氧化酶活性抑制作用的检测结果表明,三种有机相提取物与抗氧化活性之间存在良好的构效关系。
黄精;有效成分;抗氧化
1 问题的提出
黄精为百合科黄精属植物黄精(Polygonatumsibiricum)、滇黄精(P.kingianum)、多花黄精(P.cyrtonema)和长梗黄精(P.filipes)的根茎,是一种药食同源的传统中草药[1]。黄精味甘、性平,具有补中益气、润心肺、补肾益精、强筋骨、安五脏、止寒热、填精髓等功效。黄精主要含有成分为多糖和皂苷等活性成分[2-3]。其中,主要活性成分为黄精多糖(PSP)。药理研究表明,黄精多糖能够增强免疫功能、降低血糖、降低血脂、抗动脉粥样硬化、延缓衰老、抗肿瘤、抗炎、抗病毒等多种生物学活性,目前已有大量有关黄精多糖降血糖功能的报道[4]。为了进一步开发利用黄精的药用价值,本研究采用有机溶剂萃取并结合大孔树脂吸附,提取黄精中的主要活性成分多糖和皂苷,并测定其含量,同时检测其药理活性,为黄精的药理学研究奠定前期基础。
2 实验部分
2.1 试剂与仪器
RV-605型真空旋转蒸发仪(上海亚荣生化仪器厂);Multiskan GO型酶标仪(美国Thermo公司);Diaion HP-20型大孔树脂(日本三菱合成化学工业公司);752型紫外可见分光光度计(上海现科仪器有限公司);BCD-206SVES型海尔冰箱(青岛海尔集团)。
薯蓣皂苷标准品由中国药品生物制品检验所生产,质量分数均≥99.6%;葡萄糖标准品由上海化学试剂公司生产;试剂乙醇、正丁醇、石油醚、乙酸乙酯均为分析纯,购自中国上海化学试剂公司;实验用水为二次蒸馏水。
2.2 实验方法
2.2.1 样品制备
选用从市场购得的优质黄精块根(购自宿州市中药材有限责任公司),切成长0.5 cm左右的小块,放置于鼓风干燥箱中在45℃恒温条件下烘干12 h,然后将温度升至60℃继续烘干8 h后取出。利用粉碎机将其粉碎,粉碎后呈灰黄色粉末状,在干燥箱中60℃下干燥2 h至恒重,备用。称取约1 kg黄精粉,用80%乙醇溶解,室温下提取72 h。将上一步得到的浸提液经真空抽滤,得到滤液和滤渣,收集滤液A;将滤渣再用80%乙醇溶解,同样条件下重复浸提,再次真空抽滤,得到滤液B。
2.2.2 有机溶剂萃取
将总滤液(A+B)经旋转蒸发仪浓缩,在适当转速下,温度从室温慢慢上升至78℃,得到浓缩液C。将浓缩液C置于分液漏斗中,用等体积的石油醚萃取,得到水相和石油醚相,收集石油醚相。将水相再次倒入分液漏斗,用等体积的乙酸乙酯萃取,得到水相和乙酸乙酯相,收集乙酸乙酯相。将水相再次倒入分液漏斗,用等体积的正丁醇萃取,得到水相和正丁醇相,收集正丁醇相。这样,分别得到水相、正丁醇相、乙酸乙酯相、石油醚相。将上述四相液体分别置于旋转蒸发仪中浓缩得4种相的浓缩液。
2.2.3 分离纯化
将大孔树脂进行预处理、装柱,然后将上述方法得到的水相和3个有机相进行过柱吸附,用70%乙醇洗涤树脂,控制流速为每分钟床层体积的1/25左右,用量为床层体积的5倍,得洗脱液。此步骤分别得到4种过柱液与4种洗脱液。将得到的4种洗脱液与过柱液分别合并,浓缩,冷冻干燥,得到各有机相成分粉剂。
2.2.4 多糖含量分析
2.2.4.1 标准曲线的建立
称取葡萄糖50 mg,溶解并定容至50 mL容量瓶中,得葡萄糖标准溶液(1 mg/mL)。精密吸取0.5、1.0、2.0、3.0和4.0 mL的葡萄糖标准溶液,摇振,静置30 min,于490 nm处测定吸光度。重复测定3次,取平均值。以葡萄糖标准品质量x(mg)为横坐标,吸光度y为纵坐标,绘制标准曲线,得到回归方程。
2.2.4.2 多糖含量的测定
精密称取各有机相黄精提取物约3 mg,置50 mL量瓶中,加双蒸水溶解定容,离心,取其上清液检测,与标准曲线对照得多糖含量。
2.2.5 薯蓣皂苷标准曲线制作
2.2.5.1 薯蓣皂苷标准溶液的配制
称取干燥至恒重的薯蓣皂苷标准品100 μg,置100 mL容量瓶中,用蒸馏水溶解并定容,摇匀,配制成浓度为1 mg·L-1的标准溶液[5],备用。
2.2.5.2 标准曲线的制作
将薯蓣皂苷标准液分别配成0.04、0.08、0.12、0.16、0.20 mg·mL-1,分别在326 nm处测定吸光值,得线性回归方程。
2.2.6 各有机相提取物抗氧化活性检测
2.2.6.1 清除DPPH自由基的活性检测
首先向96孔酶标板中加入160 μL 50 μmol/L DPPH自由基的甲醇液,进而加入40 μL各有机溶剂提取物,空白对照用等量的溶剂所代替,总体积为200 μL。每个处理3个重复,摇匀后于室温下放置30 min,517 nm处测定吸光值(A0为空白对照值,AS为试样测定值),用160 μL甲醇与40 μL试样混合液调仪器零点,以扣除样品本身颜色的影响。清除率(C)按下式计算[6]:
C=[(A0-AS)/A0]×100%
2.2.6.2 超氧阴离子自由基的清除或产生能力的检测
采用黄嘌呤与黄嘌呤氧化酶反应系统检测超氧阴离子产生/清除能力。加入电子传递物质Gress氏显色剂,利用酶标仪测定吸光度。操作按照检测试剂盒说明书进行,每个处理样品做3个重复。
2.2.6.3 黄嘌呤氧化酶抑制活性检测
称取黄嘌呤(XA)15.21 mg样品溶于10 mL的PBS中,调pH值至7.8作为储备液,浓度为10 mM,将50 μM的黄嘌呤和0.1 U的黄嘌呤氧化酶加上不同质量浓度的提取液,反应液的总体积为500 μL,在25℃的水浴中反应10 min,空白对照用PBS代替。在295 nm波长处检测吸光值。抑制率(I)按下式计算[7]:
I=(1-AS/A0)×100%
健康旅游配套产业主要集中在餐饮、娱乐和物流等第三产业,随着市场广度和深度的拓展,与健康旅游相适应的服务体系正在完善。在“互联网+医疗健康”和医疗大数据的背景下,信息化的重要性日益显现,因旅游与健康领域的信息壁垒尚未打破,信息化的促进作用还未有效发挥。立体化旅游交通格局正在形成,集散中心、景观公路、休闲绿道等多点开花,旅游与交通正面临着共同转型升级,以为健康旅游带来更多的交通便利。
3 结果与讨论
3.1 黄精提取物中多糖和总皂苷含量的测定
3.1.1 多糖含量
根据葡萄糖标准曲线得到回归方程y=0.160 2x-0.02,R2=0.999 5,见图1。表明葡萄糖在0.02~0.1 mg范围内与吸光度成良好的线性关系。根据葡萄糖标准曲线所得的回归方程计算各提取物中多糖含量,见表1。
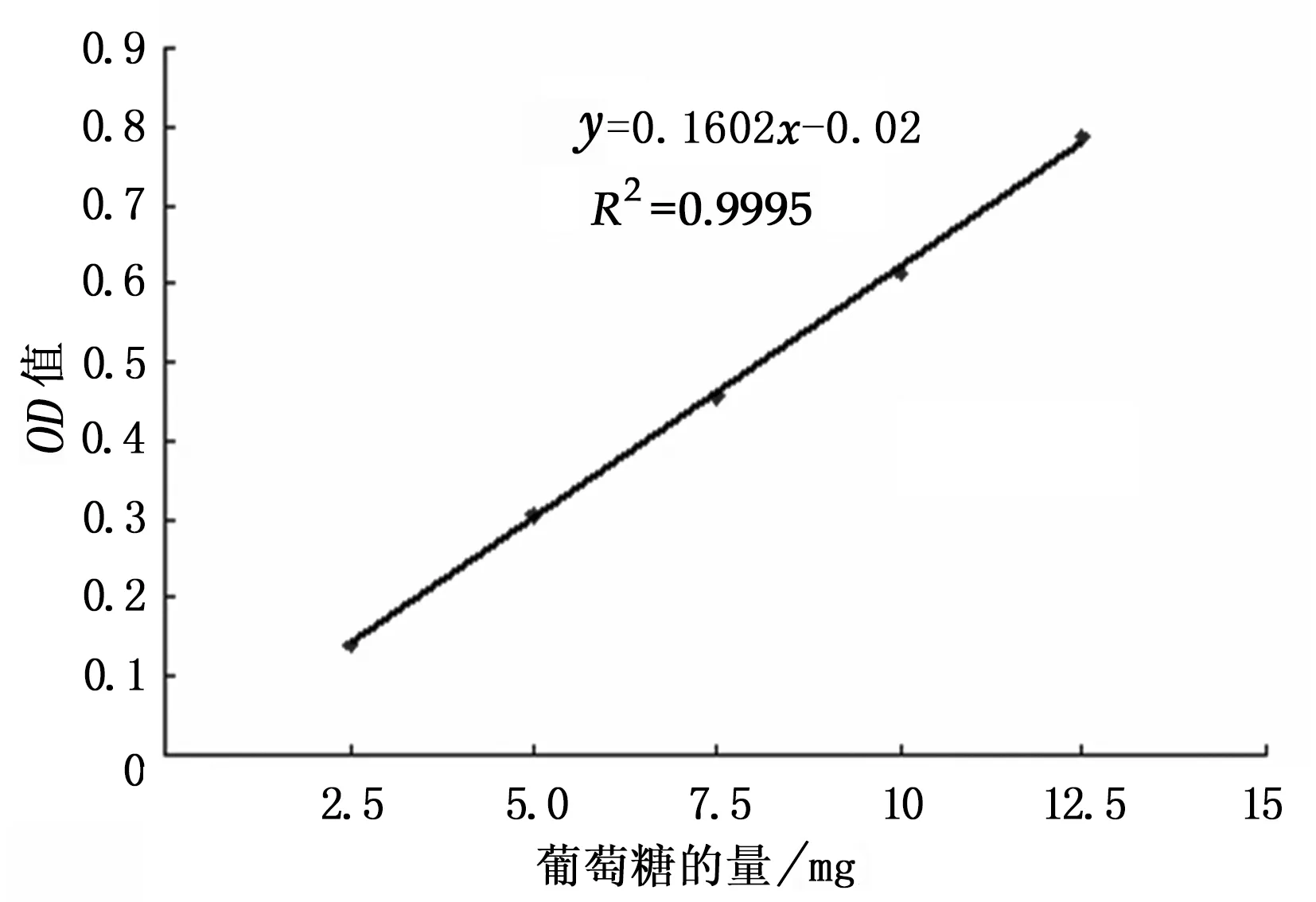
图1 葡萄糖的标准曲线

表1 各萃取相过柱液葡萄糖的检测结果
3.1.2 皂苷含量
根据薯蓣皂苷标准曲线得到回归方程为y=0.084 1x+0.021 1,R2=0.999 2,表明薯蓣皂苷在0.04~0.2 mg·mL-1范围内表现出良好的线性关系(图2)。根据薯蓣皂苷标准曲线所得的回归方程计算得到各提取物中皂苷的含量,结果见表2。

表2 各有机相总皂苷含量的测定

图2 薯蓣皂苷标注曲线
3.2 三种提取物不同浓度对DPPH自由基的清除率
乙酸乙酯相和正丁醇相提取物对DPPH产生的自由基有清除作用,活性呈剂量依赖性增强。正丁醇相提取物的活性高于乙酸乙酯相提取物的活性。石油醚相提取物未表现出自由基清除能力(表3)。

表3 三种有机相提取物对DPPH自由基的清除率/%
注:ND表示无DPPH自由基清除。
3.3 对超氧阴离子自由基的清除的检测
实验结果表明,石油醚提取物和乙酸乙酯提取物对黄嘌呤/黄嘌呤氧化酶体系所产生的自由基均没有清除效果。正丁醇相提取物对自由基具有一定的清除作用,而且呈剂量依赖性增加(图3)。
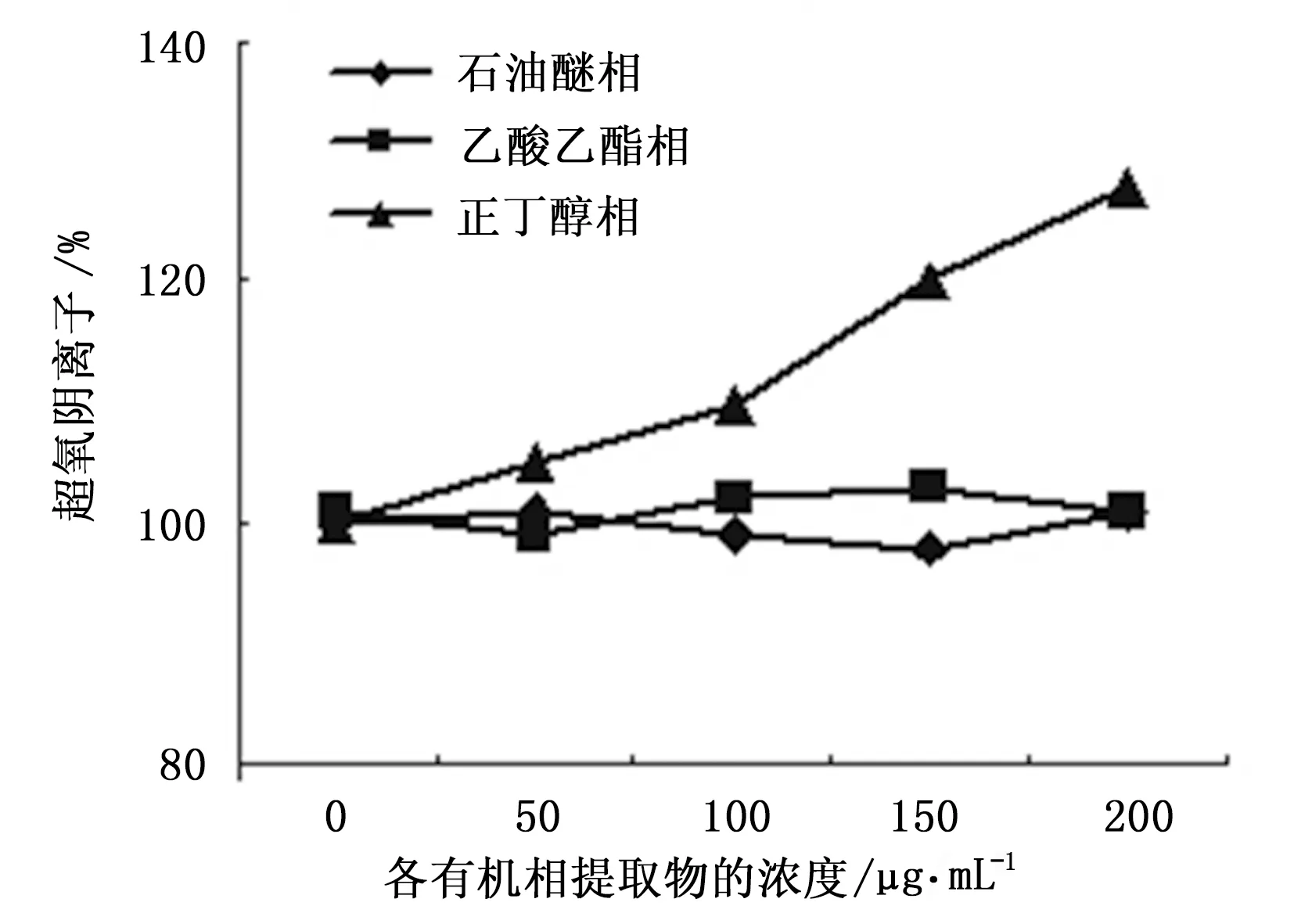
图3 三种有机相提取物在XA/XO体系中超氧阴离子的清除率
3.4 三种有机相提取物对黄嘌呤氧化酶酶活影响的检测
在三种有机相提取物中,正丁醇相提取物在黄嘌呤/黄嘌呤氧化酶反应体系中能够抑制尿酸的生成,说明总皂苷对黄嘌呤氧化酶具有一定的抑制作用。且在150 μg·mL-1和200 μg·mL-1时的抑制率分别为42.3%和46.2%。而石油醚相和乙酸乙酯相提取物在检测浓度范围内没有检测到对黄嘌呤氧化酶的抑制作用(图4)。

图4 三种有机相提取物对黄嘌呤氧化酶的抑制作用
4 结 论
采用大孔树脂吸附法提取了黄精的有效化学成分,并对多糖和皂苷的含量进行了测定,结果表明,多糖大部分被除去,而总皂苷的量随着有机溶剂极性的增加,含量增加,并且获得了良好的收率。
有研究表明,黄精可以调控和增强免疫系统,具有延缓衰老、减少自由基损伤的作用。因此,本研究进一步对三种有机相提取物进行了体外无细胞体系抗氧化活性研究,结果表明乙酸乙酯相和正丁醇相提取物具有明显的抗氧化活性,这为黄精中单一活性组分的研究提供了一定的理论依据。
[1]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:288
[2]唐翩翩,徐德平.黄精中甾体皂苷的分离与结构鉴定[J].食品与生物技术学报,2008,27 (4):34-37
[3]张亮.不同产地黄精中微量元素的主成分分析[J].微量元素与健康研究,2009,26(6):19-21
[4]王海敏,虞海霞,董蕊,等.苕子蜜总酚酸和总黄酮含量测定及抗氧化活性的研究[J].食品科学,2010(1): 54-58
[5]王光忠,刘伟伟,葛如斌,等.分光光度法测定盾叶薯蓣薯蓣皂苷的含量[J].湖北中医学院学报,2008(2):44-45
[6]Dok-Go H, Lee KH, Kim HJ, et al. Neuroprotective effects of antioxidative flavonoids, quercetin,(+)-dihydroquercetin and quercetin 3-methyl ether, isolated from Opuntia ficus-indica var.saboten[J].Brain Res,2003,965 (1-2): 130-136
[7]Cotelle N, Bernier J L, Catteau J P, et al.Antioxidant properties of hydroxy-flavones[J].Free Radic Biol Med, 1996,20(1):35-43
(责任编辑:汪材印)
2014-07-28
宿州学院教授(博士)科研启动基金项目(szxyjb201206)。
刘小阳(1964-),安徽怀宁人,教授,硕士生导师,主要研究方向:细胞与分子生物学。
10.3969/j.issn.1673-2006.2014.12.024
R284.2
A
1673-2006(2014)12-0082-03

