妥洛特罗贴剂在儿童咳嗽变异性哮喘诊断性治疗中的应用及评价
冯 雍,尚云晓
0 引言
咳嗽是儿童呼吸系统疾病最常见的症状,近年来,慢性咳嗽(>4周)的发病率越来越高,其病因诊断和治疗成为儿科医生关注的重点和难点。2012年最新中国儿童慢性咳嗽病因构成比多中心研究显示,咳嗽变异性哮喘(CVA)是引起我国儿童慢性咳嗽的首位病因[1]。而目前儿童CVA的诊断仍以临床表现为主,具有下述表现的患儿可疑似CVA:刺激性干咳>4周,夜间及晨起为著,运动、感冒、冷空气等刺激容易诱发或加重咳嗽,临床上无感染征象或经较长时间抗生素治疗无效。对于5岁以上能配合完成肺功能检查的患儿,可行支气管激发试验,阳性可确诊;对于5岁以下或不能配合的患儿,可予以临床试验性治疗,若支气管扩张剂治疗有效,亦可确诊[2]。
妥洛特罗(Tulobuterol)贴剂是一种透皮吸收型高选择性β2受体激动剂,对支气管平滑肌具有强而持久的扩张作用,药效长达24 h,而对心脏的兴奋作用较弱,同时具有一定的抗过敏、促进支气管纤毛运动和止咳促排痰的作用,在儿童哮喘等疾病中得到了广泛的应用,依从性较好。妥洛特罗贴剂在CVA诊断性治疗中的应用,在成人中已有相关研究,且推荐短期使用妥洛特罗贴剂对成人CVA进行诊断性治疗[3]。而有关妥洛特罗贴剂在儿童CVA诊断性治疗中的应用及评价,国内外尚无相关报道。本研究旨在评价妥洛特罗贴剂在儿童CVA诊断性治疗中的作用,以及妥洛特罗贴剂联合孟鲁司特钠治疗儿童CVA的有效性和安全性。
1 对象与方法
1.1 研究对象 研究对象为2012年12月至2013年9月于我院小儿呼吸内科门诊就诊的101例疑似CVA的慢性咳嗽患儿。所有研究对象在筛选前均获得家长或监护人的知情同意。
1.1.1 入选标准 年龄为6个月~9岁的男性或女性门诊患儿;咳嗽持续>4周,常在夜间和(或)清晨发作或加重,以干咳为主;咳嗽严重程度评分≥2分;临床上无感染征象,或经较长时间抗生素治疗无效;胸部X线检查无明显异常;患儿法定监护人同意参加本研究。咳嗽严重程度评分:0分:无咳嗽;1分:偶有日间或夜间短暂咳嗽(轻度咳嗽);2分:频繁咳嗽,轻度影响日常生活及夜间睡眠(中度咳嗽);3分:频繁咳嗽,严重影响日常生活及睡眠(重度咳嗽)。
1.1.2 排除标准 合并患有心脏病、高血压、糖尿病、甲状腺疾病、血液系统疾病、遗传性疾病等;患有严重哮喘或其他严重呼吸系统疾病;胸片异常;对研究药物成分过敏或不能耐受贴附;在2周内使用过β2受体激动剂、类固醇类激素、白三烯受体调节剂;不适合参加本研究的其他患儿。
1.2 方法
1.2.1 分组及研究方法 本研究包括2周的筛选/洗脱期,1~2周的诊断性治疗期,2周的后续药物治疗期。所有患儿均已有2周筛选/洗脱期,初诊时对疑似CVA的患儿给予妥洛特罗贴剂1~2周的诊断性治疗。妥洛特罗贴剂(0.5 mg/贴,日东电工株式会社)每日睡前贴附,每次贴24 h,剂量:0.5~3岁0.5 mg/次,3~9岁1.0 mg/次。诊断性治疗期结束后再次进行咳嗽严重程度评分,根据评分将其分为A、B两组。A组:妥洛特罗贴剂诊断性治疗阳性组,妥洛特罗贴剂诊断性治疗有效,咳嗽严重程度评分≤1分。B组:妥洛特罗贴剂诊断性治疗阴性组,妥洛特罗贴剂诊断性治疗无效,咳嗽严重程度评分≥2分。A组患儿继续给予妥洛特罗贴剂,同时联合孟鲁司特钠治疗2周,评价其疗效。孟鲁司特钠咀嚼片(默沙东)1次/d,睡前服用,剂量:0.5~6岁 4 mg/次(4 mg/片);6~9岁5 mg/次(5 mg/片)。B组则根据临床经验诊断,发放相应的治疗药物治疗2周。在试验过程禁止合并使用除研究药物外的其他支气管舒张药物、类固醇类激素、白三烯受体调节剂等。在入组前已使用止咳、祛痰药进行治疗的患者,入组后可继续使用,但原则上不得改变用药剂量及组合。若病情需要可使用短效的β2受体激动剂。
1.2.2 观察指标 观察周期为4周,于初诊时进行症状评分等作为基线值,诊断性治疗1~2周后进行疗效评价、药物使用依从性评价以及安全性评价,后续治疗2周后对A组患儿再次进行上述各项评价。
(1)疗效评价:①症状评分即咳嗽严重程度评分。②家长对患儿呼吸道症状的评价:家长反馈咳嗽对患儿日常生活的影响和对夜间睡眠的影响。前者评分标准:0分,基本不影响生活;1分,部分影响生活;2分,严重影响生活。后者评分标准:0分,睡眠较好;1分,睡眠不太好;2分,几乎不能睡眠。③患儿家长对患儿用药意愿的评价:分为基本接受、有些抵触以及强烈抵触。
(2)药物使用依从性评价及安全性评价:记录患儿应使用药物总量及实际使用药物总量,并对用药期间的不良事件和不良反应的发生情况、时间、严重程度、处理、转归以及与药物的关系进行记录。
1.2.3 疗效评估 通过对A、B组中最终诊断为CVA的例数进行分析,得出妥洛特罗贴剂在儿童CVA诊断性治疗中的灵敏度及特异度,并进一步对A组进行药物治疗的有效性评价,以症状改善百分率表示。临床控制:症状改善百分率>75%;显效:症状改善百分率为51%~75%;好转:症状改善百分率为26%~50%;无效:症状改善百分率≤25%。症状改善百分率=(治疗前症状评分-治疗后症状评分)÷治疗前症状评分×100%。总有效率=(临床控制例数+显效例数)÷总病例数×100%。同时分别对A组起效时间、患儿呼吸道症状对日常生活和夜间睡眠的影响进行评价。
2 结果
2.1 一般资料 本研究共筛选入组疑似CVA患儿101例,失访3例,98例完成诊断性治疗,其中男56例,女42例,年龄1.02~9.68岁,平均(4.05±1.76)岁。诊断性治疗结束后,妥洛特罗贴剂诊断性治疗阳性83例(A组),男46例,女37例,年龄1.02~9.68岁,平均(4.09±1.68)岁;妥洛特罗贴剂诊断性治疗阴性15例(B组),男10例,女5例,年龄1.11~9.04岁,平均(3.86±2.23)岁。两组筛选入组时,在年龄、身高、体重、体重指数(BMI)、咳嗽严重程度评分等方面比较,差异无统计学意义(P>0.05),见表1。

表1 两组一般资料及治疗前咳嗽严重程度评分比较
2.2 妥洛特罗贴剂诊断性治疗分析 A组83例,B组15例,妥洛特罗贴剂诊断性治疗阳性率为84.69%。结合临床表现、疗效及进一步检查,并排除其他原因引起的慢性咳嗽,最终确诊为CVA共82例。A组有81例最终诊断为CVA,其中有2例合并感染后咳嗽,另外2例为感染后咳嗽;B组15例中仅有1例最终诊断为CVA合并感染后咳嗽,其余:感染后咳嗽11例、上气道咳嗽综合征2例、咽炎1例(见表2)。妥洛特罗贴剂诊断性治疗儿童CVA的灵敏度为98.78%,特异度为87.50%。
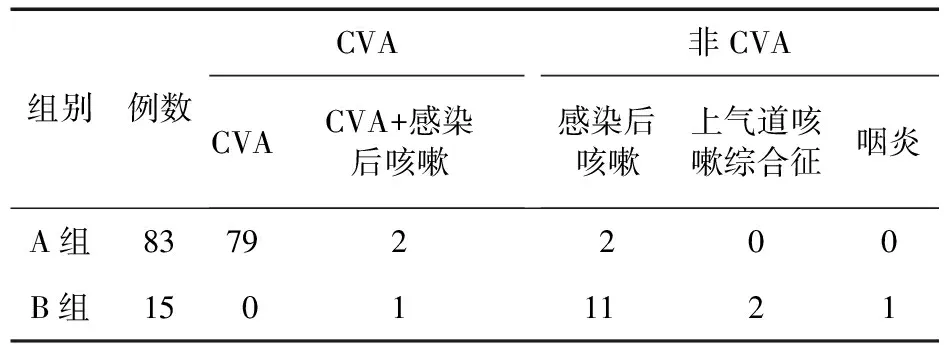
表2 两组最终诊断情况
2.3 妥洛特罗贴剂对CVA患儿的疗效评价 对最终诊断为CVA的82例患儿进行分析发现,诊断性治疗期结束时的总有效率为84.15%(69/82),47.56%(39/82)可达到临床控制,平均起效时间为(12.15±2.58) d。其中A组的81例CVA患儿在接受了2周的联合孟鲁司特钠治疗后,总有效率为93.83%(76/81),较诊断性治疗期有进一步增高的趋势,74.07%(60/81)的患儿达到临床控制,较诊断性治疗期显著增高(P<0.05),见表3。为了进一步观察妥洛特罗贴剂在CVA治疗中的作用,本研究分别就呼吸道症状对A组患儿的日间生活及夜间睡眠质量的影响进行评价。治疗前,49例患儿的呼吸道症状对其日间生活有影响,61例患儿的呼吸道症状对其夜间睡眠有影响。结果显示,与基线期相比,上述患儿的呼吸道症状在诊断性治疗期后及联合孟鲁司特钠治疗后都出现显著改善,见表4。
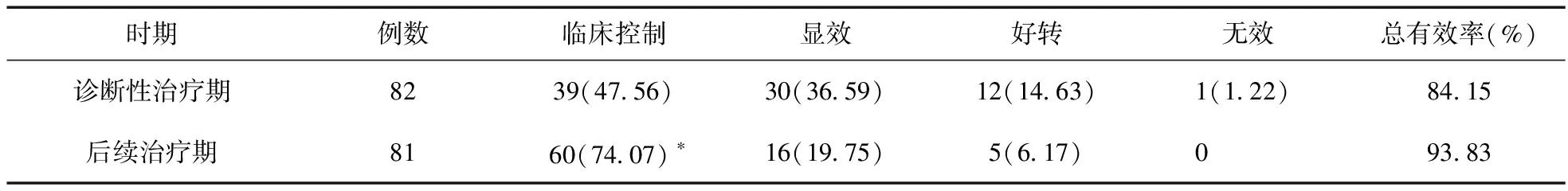
表3 诊断性治疗期及后续治疗期的疗效评价(例,%)
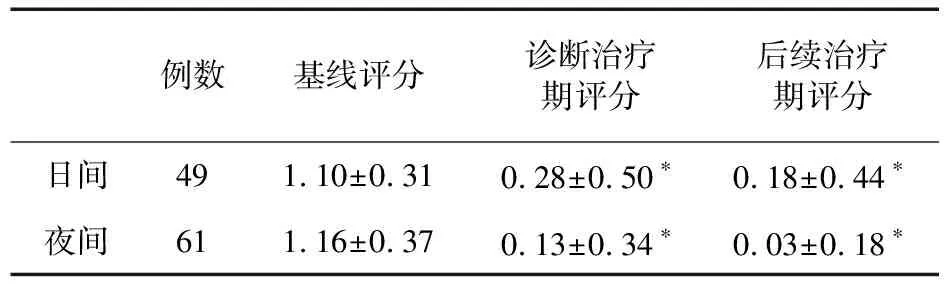
表4 治疗前后呼吸道症状对A组患儿日间生活和夜间睡眠质量的影响
2.4 用药依从性、用药满意度及安全性评价 在诊断性治疗期,98例患儿的总体用药依从性为96.94%。在后续联合治疗期间,A组患儿总体用药依从性为96.39%。纳入研究的98例患儿对妥洛特罗贴剂的用药满意度均较好,仅有2名家长诉患儿有些抵触。在使用妥洛特罗贴剂进行诊断性治疗及后续联合治疗期间,98例患儿中3例出现不良反应,发生率为3.06%。其中2例出现皮肤瘙痒,伴有局部红疹;1例患儿出现心悸症状,且仅为一过性。3例患儿均未因不良反应而停药。
3 讨论
CVA是我国儿童慢性咳嗽的首位病因,约占41.95%[1]。CVA与哮喘有相似的病理特点,均存在气道慢性炎症和气道高反应性[4-7]。虽然CVA患儿的气道反应性低于典型哮喘患儿,但却显著高于普通咳嗽患儿和健康儿童[8],这也是其产生咳嗽症状的主要原因。一项对CVA患儿(平均5.7岁)进行3年以上的随访研究显示,54%的CVA患儿发展成为典型哮喘[9]。因此,早期诊断、早期干预是有效治疗CVA、改善预后及防止发展成典型哮喘的根本途径。儿童CVA的诊断相对困难,气道反应性增高是诊断CVA的重要条件,支气管激发试验阳性有助于诊断[10],但是对于5岁以下及不能配合的患儿,其应用价值有限。美国胸科医师协会(ACCP)认为,只有经过特异性平喘治疗后咳嗽症状缓解,才能诊断为儿童CVA,而支气管激发试验也可能存在假阳性[11]。目前,这种特异性的平喘、诊断性治疗药物主要包括吸入性糖皮质激素(ICS)和支气管扩张剂,但是ICS诊断性治疗有效也不能除外非哮喘性嗜酸性粒细胞性支气管炎(NAEB),因此,支气管扩张剂诊断性治疗有效是帮助确诊儿童CVA的较佳方法。
β2受体激动剂是目前治疗支气管哮喘的一线药物,可选择性地作用于支气管平滑肌细胞表面的β2肾上腺素能受体,借助核苷酸耦合蛋白,激活腺苷酸活化酶,将三磷酸腺苷转变成3,5-环磷酸腺苷(cAMP)。后者引起细胞内蛋白激酶A的脱磷酸作用,使细胞内Ca2+浓度下降,造成细胞内粗细丝微细结构发生改变,导致肌节延长,使气道平滑肌松弛,从而达到支气管扩张的目的。妥洛特罗虽然在药理作用机制上属于短效β2受体激动剂(SABA),但是制成透皮吸收型贴剂后,利用其独特的药物结晶储存系统,均衡持续地释出有效治疗剂量的药物,并通过经皮吸收系统控制血药浓度,用药后10~12 h达血药浓度峰值,持续作用24 h,能有效避免口服制剂引起的血药浓度的过度升高,因此,具有长效、预防“晨降”等特点[12]。已有研究表明,β2受体激动剂可用于儿童CVA的诊断性治疗[13]。本研究显示,妥洛特罗贴剂诊断性治疗儿童CVA的敏感度为98.78%,特异度为87.50%。其中A组有2例最终诊断为感染后咳嗽的患儿被误诊为CVA,考虑与支原体感染后气道反应性增高有关。另外有1例CVA合并感染后咳嗽漏诊,其原因可能是在研究期间发生支原体感染,未能及时应用大环内酯类抗生素控制感染。因此,妥洛特罗贴剂可作为儿童CVA诊断性治疗药物。另外在诊断性治疗阳性的病例中,平均起效时间为12.15 d,因此推荐临床上对于疑似CVA的慢性咳嗽患儿,应用妥洛特罗贴剂诊断性治疗2周为宜,不可过早停药导致漏诊或误诊。
笔者之前的研究已经证实妥洛特罗贴剂在治疗儿童支气管哮喘方面具有良好的临床疗效,特别对夜间症状改善情况较好,明显优于盐酸丙卡特罗片[14]。国内也有其他研究表明,对于CVA患儿,经过2周的妥洛特罗贴剂治疗,总有效率可达90.4%,而且不良反应少见,具有良好的安全性[15]。本研究显示,在最终诊断为CVA的患儿中,经过1~2周的诊断性治疗,总有效率可达84.15%,而47.56%患儿可得到临床控制。另外有研究显示,在CVA患儿痰液中,半胱氨酰白三烯水平比健康对照组明显增高[16]。孟鲁司特钠是强效的选择性白三烯D4受体拮抗剂,可以选择性抑制气道平滑肌中的白三烯活性,阻断白三烯与受体结合,有效地预防和抑制了白三烯所致的血管通透性增高、气道嗜酸性粒细胞浸润及支气管痉挛[17]。对支气管扩张剂、糖皮质激素和抗变态反应药物治疗不理想的CVA患儿,应用孟鲁司特钠治疗有一定疗效。储毅等[18]对100例CVA患儿进行研究发现,妥洛特罗贴剂联合孟鲁司特钠治疗组患儿在治疗第7天时就已经达到了临床控制。另外,Katsunuma等[19]对64例哮喘患儿进行随机、开放、多中心研究发现,在长期使用白三烯受体拮抗剂治疗的基础上,短期持续加用妥洛特罗贴剂能更好地提高患儿日间和夜间的最大呼气峰流速(PEF),同时,具有减少哮喘急性发作、提高睡眠质量的倾向。该研究提示,妥洛特罗贴剂对长期使用白三烯受体拮抗剂治疗的哮喘患儿具有协同作用。本研究对妥洛特罗治疗阳性组进行了后续为期2周的联合孟鲁司特钠治疗,结果显示,总有效率可达93.83%,而74.07%得到临床控制,较诊断性治疗期显著上升。提示妥洛特罗贴剂与孟鲁司特钠在治疗儿童CVA上具有协同作用,联合治疗可增强疗效。本研究进一步对呼吸道症状对患儿日间生活和夜间睡眠质量的影响进行分析,发现二者较治疗前均有明显改善,与国内其他报道一致。考虑夜间睡眠质量获得改善主要是由于妥洛特罗贴剂睡前给药有效预防了“晨降”的发生。
综上所述,妥洛特罗贴剂可作为儿童CVA的诊断性治疗药物,诊断性治疗时间以2周为宜。妥洛特罗贴剂联合孟鲁司特钠在治疗CVA上具有协同作用,可达到更好的疗效,对夜间及晨起症状亦有较明显改善。另外,妥洛特罗贴剂使用方便,依从性良好,不良反应轻微,值得临床推广使用。
参考文献:
[1] 中国儿童慢性咳嗽病因构成比研究协作组,《中华儿科杂志》编辑部.中国儿童慢性咳嗽病因构成比多中心研究[J].中华儿科杂志,2012,50(2):83-92.
[2] 中华医学会儿科学分会呼吸学组,《中华儿科杂志》编辑委员会.儿童慢性咳嗽诊断与治疗指南(试行)[J].中华儿科杂志,2008,46(2):104-107.
[3] Niimi A,Ohbayashi H,Sagara H,et al.Cough variant and cough-predominant asthma are major causes of persistent cough:a multicenter study in Japan[J].J Asthma,2013,50(9):932-937.
[4] 叶飒,严建平,王宏.咳嗽变异性哮喘患者诱导痰P物质与气道反应性的关系研究[J].实用医学杂志,2013,29(16):2605-2607.
[5] De Diego A,Martinez E,Perpina M,et al.Airway inflammation and cough sensitivity in cough-variant asthma[J].Allergy,2005,60(11):1407-1411.
[6] 熊宁,彭志群,吴金飞,等.苏黄止咳胶囊治疗咳嗽变异性哮喘的有效性研究[J].中国医药,2013,8(8):1071-1072.
[7] 武晓兰,唐伟,王聪慧,等.咳嗽变异性哮喘患者Eotaxin的表达及其与肺功能的关系[J].实用医学杂志,2013,29(2):199-201.
[8] Mochizuki H,Arakawa H,Tokuyama K,et al.Bronchial sensitivity and bronchial reactivity in children with cough variant asthma[J].CHEST Journal,2005,128(4):2427-2434.
[9] Todokoro M,Mochizuki H,Tokuyama K,et al.Childhood cough variant asthma and its relationship to classic asthma[J].Annals of Allergy,Asthma & Immunology,2003,90(6):652-659.
[10]Ohkura N,Fujimura M,Nakade Y,et al.Heightened cough response to bronchoconstriction in cough variant asthma[J].Respirology,2012,17(6):964-968.
[11]Irwin RS,Baumann MH,Bolser DC,et al.Diagnosis and management of cough executive summary ACCP evidence-based clinical practice guidelines[J].CHEST Journal,2006,129(suppl 1):1S-23S.
[12]Tamura G,Ichinose M,Fukuchi Y,et al.Transdermal tulobuterol patch,a long-acting β2-agonist[J].Allergol Int,2012,61(2):219-229.
[13]朱宏斌,张凤仙.盐酸丙卡特罗在儿童慢性咳嗽诊断性治疗中的价值[J].儿科药学杂志,2010,16(1):16-18.
[14]冯晶,尚云晓,舒林华,等.妥洛特罗贴剂治疗儿童支气管哮喘的疗效及安全性研究[J].实用药物与临床,2011,14(3):206-208.
[15]魏兵,李奇玉,蒋静,等.妥洛特罗贴剂治疗咳嗽变异性哮喘的疗效[J].实用儿科临床杂志,2011,26(9):699-700,705.
[16]Birring SS,Parker D,Brightling CE,et al.Induced sputum inflammatory mediator concentrations in chronic cough[J].Am J Rrspir Crit Care Med,2004,169(1):15-19.
[17]刘心洁.氨溴特罗联合孟鲁司特钠治疗咳嗽变异性哮喘患儿的效果观察[J].中国医药,2013,8(10):1449-1450.
[18]储毅,林芊,霍婧,等.妥洛特罗贴剂治疗咳嗽变异性哮喘的有效性和安全性研究[J].临床儿科杂志,2012,30(2):183-186.
[19]Katsunuma T,Fujisawa T,Nagao M,et al.Effects of transdermal tulobuterol in pediatric asthma patients on long-term Leukotriene receptor antagonist therapy:results of a randomized,open-label,multicenter clinical trial in japanese children aged 4-12 years [J].Allergol Int,2013,62(1):37-43.

