氟尿嘧啶通过激活促凋亡信号通路介导人肝癌细胞凋亡的治疗作用
任召磊
0 引言
肝癌是侵入性肝脏的恶性肿瘤之一,且多见于原发性肝癌[1]。当前我国肝癌发病率居高,已严重威胁到人民健康和生命安全,造成了沉重的社会负担,其诱发的并发症也难以控制[2]。目前,临床上多采用手术切除肿瘤组织,达到清除肿瘤细胞的效果,但其突显的风险高,费用高,预后差等特性也限制了它的推广[3]。而化学治疗是治疗肿瘤等疾病的主要手段之一,氟尿嘧啶对多种肿瘤如肝癌等有一定疗效,故在临床上得到广泛应用[4]。在当前的实验中,我们拟采用体外建立稳定人肝癌HepG-2细胞株,以细胞凋亡为研究对象,研究氟尿嘧啶的抗肝癌作用与促凋亡相关通路关系,为阐明其诱导HepG-2凋亡的作用机理提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞 人肝癌HepG-2细胞株由广西医科大学附属肿瘤医院科学实验室惠赠。
1.1.2 药物与试剂 氟尿嘧啶(纯度>99.0%):Spectrum公司。DMEM培养基:Life Technologies公司。胎牛血清:上海微科生化试剂有限公司。胰蛋白酶:Life Technologies公司。四甲基偶氮唑盐(MTT):上海杰美基因医药科技有限公司。DAPI染色试剂盒:北京中生瑞泰科技有限公司。Fas和cleaved-caspase-8抗体:Life Technologies公司。蛋白裂解液:武汉博士德生物工程有限公司。磷酸甘油醛脱氢酶(GAPDH):Life Technologies公司。
1.1.3 仪器HettCube 200二氧化碳培养箱(德国Hettich公司)。XYH-3A倒置显微镜(日本Olympus公司)。HD-650超净工作台(上海皓庄仪器有限公司)。Biorad GelDoc XR伯乐凝胶成像系统(美国Bio-rad公司)。SHP-250(D)恒温培养箱(上海森信实验仪器有限公司)。
1.2 方法
1.2.1 细胞培养 无菌条件下,BD培养基中加入新配置10%胎牛血清、100 μg/mL青霉素、50 μg/mL链霉素,低温保存待用。HepG-2细胞经复苏后,移植到培养瓶中,放置于二氧化碳培养箱中孵化(37 ℃,5% CO2)。PBS缓存液冲洗5次,加入8 mL 0.2%的胰蛋白酶液,置37 ℃消化15 min。随后,细胞悬浮液移入无菌刻度离心管中,低速离心15 min后再次消化5次,然后进行MTT实验操作。
1.2.2 分组及给药 精密称取200 μg氟尿嘧啶,用含10%胎牛血清的BD培养基稀释成不同浓度的5-Fu(0、40、80、160 μM),每孔120 μL,同时设8个平行孔/组,重复实验10次,取平均值。应用GraphPad Prism 5.0软件计算IC50(半数抑制率),同时建立对照组。细胞增殖抑制率(%)=(OD对照-OD治疗)/(OD对照-OD空白)×100%
1.3 指标检测 采用四甲基偶氮唑盐(MTT)法测定5-Fu对HepG-2的抑制作用,DAPI染色检查细胞形态学的改变,Western blot法测定内源性Fas蛋白以及cleaved-caspase-8表达水平。
P<0.05为差异有统计学意义。
2 结果
2.1 5-Fu干预抑制HepG-2增殖 MTT法实验数据表明,梯度浓度5-Fu抑制HepG-2的增殖活力明显增强,与空白对照组比较差异有统计学意义(P<0.01)。而且,随着时间的增加5-Fu的抑制作用逐渐增加,体现一定的时间-剂量依赖性。见图1。

图1 5-Fu干预对HepG-2抑制增殖的作用
2.2 5-Fu干预诱导HepG-2细胞核裂变 DAPI染色结果显示,空白对照组中HepG-2的细胞排列均匀,组织形态整齐完整,胞核浆清晰,细胞增殖分化旺盛。40 μM 5-Fu干预72 h后,部分肝癌细胞体积收缩,细胞质变性明显,核破裂,表现细胞凋亡。同时,在80和160 μM 5-Fu干预后,HepG-2核染凋亡细胞明显增多,细胞凋亡形态改变明显,核裂解溶解,凋亡细胞数量增加。见图2。

图2 5-Fu干预后对HepG-2细胞组织形态的影响(DAPI染色,×200)
2.3 5-Fu干预上调HepG-2内源性Fas、cleaved-caspase-8表达 Western blotting分析数据表明,空白对照组HepG-2细胞内源性Fas、cleaved-caspase-8表达较少,基本维持在低生理水平状态。而在5-Fu干预后,HepG-2细胞Fas蛋白和cleaved-caspase-8表达水平显著增加,与空白组比较差异有统计学意义(P<0.01),表现为一定的时间-剂量依赖性。见图3。
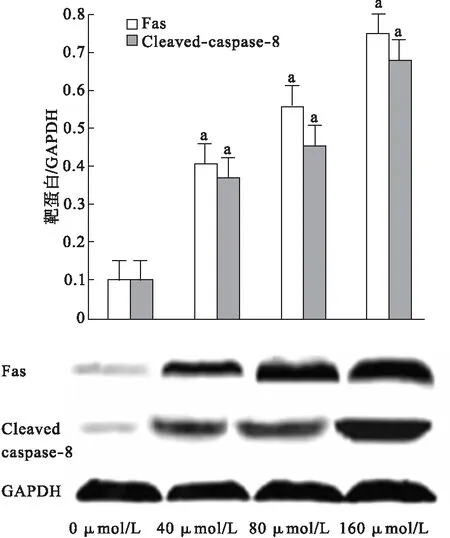
图3 5-Fu干预后对HepG-2细胞Fas蛋白和cleaved-caspase-8表达水平的影响
3 讨论
肝癌是一种严重威胁全球公众健康的疾病之一,且患者生存率低[5]。因此,鉴定具有更好的效力和较低的毒性的抗肝癌药物是迫切需求的科学攻关[6]。在当前实验中,MTT法数据显示,正常情况下HepG-2细胞增殖分化能力强,提示抑制癌症细胞过度增殖是治疗肝癌的有效手段。5-Fu干预后能有效控制HepG-2增殖分化,表明5-Fu发挥有效的抑制肝癌细胞增殖活性。而且,DAPI染色形态检查进一步显示,5-Fu可以介导HepG-2细胞核裂变,即发生细胞凋亡,其实验结果与MTT结果一致。
研究表明,细胞内Fas元件耦合其配体FasL介导细胞的杀伤作用,其机制为通过穿孔素和颗粒酶相互作用的结果。穿孔素在大量的Ca2+微环境中直接作用在靶细胞膜,并经多聚反应形成管状结构,直接插入并破坏细胞膜结构,同时颗粒酶转移至胞浆,直接招募活化胞浆中系列蛋白酶,诱导细胞发生程序性凋亡[7-8]。半胱氨酸蛋白酶caspase-8因具有FADD样结构域,而且与DED结构域结合,从而将细胞膜外信号转化为细胞浆内在联系。当细胞膜表面的Fas与其配体FasL多聚化而激活时,触发FADD与受体胞浆区死亡结构域互相结合,胞浆中变构后(剪切)caspase-8,使下游蛋白酶发生逐级活化,从而启动细胞内交联的细胞凋亡进程[9-10]。因此,癌细胞内源性Fas/caspase-8通路是抗肿瘤药物开发的潜在靶点。本实验Western blotting结果表明,HepG-2细胞内源性Fas蛋白和cleaved-caspase-8水平显著减少。在5-Fu干预后,HepG-2细胞中Fas蛋白和cleaved-caspase-8水平有效地上调,表明5-Fu特异性激活Fas蛋白活性,从而增强caspase-8剪切水平,进而启动系列程序诱导靶细胞发生凋亡。我们推测5-Fu介导的抗肝癌作用与其激活HepG-2内源性Fas信号通路有关,并将为其今后的临床应用提供科学理论支持。
参考文献:
[1] Yang-Sheng L,Tao-Yeuan W,Jiunn-Chang L,et al.Hepatic carcinosarcoma:clinicopathologic features and a review of the literature[J].Ann Hepatol,2013,12(3):495-500.
[2] Son SH,Choi BO,Ryu MR,et al.Stereotactic body radiotherapy for patients with unresectable primary hepatocellular carcinoma:dose-volumetric parameters predicting the hepatic complication[J].Int J Radiat Oncol Biol Phys,2010,78(4):1073-1080.
[3] Takahashi S,Konishi M,Kinoshita T,et al.Predictors for early recurrence after hepatectomy for initially unresectable colorectal liver metastasis[J].J Gastrointest Surg,2013,17(5):939-948.
[4] Van Kuilenburg AB,Maring JG.Evaluation of 5-fluorouracil pharmacokinetic models and therapeutic drug monitoring in cancer patients[J].Pharmacogenomics,2013,14(7):799-811.
[5] Cohen MJ,Bloom AI,Barak O,et al.Trans-arterial chemo-embolization is safe and effective for very elderly patients with hepatocellular carcinoma[J].World J Gastroenterol,2013,19(16):2521-2528.
[6] Lencioni R,Crocetti L.Local-regional treatment of hepatocellular carcinoma[J].Radiology,2012,262(1):43-58.
[7] Villa-Morales M,Fernández-Piqueras J.Targeting the Fas/FasL signaling pathway in cancer therapy[J].Expert Opin Ther Targets,2012,16(1):85-101.
[8] Yao Y,Lu S,Li H,et al.Low doses of exogenous interferon-γ attenuated airway inflammation through enhancing Fas/FasL-induced CD4+T cell apoptosis in a mouse asthma model[J].J Interferon Cytokine Res,2012,32(11):534-541.
[9] Toporkiewicz M,Grzybek M,Meissner J,et al.Release of an 55kDa fragment containing the actin-binding domain of β-spectrin by caspase-8 during FND-induced apoptosis depends on the presence of protein 4.1[J].Arch Biochem Biophys,2013,535(2):205-213.
[10]Liu WH,Chang LS.Fas/FasL-dependent and -independent activation of caspase-8 in doxorubicin-treated human breast cancer MCF-7 cells:ADAM10 down-regulation activates Fas/FasL signaling pathway[J].Int J Biochem Cell Biol,2011,43(12):1708-1719.

