细胞免疫在三阴性乳腺癌治疗中的临床研究
王 征,翟晓建,叶新平,李 琰,郭 满,李伟汉,张 浩
(1.河南省南阳市中心医院乳腺外科 473000;2.广西医科大学第一附属医院普外科,南宁 530000;3.南阳医学高等专科学校普外科,河南南阳 473061)
三阴性乳腺癌(triple-negative breast cancer,TNBC)发病较低,占乳腺癌患者总数的12%~17%[1]。但其有恶性程度高、预后差等特点[2-4],治疗以细胞毒性药物化疗为辅助治疗,但效果不佳。由于受体缺乏,内分泌治疗及针对人类表皮生长因子受体2(HER-2)过表达的靶向治疗也无效[5]。所以大家都在尝试新的治疗方法。细胞因子激活杀菌细胞(CIK)细胞疗法成为抗肿瘤过继性细胞免疫治疗的首选方案。本研究尝试应用CIK联合化疗治疗TNBC,评估以CIK为基础免疫治疗TNBC的有效性和安全性。
1 资料与方法
1.1 一般资料 本研究选取2007年1月至2013年1月就诊于南阳市中心医院乳腺外科、广西医科大学第一附属医院普外科、南阳医学高等专科学校普外科住院的TNBC患者420例,分成两组,分别为CIK免疫细胞治疗加TA方案化疗的CIK联合化疗组和单纯TA方案化疗的对照组,详细了解入组患者病史,进行全面的体格检查并行卡氏功能状态评分(KPs),KPs评分标准:KPs≥60分;预计生存期大于6个月。排除心、肝、肾功能不全;并发其他恶性肿瘤;有精神或心理疾病不能配合治疗及疗效评估者。入组患者治疗前签署知情同意书。两组患者年龄、肿瘤分期、淋巴结转移情况之间无明显差异。
1.2 方法 CIK细胞制备及回输,先用Ficoll-泛影酸钠(Ficoll-Hypaque)密度梯离心将患者外周血的单核细胞分离,重悬于10%胎牛血清(FBS)的RPMI 1640培养液中,以2×106mL-1铺满培养瓶后,按1000U/mL浓度加入γ-干扰素,在37℃、5%CO2培养箱中孵育;第2天加CD3单抗和IL-2继续培养;培养10~14d后收集CIK细胞。经检验合格后,制成100 mL CIK细胞悬液,静脉回输患者。CIK细胞回输前2d进行细菌学检测,回输前1h进行细菌内毒素检测;对输入的CIK细胞用流式细胞仪(美国BD公司的FACS CaIiur)对CD3、CD4、CD8、NKT等标记细胞进行测定和分析。
1.3 统计学处理 采用SPSS17.0软件进行数据分析,两两比较采用t检验,率的比较采用χ2检验,生存时间比较应用Log-rank检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 安全性评价结果 按照WHO标准评估每次治疗周期中对两组患者化疗的不良反应强度,回输后临床观测到无明显的不良反应。两组均有白细胞、血小板减少,肝功能损害,胃肠道反应、发热等常见不良反应,在治疗过程中未完成CIK治疗2例,化疗后不能耐受反应退出4例,但均无死亡事件发生,在输注CIK细胞过程中有2例出现发热反应,但未超过38.5℃,观察后退热。两组的不良反应接近,见表1。
2.2 细胞免疫功能 分析两组治疗前后T细胞免疫功能检测结果,CIK治疗后CD3+、CD8+、NKT细胞比例升高,与对照组比较,差异有统计学意义(P<0.05),见表2。
表2 化疗联合CIK组和单纯化疗组患者外周血T细胞亚群的变化()
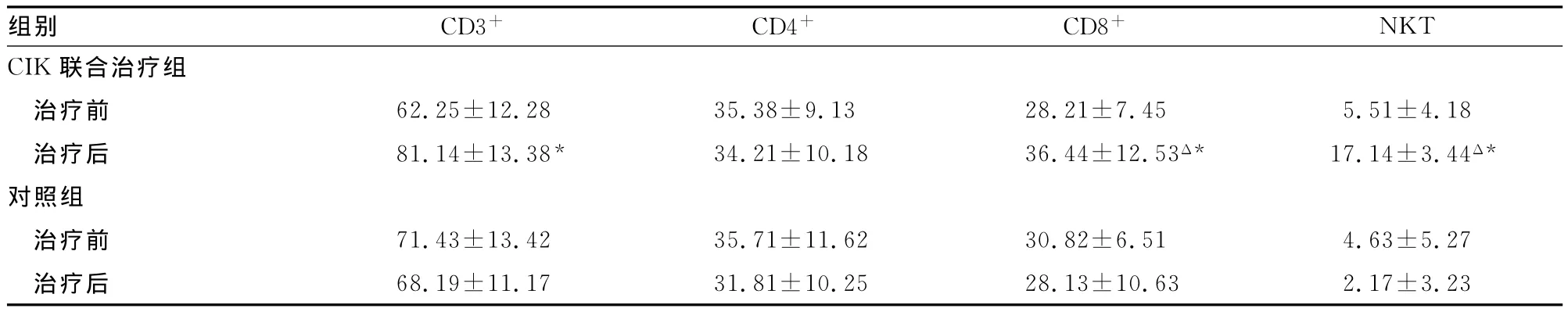
表2 化疗联合CIK组和单纯化疗组患者外周血T细胞亚群的变化()
*:P<0.05,与同组治疗前比较;Δ:P<0.05,与对照组治疗后比较。
NKT CIK组别 CD3+ CD4+ CD8+联合治疗组治疗前 62.25±12.28 35.38±9.13 28.21±7.45 5.51±4.18治疗后 81.14±13.38* 34.21±10.18 36.44±12.53Δ* 17.14±3.44Δ*对照组治疗前 71.43±13.42 35.71±11.62 30.82±6.51 4.63±5.27治疗后 68.19±11.17 31.81±10.25 28.13±10.63 2.17±3.23
2.3 生存质量评价 两组患者应用欧洲癌症研究与治疗组织生存质量核心量表(TORTC)评估治疗后的生存质量。两组患者躯体功能、角色功能、认知功能、情绪功能、社会功能、整体生活质量比较,研究组比对照组评分高,差异有统计学意义(P<0.05),见表3。
表3 两组患者EORTC QLQ-C30各项评分比较()

表3 两组患者EORTC QLQ-C30各项评分比较()
项目 研究组 对照组P躯体功能 80.0±6.7 65.0±7.2 <0.05角色功能 67.0±8.2 50.6±7.0 <0.05认知功能 81.5±4.5 67.1±10.1 <0.01情绪功能 63.4±8.7 54.1±6.2 <0.05社会功能 65.4±9.4 50.3±8.7 <0.05整体生活质量 60.2±8.1 46.7±7.2 <0.01

图1 两组间生存曲线的比较
2.4 化疗加CIK组与单纯化疗组患者治疗后的生存时间评价 通过电话随访、门诊复诊及书信随访等形式,随访6~48个月,其中,失访13例,在治疗过程中未完成CIK治疗2例,化疗后不能耐受反应退出4例。应用Log-rank检验比较两组生存时间,得出χ2=5.982,P=0.021,提示化疗联合CIK治疗提高患者的生存时间,见图1。
3 讨 论
乳腺癌的发生、发展中存在免疫逃避、免疫抑制的机制。CIK是过继性免疫治疗中的一种常见的、有效的手段。安全性高,在心包内灌注也有较高的安全性[6]。在本研究中发现CIK联合化疗与单纯化疗的不良反应相近,仅在单纯输注CIK免疫细胞过程中出现中度发热,但无恶性不良反应发生。CIK细胞在外周血中的含量极少(约为1%~5%),只有扩增后才能应用于临床肿瘤的治疗。临床中使用的CIK细胞是通过将采集的患者外周血单个核细胞在体外与抗CD3微粒体抗体(McAb)、IL-2及干扰素-γ(IFN-γ)等细胞因子共同培养,然后获得一种异质细胞群。该细胞群兼具T淋巴细胞强大的抗瘤活性及NK细胞的非主要组织相容性复合体限制性杀伤肿瘤细胞的特点[7]。CIK细胞对不同肿瘤细胞株有很强的杀伤作用[8]。CIK细胞与淋巴因子激活的杀伤细胞(lymphokine activated killer cells,LAK)[9]、肿瘤浸润淋巴细胞(tumor infiltration lymphocyte,TIL)和 CD3单抗激活的杀伤细胞(anti-CD3 antibody induced activated killer,CD3AK)等过继性免疫治疗手段相比,具有细胞扩增快、杀瘤活性强、杀瘤谱广泛、对多重耐药肿瘤细胞疗效佳、不良反应小等优势,已成为过继性细胞免疫抗肿瘤治疗的首选方案。CIK细胞治疗能够降低肿瘤患者外周血TRAG比例,提高CD3+、CD4+细胞比例及CD4+/CD8+细胞比值,从而减轻或消除肿瘤患者的免疫抑制状态[10]。本研究中检测T治疗后细胞亚群相对计数发现,CIK联合化疗治疗后患者CD3+、CD8+、NKT细胞百分比较治疗前明显提高,与单纯化疗组相比,CD3+、CD8+、NKT细胞百分比也升高,单纯化疗组患者T细胞亚群比例降低,说明患者接受CIK治疗后免疫细胞增加,免疫功能增强,减轻了化疗引起的免疫抑制作用,说明CIK治疗有助患者T细胞功能的恢复,达到抗肿瘤目的。在生存质量评价中,EORTC QLQ-C30各项评分均有提高,提示肿瘤患者整体生活质量改善。生存时间上,本研究中患者的生存时间与对照组比较差异有统计学意义,生存时间高于对照组,说明在预后方面有较好的效果。总之,CIK细胞免疫治疗作为辅助治疗有较好的有效性及安全性,为TNBC的治疗提供了一种新的选择。
[1]Foulkes WD,Smith IE,Reis-Filho JS.Triple-negative breast cancer[J].N Engl J Med,2010,363(20):1938-1948.
[2]Solin LJ,Hwang WT,Vapiwala N.Outcome after breast conservation treatment with radiation for women with triple-negative early-stage invasive breast carcinoma[J].Clin Breast Cancer,2009,9(2):96-100.
[3]Lund MJ,Trivers KF,Porter PL,et al.Race and triple negative threats to breast cancer survival:apopulationbased study in Atlanta,GA[J].Breast Cancer Res Treat,2009,113(2):357-370.
[4]Chu QD,Henderson AE,Ampil F,et al.Outcome for patients with triple-negative breast cancer is not dependent on race/ethnicity[J].Int J Breast Cancer,2012,27(6):764-770.
[5]Liedtke C,Mazouni C,Hess KR,et al.Response to neoadjuvant therapy and long-term survival in patients with tri-ple-negative breast cancer[J].J Clin Oncol,2007,26(8):1275-1281.
[6]熊锐华,田秀荣,姚红兵,等.CIK细胞的心包腔内灌注在恶性心包积液治疗中的临床研究[J].重庆医学,2013,42(2):151-153.
[7]Verneris MR,Karami M,Baker J,et al.Role of NKG2D signaling in the cytotoxicity of activated and expanded CD8+T cells[J].Blood,2004,103(8):3065-3072.
[8]李新灵,王志爽,邵晓枫,等.CIK细胞体外诱导培养及对不同肿瘤细胞株的细胞毒作用[J].天津医药,2013,25(8):759-762.
[9]Yashin DV,Sashchenko LP,Kabanova OD,et al.The CD8+population of LAK cells can lyse both HLA-positive and HLA-negative cancer cell lines[J].Dokl Biol Sci,2009,426:296-297.
[10]罗光华,马鸣,郭莉莉,等.CIK细胞治疗对肿瘤患者外周血免疫细胞亚型的影响[J].中国肿瘤生物治疗杂志,2013,36(4):475-477.

