STAT5a在乳腺癌组织中的低表达与患者不良预后相关*
刘 威, 龙梅珺, 吴珏堃, 李 玺, 邱万寿△
(1广州市红十字会医院乳腺科,广东 广州 510220; 2中山大学附属第三医院甲乳外科,广东 广州 510630)
信号转导和转录活化蛋白5a(signal transducer and activator of transcription 5a, STAT5a)是信号转导和转录活化蛋白家族的重要成员,能够影响细胞的增殖、分化、存活与凋亡,并且在乳腺发育及肿瘤的发生发展中具有重要作用[1-2]。本研究采用免疫组化方法检测STAT5a在乳腺癌组织中的表达情况,分析STAT5a蛋白的表达与乳腺癌患者临床病理特征及预后之间的关系,探索STAT5a在乳腺癌患者中潜在的临床意义。
材 料 和 方 法
1 研究对象及分组
收集2007年01月至2009年01月期间在中山大学附属第三医院行乳腺手术病人的乳腺组织标本110例,其中病理组织学证实为浸润性乳腺癌的组织标本100例,另外10例为正常乳腺组织标本,作为对照组。所有患者均为女性。入组乳腺癌组的病人需要满足如下条件:(1) 所有乳腺癌患者在术前均经过系统检查获得较为准确的临床分期,并且排除远处转移;(2)所有患者均为原发性乳腺癌,术前未经任何化疗、放疗和其它抗肿瘤治疗;(3) 患者行乳腺癌改良根治术或根治术,术后依照患者的临床病理学情况进行规范的术后辅助治疗,且有完整的临床病案资料,均随访5年以上。
2 免疫组化试剂及方法
2.1试剂 鼠抗人STAT5a多克隆抗体,购自Abcam,稀释100倍。DAB显色试剂(二氨基联苯胺)购自上海江莱生物科技有限公司。
2.2免疫组化SP法染色步骤 将入组的乳腺组织标本切片做STAT5a的免疫组化检测,具体方法如下:(1) 烤片;(2) 脱蜡和水化;(3) 微波抗原修复:将切片放入EDTA 抗原修复液(1∶50稀释)容器中,置微波炉用中高火加热至沸腾,沸腾后继续加热10 min,然后断电,自然冷却至室温;(4) 甩去PBS缓冲液,放在3% H2O2中室温孵育15 min; (5) 滴加山羊血清封闭液,室温下孵育30 min; (6) 甩去PBS缓冲液,每张载玻片加适量的Ⅰ抗STAT5a抗体,空白对照组用PBS缓冲液代替Ⅰ抗,置于4℃冰箱湿盒内过夜;(7) 次日于37 ℃恒温箱中复温30 min,每张载玻片加适量的Ⅱ抗,37 ℃恒温箱中恒温孵育30 min; (8) 每张载玻片滴加适量新鲜配制的DAB显色剂(1∶50配制),显微镜下控制反应时间(显色时间约为2 min),阳性显色为棕黄色或者黄褐色,自来水冲洗5 min,终止反应;(9) 甩去自来水,苏木素复染5 min,自来水冲洗5 min,终止反应;(10) 切片用盐酸乙醇分化5 s,然后用自来水充分冲洗20 min;(11) 脱水透明:梯度乙醇脱水;(12) 封片;(13) 镜下观察、拍照、评分。
2.3染色对照 用 PBS缓冲液(pH 7.4)替代Ⅰ抗作为阴性对照。用已知阳性切片做阳性对照。
2.4结果判断 STAT5a以细胞核和细胞浆出现棕黄色或黄褐色颗粒为阳性反应,阴性表达细胞呈淡蓝色。参照Fromowitz的评分标准,在400倍高倍镜视野下每张切片随机观察10个视野,采用阳性细胞占观察细胞百分比结合阳性细胞染色程度进行判断,阳性细胞数所占比例: 无阳性细胞计为0分,<25%为1分,25%~50%为2分,51%~75%为3分,>75%计为4分;染色程度: 无色计为0分,淡黄色计为1分,棕黄色计为2分,棕褐色为3分。两者得分总和即为最后评分,最后评分0~1分为阴性,2~7分为阳性。
3 病例资料收集及随访
所有乳腺癌病例进行电话随访、查阅病例资料等方式获取生存时间资料(随访自手术日起,以死亡为观察终点)。通过查阅患者的病案资料,获取患者的发病年龄、月经状况、临床分期、肿瘤大小、淋巴结转移情况、肿瘤分级、病理类型、分子分型、免疫组化指标(ER、PR、HER-2)等临床病理资料。
4 统计学处理
结 果
1 STAT5a在乳腺癌组织及正常乳腺组织中的表达情况
STAT5a以目标细胞的细胞浆和细胞核出现棕黄色或者黄褐色的颗粒为阳性反应,见图1,阴性表达细胞呈淡蓝色。100例浸润性乳腺癌标本中,STAT5a的阳性表达率为46%;在10例正常乳腺组织中均未见STAT5a阳性表达,2组比较差异有统计学意义(2=7.906,P<0.05)。
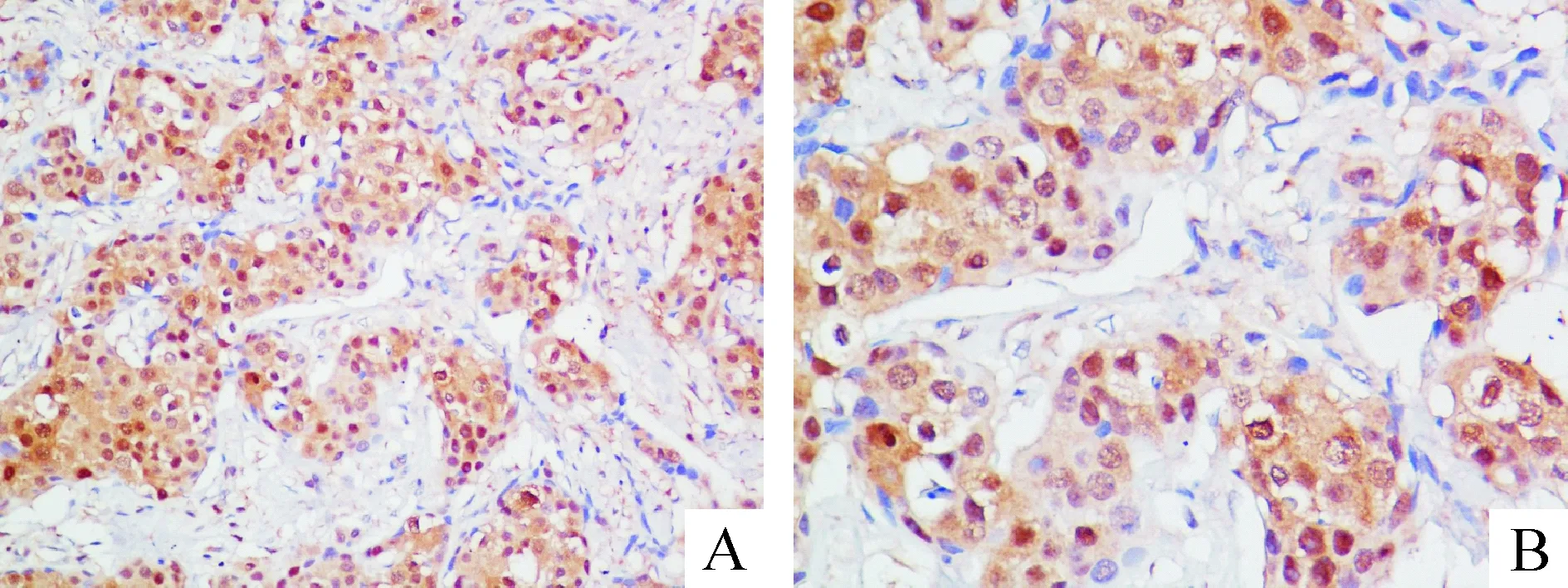
Figure 1. The positive expression of STAT5a in the breast cancer. A: ×200; B:×400.
2 STAT5a在乳腺癌组织中的表达情况与临床病理因素之间的关系
乳腺癌组织中STAT5a的表达与患者的年龄、月经状态、淋巴结转移个数、临床分期、肿瘤大小及分子标记物(HER-2)的表达情况无关(P>0.05),而与肿瘤分级及激素受体(ER、PR)表达情况之间呈显著相关(P<0.05)。在100例浸润性乳腺癌中,6例I级分化乳腺癌,56例Ⅱ级分化乳腺癌,38例Ⅲ级分化乳腺癌,其STAT5a阳性表达率分别为66.67%、60.71%和21.05%,各组比较差异有统计学意义(P<0.05)。STAT5a阳性表达率在ER+与ER-、PR+与PR-的乳腺癌之间差异均有统计学意义(P<0.05),见表1。
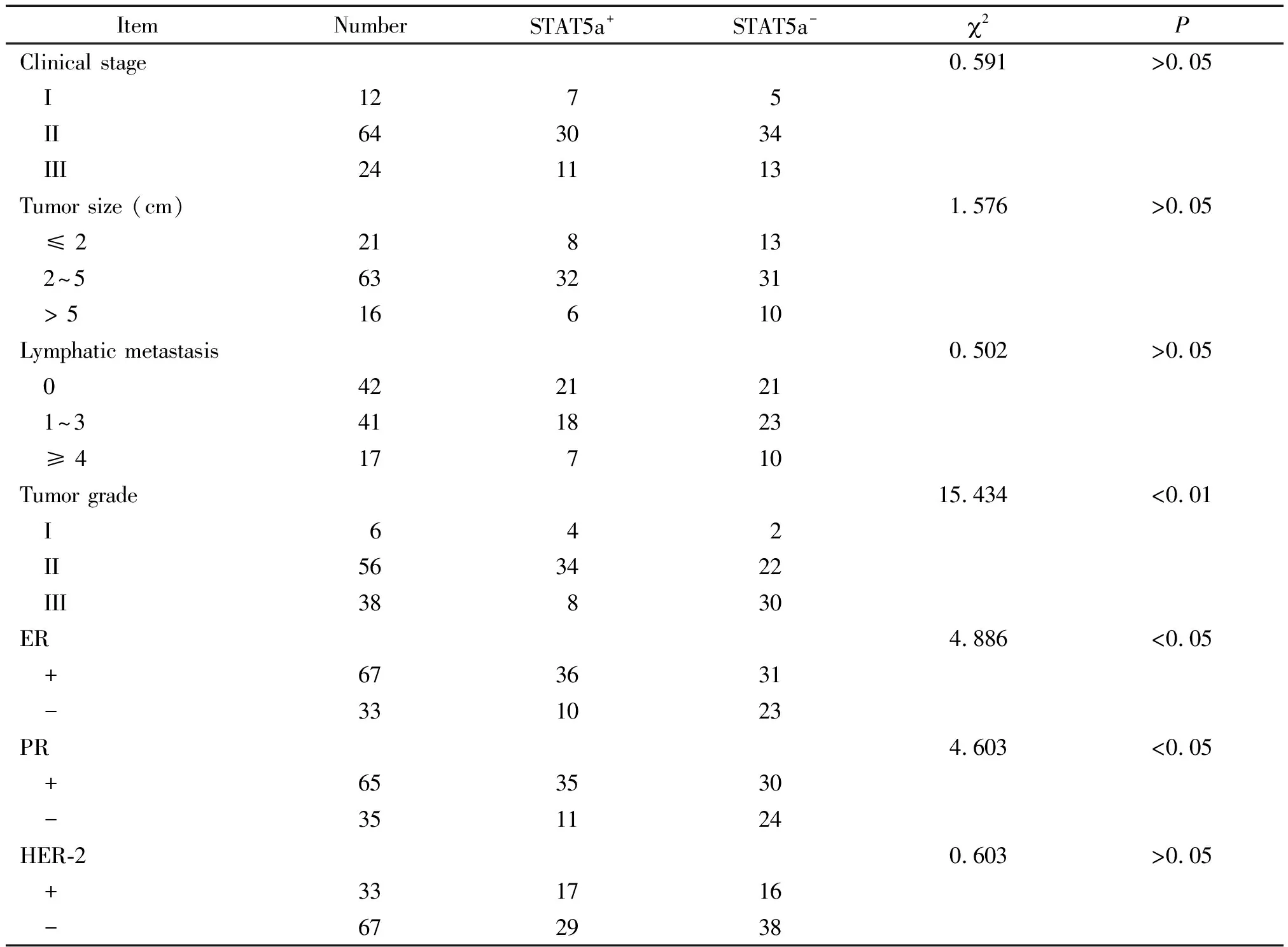
表1 STAT5a在乳腺癌组织中的表达情况与临床病理因素之间的关系
3 STAT5a在乳腺癌组织中的表达情况与分子亚型之间的关系
在100例浸润性乳腺癌中,luminal A 型乳腺癌中STAT5a阳性表达率为54.55%,luminal B 型乳腺癌中STAT5a阳性表达率为47.22%,HER2 过表达型乳腺癌中STAT5a阳性表达率为33.33%,三阴型乳腺癌中STAT5a阳性表达率为38.46%,各组的STAT5a阳性表达率比较差异无统计学意义(P>0.05)。
4 乳腺癌病人生存分析
生存分析发现STAT5a阳性组乳腺癌患者5年生存率高于STAT5a阴性组,2组比较差异有统计学意义(P<0.05),STAT5a阳性组患者具有一定的生存优势,见图2。单因素分析发现临床分期、淋巴结转移情况及STAT5a表达情况与患者5年生存率之间存在关联,并有统计学意义(P<0.05)。利用 Cox 比例风险模型进行分析发现,STAT5a、淋巴结转移情况及临床分期是影响乳腺癌患者生存的预后因素,见表2。
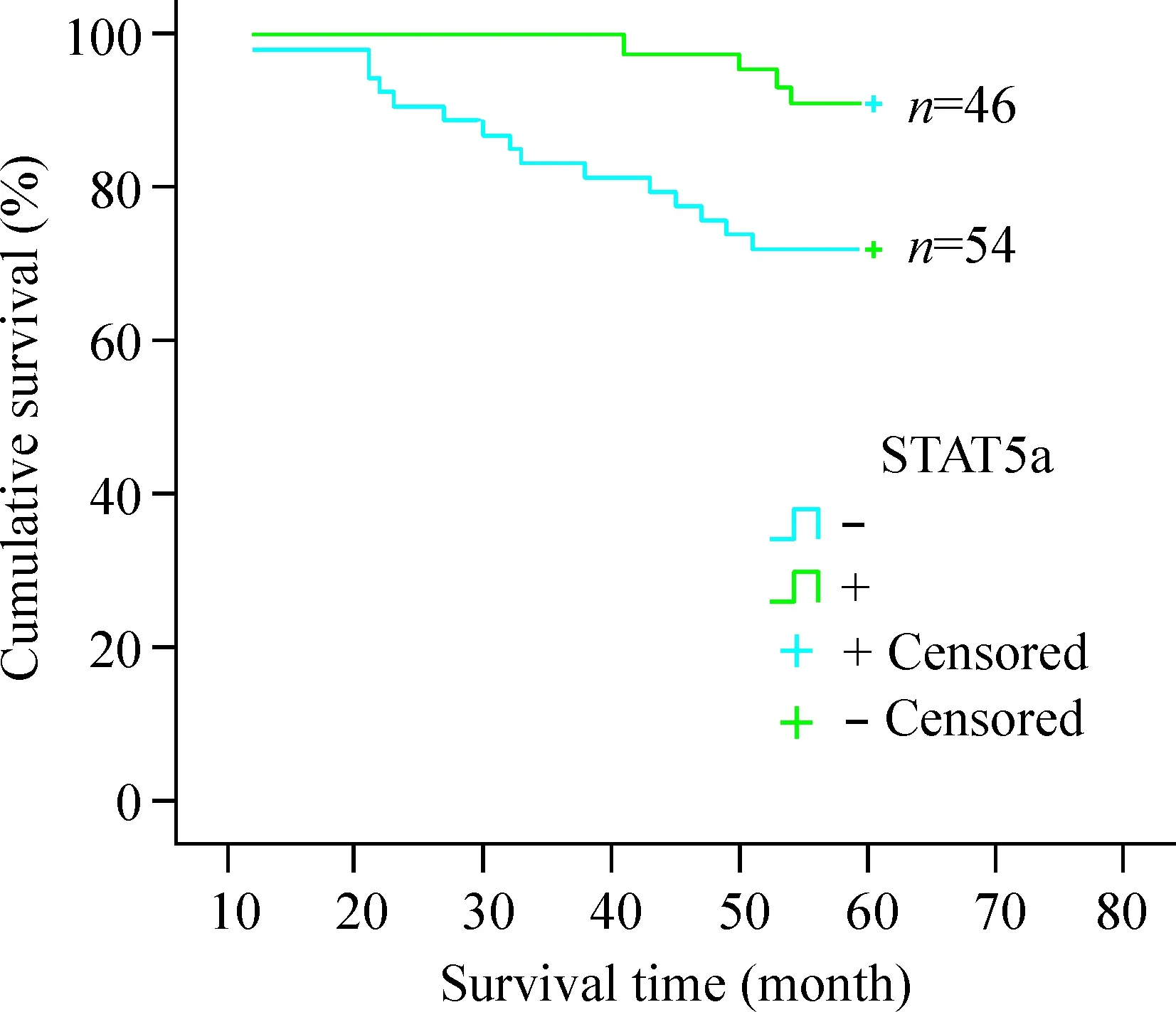
Figure 2. Kaplan-Meier plots of cumulative survival for STAT5a positive patients and STAT5a negative patients.

表2 100 例乳腺癌患者Cox回归模型多因素分析
讨 论
乳腺癌是世界范围内女性发病率最高的一种恶性肿瘤,约占女性全身恶性肿瘤的7%~10%。据世界卫生组织国际癌症研究中心统计,2008年全球约有138万新发女性乳腺癌病例,占全部女性恶性肿瘤新发病例的22.9%,全年因乳腺癌死亡的女性达46万,占所有女性恶性肿瘤死亡病例数的13.7%[3]。目前,全世界乳腺癌发病率正以每年3%的速度增长,乳腺癌患者群亦呈现出年轻化的趋势[4]。因此,乳腺癌严重危害着广大妇女的身心健康,对乳腺癌诊治的研究具有非常重要的意义。
在乳腺癌研究领域中,STAT5a是信号转导和转录活化蛋白家族的重要成员。信号转导与转录活化蛋白广泛存在于细胞浆中,目前发现STATs 家族共有7 个成员:STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6。具有高度保守分子结构的STATs家族成员可在多种信号转导途径中发挥作用,对人体免疫、细胞增殖、分化、存活等产生重要影响[5]。在STATs家族中,STAT5a由于能够影响细胞的增殖、分化、存活与凋亡,并且在乳腺发育及多种肿瘤的发生发展等中具有重要作用而被广泛关注。
STAT5a蛋白在乳腺发育及其正常生理功能方面具有十分重要的作用。在分化发育过程中,STAT5a具有不可或缺的作用,STAT5a基因完全缺失,乳蛋白基因的表达会受到影响,乳腺也将无法分化[6]。在乳腺发育的不同阶段,乳腺上皮细胞中都能检测到一定量STAT5a蛋白的表达。但STAT5a蛋白并不是以一种相对稳定的模式表达,STAT5a的酪氨酸磷酸化状态与乳蛋白基因的活化及乳腺的发育状态存在密切的关系。在妊娠后期和泌乳早期,STAT5a的磷酸化水平增加,而在哺乳后期则会下降。在乳腺退化的阶段,STAT5a作为一个具有抗凋亡作用的存活因子而存在,其抗凋亡作用可能是通过调控下游靶基因Bcl-xL实现的[7-8]。
目前大量研究已证实STAT5a在乳腺上皮细胞中不适当活化可诱发乳腺癌的事实[9-11]。小鼠乳腺癌研究的数据表明,在乳腺癌早期,STAT5a可促进乳腺上皮细胞的恶性转化并加快肿瘤的生长,这对肿瘤的发生是非常重要的[12]。然而,STAT5a在恶性乳腺上皮细胞中是具有双重功效的,有学者发现在乳腺癌晚期,STAT5a是调控并促进乳腺上皮细胞分化的关键分子,它能够有效地延缓肿瘤的侵袭和转移进程[13]。
在正常乳腺组织中, STAT5a 蛋白多以无活性的状态存在于胞质中, 而在乳腺癌细胞中STAT5a则被持续活化并易位入核内。陈晶等[14]研究发现低分化乳腺癌组织中STAT5蛋白表达水平高于高分化乳腺癌, 提示STAT5可能与乳腺癌的分化有关,且STAT5高表达于肿瘤较大、有淋巴结转移、较晚的临床分期和激素受体阴性的乳腺癌,但缺乏与患者生存预后关系的研究。张秀忠等[15]的研究结果发现STAT5在乳腺癌组织中的阳性表达在乳腺癌发生和侵袭转移中起重要作用,但其与预后无明显关系。Cotarla等[16]的一项包括 78例乳腺癌标本的研究发现乳腺癌组织中STAT5a的阳性表达率高达76%,其阳性表达与乳腺癌组织学高分化、核内p27表达水平的增加和不良预后有关。Yamashita等[17]检测了517例乳腺癌组织,STAT5a的阳性表达率为34%,高表达于低分化、激素受体阳性乳腺癌,高表达者内分泌治疗敏感,且与患者良好预后相关。一项由Peck等[18]主持的研究发现乳腺癌组织中STAT5a的阳性表达率为42%,高表达于激素受体阳性乳腺癌,高表达者内分泌治疗敏感,STAT5a的阳性表达与患者良好预后相关。综合起来,相当比例的乳腺癌表达STAT5a,而各个研究关于STAT5a阳性表达与乳腺癌患者临床病理因素之间关系的结果不一致。最近Peck等[19]进一步的研究发现乳腺癌组织中STAT5a蛋白表达水平在乳腺癌进展中逐渐下降,而且乳腺癌中STAT5a低表达(核内蛋白水平、组织mRNA水平)与患者不良预后相关,而STAT5b则不存在这种情况。本研究结果发现乳腺癌组织中STAT5a蛋白的低表达与患者的不良预后相关,进一步证实了Peck的报道。我们推测之前的研究结果的不一致,其可能的重要原因是有些研究没有区分STAT5a与STAT5b。
本研究就STAT5a蛋白的表达与乳腺癌患者临床病理特征、预后之间的关系进行研究,结果发现:浸润性乳腺癌组织中STAT5a的阳性表达率为46%,乳腺癌组织中STAT5a的阳性表达率显著高于正常乳腺组织,提示STAT5a可能参与乳腺癌的发生、发展。分析乳腺癌组织中STAT5a的表达情况与患者临床病理因素之间的关系发现,乳腺癌组织中STAT5a的表达与患者的肿瘤分级及激素受体(ER、PR)表达情况存在关联。高分化、激素受体阳性乳腺癌组织高表达STAT5a。生存分析结果发现,STAT5a阳性组乳腺癌患者的5年生存率高于STAT5a阴性组,STAT5a阳性组乳腺癌患者具有一定的生存优势;STAT5a、淋巴结转移情况及临床分期是影响乳腺癌患者生存的独立预后因素。这些结果提示STAT5a阳性表达是乳腺癌患预后良好的指标,STAT5a可以作为乳腺癌临床预后判断的生物学标记物。
[参 考 文 献]
[1] Furth PA. STAT signaling in different breast cancer sub- types[J]. Mol Cell Endocrinol, 2014, 382(1):612-615.
[2] Vafaizadeh V, Klemmt P, Brendel C, et al. Mammary epithelial reconstitution with gene-modified stem cells assigns roles to Stat5a in luminal alveolar cell fate decisions, differentiation, involution, and mammary tumor formation[J]. Stem Cells, 2010, 28(5): 928-938.
[3] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893-2917.
[4] Lu WL, Li HX, Qian BY, et al. The clinical characteristics and prognosis of Chinese early stage breast cancer patients: a retrospective study [J]. Breast J, 2010,16(3):331-333.
[5] Ivashkiv LB, Hu X. Signaling by STATs[J]. Arthritis Res Ther, 2004, 6(4):159-168.
[6] Kloth MT, Catling AD, Silva CM. Novel activation of STAT5b in response to epidermal growth factor[J]. J Biol Chem, 2002, 277(10): 8693-8701.
[7] Mitra A, Ross JA, Rodriguez G, et al. Signal transducer and activator of transcription 5b (Stat5b) serine 193 is a novel cytokine-induced phospho-regulatory site that is constitutively activated in primary hematopoietic malignancies[J]. J Biol Chem, 2012, 287(20):16596-16608.
[8] 马向涛,余力伟,王 杉,等. Stat5b/Survivin信号转导通路调控结肠癌细胞凋亡的机制[J]. 中国病理生理杂志, 2007, 23(6):1049-1052.
[9] Gu L, Dagvadorj A, Lutz J, et al. Transcription factor Stat3 stimulates metastatic behavior of human prostate cancer cellsinvivo, whereas Stat5b has a preferential role in the promotion of prostate cancer cell viability and tumor growth[J]. Am J Pathol, 2010, 176(4):1959-1972.
[10] Liang QC, Xiong H, Zhao ZW, et al. Inhibition of transcription factor STAT5b suppresses proliferation, induces G1 cell cycle arrest and reduces tumor cell invasion in human glioblastoma multiform cells[J]. Cancer Lett, 2009, 273(1):164-171.
[11] Tang JZ, Zuo ZH, Kong XJ, et al. Signal transducer and activator of transcription (STAT)-5A and STAT5B differentially regulate human mammary carcinoma cell behavior[J]. Endocrinol, 2010, 151(1):43-55.
[12] Wierenga AT, Schepers H, Moore MA, et al. STAT5-induced self-renewal and impaired myelopoiesis of human hematopoietic stem/progenitor cells involves down-modulation of C/EBPα[J]. Blood, 2006,107(11):4326-4333.
[13] Wagner KU, Rui H. Jak2/Stat5 signaling in mammogenesis,breast cancer initiation and progression[J]. J Mammary Gland Biol Neoplasia, 2008, 13(1): 93-103.
[14] 陈 晶,单保恩,贺占国,等. 信号转导和转录激活因子5与β-catenin在乳腺癌组织中的表达及其临床意义[J]. 中国癌症杂志, 2006, 16(2):89-92.
[15] 张秀忠,任泽强,张 静. STAT5在乳腺癌组织中的表达及临床意义[J]. 徐州医学院学报, 2009, 29(7):444-447.
[16] Cotarla I,Ren S,Zhang Y, et al. Stat5a is tyrosine phosphorylated and nuclear localized in a high proportion of human breast cancers[J]. Int J Cancer, 2004, 108(5):665-671.
[17] Yamashita H, Nishio M, Ando Y, et al. Stat5 expression predicts response to endocrine therapy and improves survival in estrogen receptor-positive breast cancer [J].Endocr Relat Cancer, 2006, 13(3):885-893.
[18] Peck AR, Witkiewicz AK, Liu C, et al. Loss of nuclear localized and tyrosine phosphorylated Stat5 in breast can-cer predicts poor clinical outcome and increased risk of antiestrogen therapy failure [J]. J Clin Oncol, 2011, 29(18):2448-2458.
[19] Peck AR, Witkiewicz AK, Liu C, et al. Low levels of Stat5a protein in breast cancer are associated with tumor progression and unfavorable clinical outcomes [J]. Breast Cancer Res, 2012, 14(5):R130.

