田旋花EPSPS基因启动子的克隆、序列分析及转化
黄兆峰, 周欣欣, 黄红娟, 魏守辉, 陈景超, 杨 龙, 陈金奕, 张朝贤
(1.中国农业科学院植物保护研究所/中国农业科学院杂草鼠害生物学与治理重点实验室,北京 100193;2.农业部农药检定所,北京 100193)
草甘膦是一种广谱灭生性、内吸传导型除草剂,是国内外防除一年生及多年生杂草的主要药剂[1-6]。草甘膦的作用机制是抑制植物体内5-烯醇式丙酮酸-3-磷酸合成酶(5-enolpyruvylshikimate-3-phosphate synthase,EPSPS)的活性,导致莽草酸大量积累,并抑制芳香族氨基酸的生物合成,进而扰乱正常的氮代谢[7]。以往研究表明:植物体内EPSPS基因的过量表达可以有效提高其对草甘膦的耐药性[8-11]。
田旋花(ConvolvulusarvensisL.)属旋花科,是一种多年生恶性杂草,其繁殖和再生能力极强,是华北地区小麦、玉米、大豆等旱作物田的重要杂草[12]。已被世界粮农组织列为世界上18种危害最严重的杂草之一[13]。DeGennaro等研究发现,无草甘膦用药史的田旋花对草甘膦具有天然的耐药性[14];刘延等发现,北京房山麦田田旋花对草甘膦具有较高的耐药性,并首次克隆了田旋花EPSPS基因(GenBank登录号:EU698030)[12];张猛比较了不同田旋花种群的耐药性水平,提出草甘膦处理后的EPSPS基因在表达时间和表达量上的差异是其对草甘膦产生耐药性差异的一个重要因素[13]。
本试验利用染色体步移技术克隆了田旋花EPSPS基因的启动子序列,并对其结构进行了分析。用该启动子与GUS报告基因连接转化农杆菌,花序侵染法侵染拟南芥,获得转EPSPS-P启动子拟南芥,为进一步了解田旋花EPSPS基因的表达调控机制奠定了基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 田旋花种子采自北京市海淀区上庄镇;拟南芥种子由笔者所在实验室保存。
1.1.2 质粒和菌株 大肠杆菌DH5α购自全式金公司;质粒pBI121、农杆菌GV3101由中国农业科学院畜牧研究所晁跃辉博士惠赠。
1.1.3 试验试剂 Genome Walking Kit,T4连接酶,限制性内切酶Hind Ⅲ、XbaⅠ,PMD19-T载体,均购自TaKaRa公司。
1.2 试验方法
1.2.1 DNA提取 取田旋花新鲜叶片,用CTAB方法提取总DNA,作为克隆田旋花EPSPS基因启动子的模板。产物浓度和纯度用紫外分光光度计检测,同时在1%琼脂糖凝胶上电泳检测DNA的完整性,以进一步确定DNA的质量。
1.2.2 启动子克隆 根据NCBI上已发表的田旋花EPSPS核苷酸序列设计3条特异引物:GW-1:5′-AGAGAGATTGCTGGGGCTCAAACGC-3′;GW-2:5′-GAGGTTTAGAGAGATTGCTGGGGCT -3′;GW-3:5′-CCCACCAAATTCAATTAAGAGGTTT-3′。 引物由北京博迈德科技发展有限公司合成。
根据Genome Walking Kit的说明,采用3轮嵌套式反应程序。在第1轮反应中,分别以AP1、AP2、AP3为上游引物,GW-1为下游引物,反应程序为:95 ℃预变性1 min;94 ℃ 30 s、65 ℃ 1 min、72 ℃ 2 min,5个循环;94 ℃ 30 s、25 ℃ 3 min、72 ℃ 2 min;94 ℃ 30 s、65 ℃ 1 min,72 ℃ 2 min、94 ℃ 30 s、65 ℃ 1 min、72 ℃ 2 min,94 ℃ 30 s、44 ℃ 1 min、72 ℃ 2 min,15个循环;72 ℃延伸10 min。反应完成后,将上述PCR反应产物稀释10倍用作第2轮PCR扩增的模板,第2轮PCR反应分别以AP1、AP2、AP3为上游引物,GW-2为下游引物,进行PCR扩增,反应程序为:94 ℃ 30 s、65 ℃ 1 min、72 ℃ 2 min,94 ℃ 30 s、65 ℃ 1 min,72 ℃ 2 min、94 ℃ 30 s、44 ℃ 1 min、72 ℃ 2 min,15个循环;72 ℃延伸10 min。第3轮PCR反应分别以AP1、AP2、 AP3为上游引物,GW-3为下游引物,反应程序与第2轮反应一致。所得最终PCR产物经1%琼脂糖凝胶电泳检测,通过胶回收纯化后与 pMD19-T 连接,转化大肠杆菌后送北京博迈德科技发展有限公司测序。
1.2.3 序列的生物信息学分析 将测序结果在NCBI(http://www.ncbi.nlm.nih.gov)网站上进行BLAST比对。同时在PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)上进行在线预测,分析存在的TATA-box、CAAT-box以及其他作用元件。
1.2.4EPSPS-P启动子和GUS基因植物表达载体的构建 根据已得到的启动子序列设计2条特异性引物:EPS-P-F:5′-AAGCTTAAACCTCTTAATTGAAT-3′(含HindⅢ酶切位点)和EPS-P-R:5′-TCTAGAGGTATTTTAAAAGAGGC-3′(含XbaⅠ酶切位点),将PMD- EPSPS-P、pBI121分别用限制性内切酶HindⅠ、XbaⅠ进行双酶切,回收启动子片段,然后用T4酶连接至酶切后的pBI121中。使EPSPS-P替换pBI121中的35S启动子,得到EPSPS-P与载体中GUS报告基因相连的双元表达载体pBI-EPSPS-P。采用氯化钙冻融法将pBI-EPSPS-P导入农杆菌后,用农杆菌转化拟南芥。
1.2.5 转基因拟南芥GUS活性检测[15]将转基因拟南芥叶片用无菌水冲洗干净后放入GUS染液中,抽真空至材料表面产生少许气泡并被染液完全淹没为止,37 ℃过夜,用脱色液脱色后在体视显微镜下观察染色结果。GUS染液配方:50 mmol/L磷酸钠缓冲液(pH值7.0),5 mmol/L铁氰化钾,5 mmol/L 亚铁氰化钾,0.1% Triton X-100,1 mmol/L X-Gluc。脱色液配方:乙醇 ∶乙酸=3 ∶1。
2 结果与分析
2.1 EPSPS-P启动子片段的获得
利用染色体步移方法,通过3轮PCR扩增,得到了长约1.2 kb的DNA片段,将得到的大片段回收、测序,结果显示,该DNA片段长1 145 bp,排除与已知的田旋花EPSPS基因序列重叠部分,实际获得的启动子片段为1 142 bp(图1),可以看出该序列富含A/T,是启动子序列的重要特征之一。
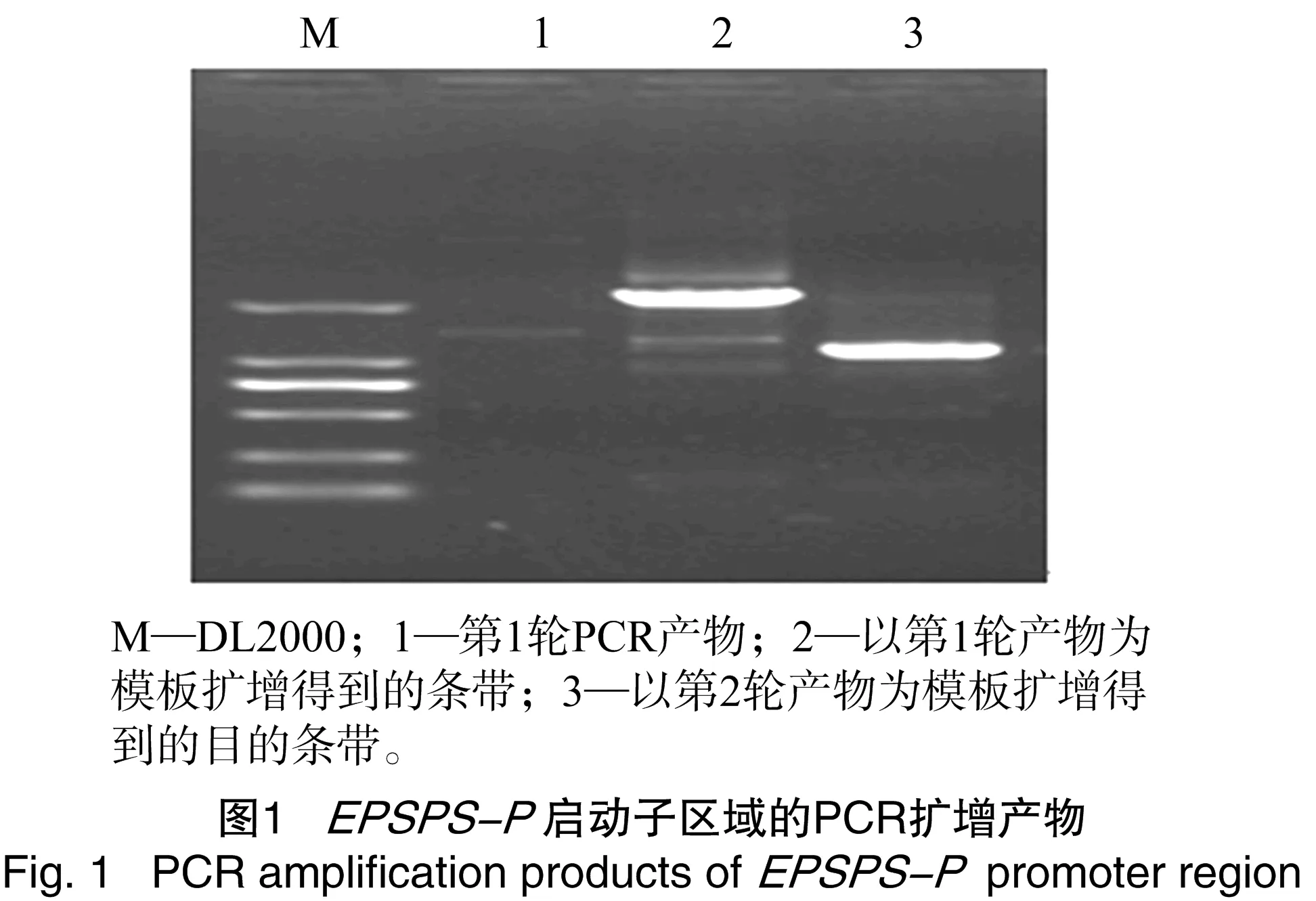
2.2 启动子的生物信息学分析
通过PlantCARE对获得的启动子序列进行分析,结果(图2)表明,EPSPS-P启动子序列中含有典型的启动子基本元件,如TATA-box 和CAAT-box,其中TATA-box(RNA聚合酶II结合位点)位于起始密码子ATG上游-40~-36。TATA-box近端的1个胁迫响应元件TC-rich repeats区位于-692~-683;此外,还有与光效应有关的元件 Sp1、GATA-motif,以及生理节奏控制元件circadian,该EPSPS基因启动子GenBank的登录号为KC107822。
2.3 植物表达载体的构建及转基因拟南芥的获得
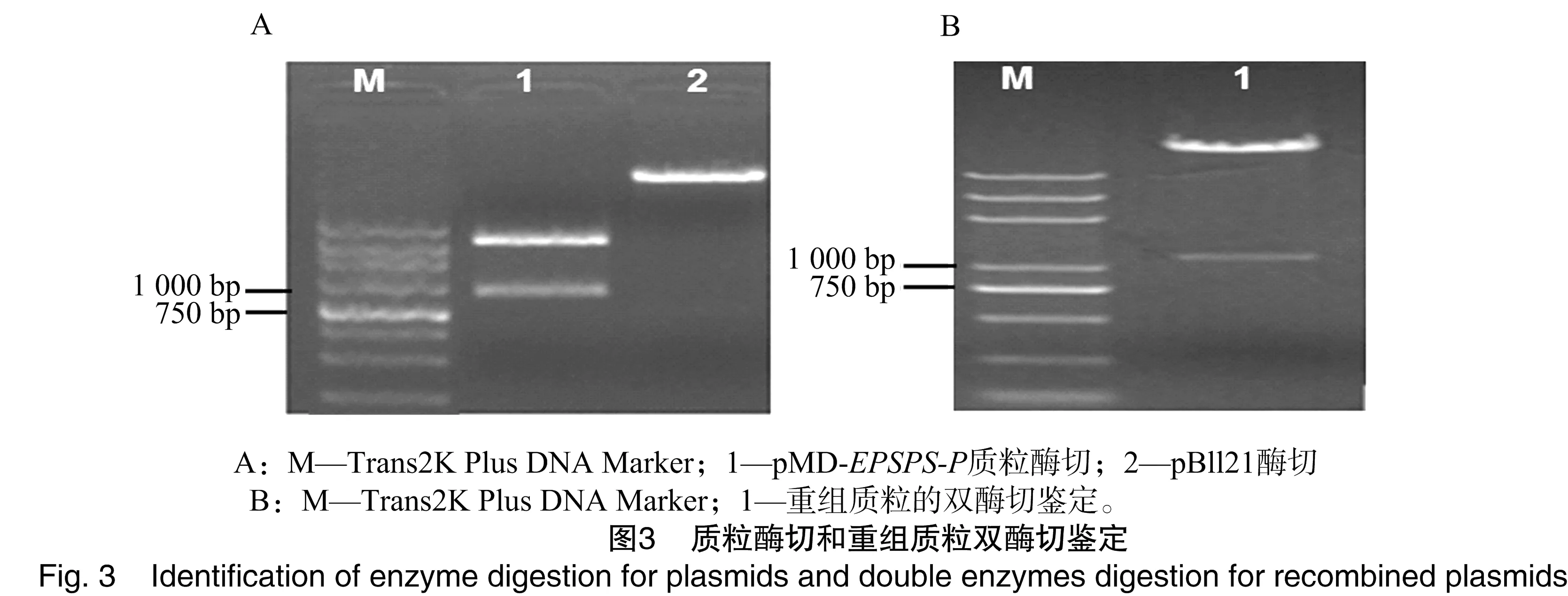
将含有启动子的pMD19-T质粒和pBI121的载体分别用HindⅢ、XbaⅠ双酶切,电泳图谱结果见图3-A;回收启动子片段,然后用T4连接酶连接至酶切后的pBI121上,经酶切鉴定(图3-B)后转化大肠杆菌DH5α。菌落经PCR扩增,初步鉴定基因已连接于载体上。挑选阳性菌落摇菌并提取质粒,用Hind Ⅲ和XbaⅠ进行双酶切鉴定,得到的目的片段大小与预测一致。经测序表明,得到的序列完全正确,植物表达载体pBl121-EPSPS-P构建成功。用冻融法将构建的植物表达载体PBl121-EPSPS-P导入根癌农杆菌GV3101中,挑取阳性菌落摇菌,提取质粒DNA并进行双酶切鉴定,得到2个条带,且大小与预期一致,说明植物表达载体pBl121-EPSPS-P已成功转入农杆菌中。用花序浸染法侵染拟南芥花序,收获种子后在含50 mg/L卡那霉素的培养基上筛选抗性苗,挑取抗性苗移栽至花盆中继续培养。

2.4 转基因拟南芥鉴定与GUS活性检测
为了检测EPSPS-P启动子是否转入拟南芥中,分别提取转基因拟南芥叶片基因组DNA,进行PCR验证。琼脂糖凝胶电泳检测结果显示均呈阳性,而野生型(WT)无特异性条带(图4)。此外。对WT和转基因拟南芥叶片进行GUS组织化学染色,由图5可以看出,染色后WT无色,而转基因拟南芥呈蓝色。表明EPSPS-P已成功转化到拟南芥中,并能启动GUS报告基因的表达。

3 讨论与结论
本研究采用染色体步移技术,通过3轮嵌套式PCR,克隆到长度为1 142 bp的田旋花EPSPS基因启动子片段,用启动子预测软件PlantCARE对该启动子片段进行分析发现,该片段除了具有启动子保守元件TATA-box及CAAT-box外,还有其他一些作用元件,如TC-rich repeats(胁迫响应元件)、spl(光响应元件)、GATA-motif(光响应元件)、CCAAT-motif(MYBHvl binding site)等。研究表明,EPSPS主要分布在叶绿体中[16-17],而叶绿体是光合作用的主要场所。在对陆地棉的研究中发现,EPSPS基因在其成熟叶片中表达量最高[18]。通过对启动子分析发现,田旋花EPSPS启动子含有2个光响应原件,这与EPSPS的分布和表达特征相符合。
很多化学诱导剂对植物的影响都是通过直接或间接地作用于植物的启动子而调控植物基因的表达,从而影响植物的生长、发育、生殖,以及植物对内外环境的反应[19]。以往的研究表明,田旋花在喷施草甘膦后,EPSPS基因在转录水平明显提高[14]。因此笔者从田旋花EPSPS基因启动子入手,克隆并通过农杆菌介导法得到了转EPSPS-P拟南芥,为进一步探究田旋花耐药性机制,以及EPSPS基因的表达调控提供了试验依据。
启动子驱动基因表达需要多个顺式元件,这些元件的种类、数量及彼此之间的顺序与距离,都可能影响基因的转录与否或转录水平[20]。目前,缺失分析法是研究启动子功能的一种重要的方法。通过5′缺失法获得不同长度的启动子片段,分别与GUS报告基因融合构建植物表达载体并转入拟南芥,对田旋花EPSPS基因启动子的诱导活性进行研究,从而明确其在草甘膦等处理条件下的调控元件,将是下一步的重点研究内容。
参考文献:
[1]彭学岗,金 涛,张景远. 除草剂面临的挑战及草甘膦复配的意义[J]. 杂草科学,2013,31(1):5-9.
[2]巩元勇,郭书巧,束红梅,等. 抗草甘膦杂草的抗性机理研究进展[J]. 杂草科学,2012,30(3):9-13.
[3]Powles S B,Yu Q. Evolution in action:plants resistant to herbicides[J]. The Annual Review of Plant Biology,2010,61:317-347.
[4]李 君,宋青春,陈秀敏. 农药草甘膦对刺参成参的急性毒性[J]. 江苏农业科学,2013,41(4):231-232.
[5]张朝贤,房 锋,张 猛,等. 草甘膦应用现状及杂草抗性研究与治理对策[J]. 中国农药,2011(8):22-26.
[6]魏松红,张景远,李 斐,等. 应用组织培养法筛选抗草甘膦水稻愈伤组织[J]. 江苏农业科学,2012,40(11):37-39.
[7]Herrmann K M,Weaver L M. The shikimate pathway[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1999,50:473-503.
[8]Wang H Y,Li Y F,Xie L X,et al. Expression of a bacterialaroAmutant,aroA-M1,encoding 5-enolpyruvylshikimate-3-phosphate synthase for the production of glyphosate-resistant tobacco plants[J]. Journal of Plant Research,2003,116(6):455-460.
[9]Ye G N,Hajdukiewicz P T J,Broyles D,et al. Plastid-expressed 5-enolpyruvylshikimate-3-phosphate synthase genes provide high level glyphosate tolerance in tobacco[J]. The Plant Journal,2001,25(3):261-270.
[10]Gaines T A,Zhang W L,Wang D F,et al. Gene amplification confers glyphosate resistance in Amaranthus palmeri[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(3):1029-1034.
[11]Powles S B. Gene amplification delivers glyphosate-resistant weed evolution[J]. PNAS,2010,107(3):955-956.
[12]刘 延,张朝贤,黄红娟,等. 草甘膦对田旋花和打碗花体内莽草酸含量的影响[J]. 杂草科学,2008(2):10-12.
[13]张 猛.田旋花对草甘膦的耐药性机理研究[D]. 北京:中国农业科学院植物保护研究所,2011.
[14]DeGennaro F P,Weller S C. Differential susceptibility of field bindweed (Convolvulusarvensis) biotypes to glyphosate[J]. Weed Science,1984,32(4):472-476.
[15]Jefferson R A. The GUS reporter gene system[J]. Nature,1989,342(6251):837-838.
[16]Gasser C S,Winter J A,Hironaka C M,et al. Structure,expression,and evolution of the 5-enolpyruvylshikimate-3-phosphate synthase genes of petunia and tomato[J]. The Journal of Biological Chemistry,1988,263:4280-4287.
[17]Della-Cioppa G,Bauer S C,Klein B K,et al. Translocation of the precursor of 5-enolpyruvylshikimate-3-phosphate synthase into chloroplasts of higher plants in vitro[J]. Proc Natl Acad Sci USA 1986,83(18):6873-6877.
[18]童旭宏,吴玉香,祝水金. 陆地棉EPSPS基因的克隆及其组织特异性表达分析[J]. 棉花学报,2009,21(4):259-264.
[19]尉万聪. 草甘膦诱导高表达基因及启动子的克隆和功能分析[D]. 北京:中国农业科学院,2005.
[20]吴智丹,王 光,郭 玲,等. 水稻启动子OsN1p的克隆与功能分析[J]. 南京农业大学学报,2012,35(2):10-14.

