不同剂量奈达铂增敏放疗治疗中晚期宫颈癌
佐志刚,邓守恒,潘东风,蔡晓军,陈 萍
(1. 湖北医药学院附属人民医院,湖北 武汉 442000;2. 湖北中医药大学,湖北 武汉 430065)
不同剂量奈达铂增敏放疗治疗中晚期宫颈癌
佐志刚1,2,邓守恒1,潘东风1,蔡晓军1,陈 萍1
(1. 湖北医药学院附属人民医院,湖北 武汉 442000;2. 湖北中医药大学,湖北 武汉 430065)
目的 观察评价不同剂量奈达铂联合调强适形放射治疗中晚期食管癌的近期疗效和毒性反应。方法 选择74例经病理学证实的ⅢA~ⅣA期中晚期宫颈癌患者分为2组,每组37例。2组均采用盆腔调强适形放射治疗联合后装治疗,盆腔放疗肿瘤靶区(GTV)剂量60 gy/30f,盆腔阳性淋巴结(GTVnd) 64~66 g`y/30f,盆腔淋巴结引流区(CTV)剂量54 gy/30f,后装治疗A点平均剂量33.5 gy。A组放疗第1周起予奈达铂20 mg/m2静滴,每周1次,共6次;B组放疗第1周起予奈达铂40 mg/m2静滴,每2周1次,共3次。2组均给予适当的止吐及补液支持治疗。治疗结束后1个月评价近期疗效,同时统计分析治疗过程中发生的毒副反应。结果 A组和B组完全缓解率分别为84%(31/37)和89%(33/37),有效率(CR+PR)均为100%,2组无显著性差异(P>0.05)。A组食欲减退、恶心及白细胞减少的发生率均明显低于B组(P均<0.05)。2组急性放射性膀胱炎及放射性直肠炎的发生率均较低,患者均可以耐受。结论 高剂量的奈达铂联合调强放疗治疗中晚期宫颈癌疗效与低剂量相似,随着奈达铂剂量的增加,胃肠道反应及骨髓毒性增加,耐受性下降。小剂量的奈达铂增敏化疗联合调强适形放疗更适合于患者。
宫颈肿瘤;调强适形放射治疗;奈达铂;化学治疗
宫颈癌是最常见的妇科肿瘤之一,每年新发病例为50万,而我国的每年新发病例为10万,占全世界发病人数的1/5[1]。多数宫颈癌患者临床表现不典型,待确诊时已属于中晚期,失去了手术机会,故放射治疗是中晚期宫颈癌最重要的治疗手段。宫颈癌调强适形放射治疗可以提高靶区剂量均匀性,从而提高局控率,保护膀胱、直肠及骨髓等危及器官,减轻放疗毒副反应,是目前主要的放疗方式[2]。单纯放疗主要失败原因在于局部未控、复发或远处转移,因此放疗增敏或同步放化疗可望提高中晚期宫颈癌治疗疗效,是目前研究的热点。铂类是目前临床上常用的放疗增敏剂,奈达铂是胃肠道反应较轻的第2代铂类衍生物,在宫颈癌中奈达铂具有放疗增敏效果已经得到证实[3-4]。为了探索不同剂量的奈达铂联合调强适形放射治疗(IMRT)用于宫颈癌的疗效及毒副反应,我院肿瘤中心对76例中晚期宫颈癌进行了随机对照试验,现将初步结果报道如下。
1 临床材料
1.1 一般资料 选择湖北医药学院附属人民医院肿瘤中心2010年3月—2012月5月收治的74例ⅢA~ⅣA期中晚期宫颈癌患者,均经宫颈活检病理学证实,具有可测量的病灶,患者均为首诊,既往未行过手术及放化疗,行腹膜后及盆腔CT增强扫描排除腹膜后淋巴结肿大患者,B超、胸部CT、ECT等检查证实无远处转移。Karnofsky评分≥80分,血常规,心、肝、肾功能基本正常,均无放化疗禁忌证。将患者随机分为A、B 2组,每组34例。2组患者基线资料比较无显著性差异(P均>0.05),具有可比性。见表1。
1.2 治疗方法

表1 2组患者一般情况比较
1.2.1 放疗方案 2组均采用相同的放疗计划,即盆腔调强适形放射治疗+腔内治疗,先盆腔外放疗,在第3周开始穿插后装治疗。①盆腔外调强适形放射治疗(IMRT):患者采用仰卧双手抱肘之于额上体位,用热塑网状体模及真空负压垫固定体位,体表标记,螺旋CT模拟定位机下L3椎体至坐骨结节下缘下5 cm水平增强扫描,整个腹盆腔5 mm层厚连续扫描。CT图像通过PACS系统传输到Eclipse三维治疗计划系统。参照盆腔MRI及超声检查记录,由医师、物理师共同勾画大体肿瘤体积(GTV),临床靶体积(CTV)、计划靶体积(PTV)及危及器官(OAR)。GTV: CT上的可见肿瘤靶区,包括子宫颈病灶及宫旁受侵范围。GTVnd:CT扫描可见的肿大淋巴结。CTV:盆腔淋巴引流区,具体包括子宫体、宫旁淋巴结、闭孔淋巴结、髂内淋巴结、髂外淋巴结、腹股沟深组淋巴结、骶前淋巴结及髂总淋巴结;上界至左右血管分叉处,下界至闭孔下缘。PTV:考虑到器官运动、机械及摆位误差,为确保CTV得到规定的处方剂量而需要扩大的照射范围,本研究在CTV基础上外扩5~10 mm。危及器官(OAR)的勾画:在定位CT图像上逐层勾画小肠、直肠、膀胱、左右股骨头及股骨颈等危及器官。给予靶体积处方剂量:GTV 60 Gy/30f,GTVnd 64 Gy/30f,CTV 54 Gy/30f,剂量保护膀胱、直肠、股骨头,计划膀胱剂量V50<30%,直肠受照剂量V40<35%,股骨头剂量V50<5%。由Eclipse治疗计划系统进行优化并计算。治疗前对每一病例于模拟机下进行治疗计划的验证。IMRT实施通过美国GE公司Varian 600 c/D加速器动态多叶调强准直器照射。②腔内照射治疗:本中心采用192 Ir高剂量率后装治疗,在盆腔外照射后第3周开始,1次/周,后装当日不做盆腔外照射,管腔与阴道治疗可同时或分别进行,管腔治疗每次A点剂量5.2 Gy,平均总剂量33.5 Gy。
1.2.2 化疗方案 A组:放疗第1周起予奈达铂20 mg/m2静滴(为了方便计算及统一剂量,予以30 mg静滴),每周1次,共6次;B组:放疗第1周起予奈达铂40 mg/m2静滴(为了方便计算及统一剂量,予以60 mg静滴),每2周1次,共3次。2组均给予适当的止吐、护肝、护胃及补液支持治疗。治疗期间每周检查血常规1次,每2周复查肝肾功能,注意观察毒副反应。
1.3 观察指标 ①近期疗效:根据治疗结束后4周的妇科检查、盆腹腔CT/MRI检查结果评价近期疗效。按照WHO实体瘤疗效评定标准分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),以CR+PR计算有效率。2组均在放化疗结束后评定疗效,随访截止于2012年10月。②毒副反应:急性放射损伤分级按RTOG标准评价2组放射性膀胱急性反应和放射性直肠急性反应。参照WHO抗癌药物毒副反应的分级标准,评价2组血白细胞和血小板下降发生率,胃肠道反应发生率,分级标准为0~Ⅳ级。
1.4 统计学方法 采用SPSS 13.0软件进行数据处理和统计分析,计数资料采用2检验,计量资料采用t检验。检验水准α=0.05。
2 结 果
2.1 近期疗效 74例患者均完成治疗。A组CR 31例,PR 7例,完全缓解率84%,总有效率100%;B组CR 33例,PR 4例,完全缓解89%,总有效率100%。2组比较差异无统计学意义(P>0.05)。
2.2 毒副反应 2组发生的放射性急性反应主要为放射性直肠炎及放射性膀胱炎,多为Ⅰ~Ⅱ级,经对症治疗可缓解,无Ⅲ~Ⅳ级的放射性损伤,无放射性股骨头坏死发生。A组中Ⅲ~Ⅳ级白细胞减少的发生率(43%)明显低于B组(73%);A组Ⅰ~Ⅱ级血小板减少的发生率为较B组的43%低,但2组差异无统计学意义,2组极少发生Ⅲ~Ⅳ级血小板减少;A组食欲减退发生率49%,B组76%,差异有统计学意义(P<0.05);A组Ⅰ~Ⅱ级恶心的发生率为24%,B组为57%,2组比较有显著性差异(P<0.05)。2组的肝肾毒性轻微。具体见表2。
3 讨 论
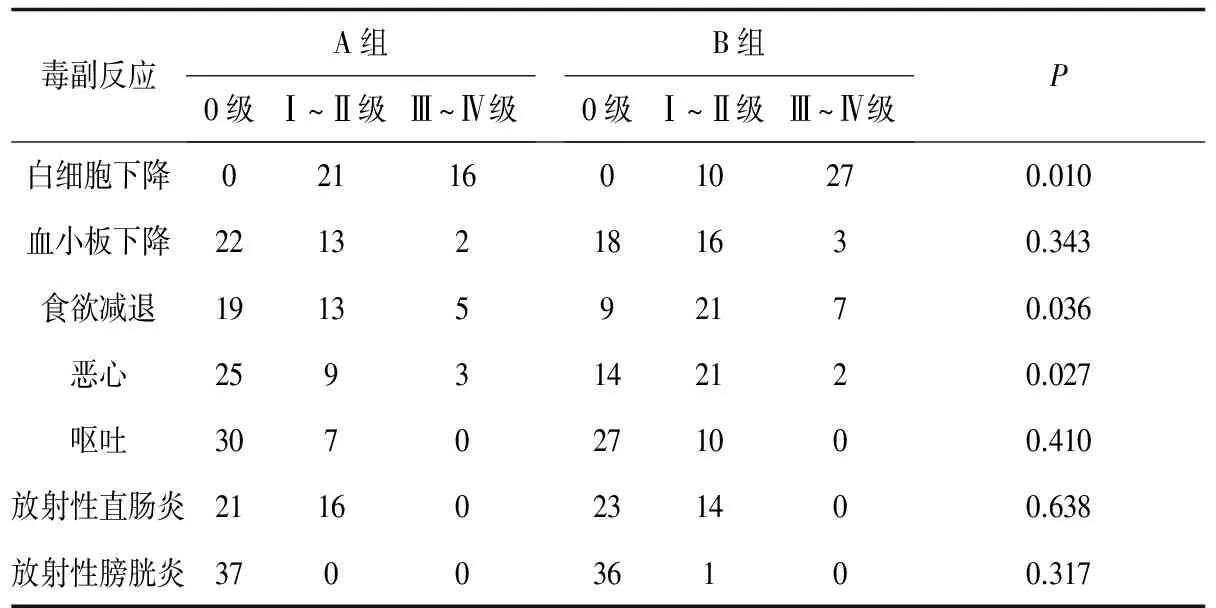
表2 2组毒副反应比较 例
在我国,宫颈癌的发病率和病死率仅次于乳腺癌,是女性最常见的恶性肿瘤[5]。对于无法手术的中晚期宫颈癌,放射治疗是其主要治疗手段。随着放疗技术的进步,宫颈癌的放射治疗已经进入精确治疗的时代。目前,调强适形放疗(IMRT)已经广泛用于宫颈癌,它具有定位精准,靶区剂量集中、均匀,能更好地提高靶区的适形度指数,减少膀胱、直肠等正常组织受照射的体积,从而更好地保护了周围正常组织及危及器官,降低患者并发症发生的概率,是一种较理想的照射技术[6-7]。单纯放疗失败的主要原因是于肿瘤局部未控或复发,以及淋巴结转移和远处转移[8]。研究表明,肿瘤细胞中存在10%~15%的乏氧细胞,该细胞对放化疗的敏感性较差,乏氧细胞再增殖是肿瘤复发和转移的主要因素[9]。化疗可以杀灭肿瘤细胞,缩小肿瘤体积,减少乏氧细胞,使肿瘤细胞周期同步化于对放疗敏感的周期,阻止放疗中肿瘤细胞的再增殖和放射性损伤的修复,提高放疗的敏感性,同时化疗也是一种全身性治疗,可以消除微小病灶,减少转移和复发的危险,因此同步放化疗已是中晚期宫颈癌标准治疗方法之一[10]。为提高中晚期宫颈癌的疗效,美国国家癌症研究所(NCI)将铂类为基础的同步放化疗作为宫颈癌的标准治疗[11-12]。由于顺铂的肾毒性及胃肠毒性大,而卡铂的血液毒性大,同步放化疗毒性也具有协同作用,患者生活质量差,往往不能耐受,故探索研究高效低毒的铂类药物是近些年国内外专家努力的目标。奈达铂是第二代铂类药物,与顺铂的结构相似,其抗癌机制与顺铂相同,主要是与核苷反应生成核苷-铂络合物,以DDP相同的方式与DNA碱基结合,并抑制DNA复制,从而产生抗肿瘤活性。Koshiyama等[13]报道,奈达铂与顺铂相比具有抗肿瘤活性高、治疗有效率高、肾毒性、血液毒性与胃肠道毒性低、水溶性高等优点,目前已经越来越多地用来代替顺铂应用于肺癌、食管癌、头颈部肿瘤、宫颈癌、卵巢癌等实体肿瘤。研究证实,奈达铂不仅可以单药或联合用于宫颈癌的治疗,而且可以同步放化疗增加放疗的敏感性。
小剂量奈达铂增敏化疗在宫颈癌的治疗中已经广泛应用于临床,但是增加药物剂量患者是否获益以及毒副反应是否增加,目前研究还比较少。笔者应用低、高剂量的奈达铂化疗联合调强适形放射治疗中晚期宫颈癌,放疗结束后4周2组完全缓解率显示无明显差异,近期疗效相似。急性毒副反应方面,主要为血液学毒性,2组Ⅲ~Ⅳ级白细胞减少的发生率有显著性差异,血小板的减少则高剂量组略高于低剂量组。胃肠道反应主要表现为Ⅰ~Ⅱ级的食欲下降及恶心,Ⅲ级以上的胃肠道反应比较少见,而食欲下降、恶心A组低于B组,差异有意义,但经过护胃、止吐等对症治疗后能很快缓解。由于调强适形放疗的实施,对膀胱、直肠等危及器官具有很好的保护作用,出现急性放射性损伤较少见,且多为Ⅰ~Ⅱ级反应,经过灌肠、抗炎等治疗,症状均可缓解。
综上所述,奈达铂化疗联合调强放射治疗中晚期宫颈癌具有较好的近期疗效。高剂量的增敏化疗与小剂量每周给药疗效相当,但出现骨髓毒性及胃肠道反应的毒性增加,患者更容易耐受小剂量方案。由于本实验仅观察了近期疗效和不良反应,其远期疗效及生存率还需要进一步观察。
[1] 刘昱,曹来英. 槲皮素抗宫颈癌的机制研究[J]. 循环医学杂志,2010,20(3):27
[2] Huh SJ,Kang MK,Han Y. Small bowel displacement system-assistedintensity-modulated radiotherapy for cervical cancer[J]. Gynecol Oncol,2004,93(2):400-406
[3] 陈玲娟,宋颖秋,伍钢,等. 奈达铂同步调强放疗治疗局部晚期宫颈癌的临床研究[J]. 临床肿瘤学杂志,2012,17(7):644-647
[4] 靳红,张云艳,成海燕. 放射治疗联合每周使用奈达铂治疗中晚期宫颈癌疗效观察[J]. 实用医药杂志,2010,14(9):68-70
[5] 殷蔚伯,李晔雄,王绿化,等. 肿瘤放射治疗手册[M]. 北京:中国协和医科大学出版社,2010:228
[6] Forrest J,Presutti J,Davidson M,et al. A dosimetfic planningstudy comparing intensity-modulated radiotherapy with four-field conformal pelvic radiotherapy for the definitive treatment of cervical carcinoma[J]. Clin Oncol(R Coil Radio1),2012,24(4):63-70
[7] 赖国静. CT模拟定位在宫颈癌三维适形调强放疗中的应用[J]. 福建医药杂志,2013,35(1):108-110
[8] 胡文惠,杨梅,赵玲. 宫颈癌淋巴结转移的危险因素及预后分析[J]. 海南医学院学报,2009,15(5):475
[9] 殷蔚伯. 食管癌的放射治疗进展[J]. 实用肿瘤杂志,2006,20(2):99-102
[10] 宋颖秋,伍钢,李贵玲,等. 盐酸伊立替康对局部晚期宫颈癌放射增敏的临床研究[J]. 临床肿瘤学杂志,2008,13(8):730-732
[11] Eifel PJ. Chemoradiotherapy in the treatment of cervical cancer[J]. Semin Radiat Oncol,2006,16(3):177-185
[12] Peters WA,Liu PY,Barrett RJ,et al. Concurrent chemotherapy and pelvicradiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix[J]. J Clin Oncol,2000,18(8):1606-1613
[13] Koshiyama M,Kinezaki M,Uchida T,et al. Chemosensitivity testing of a novel platinum analog,nedaplatin(254-S),in human gynecological carcinomas:a comparison with cisplatin[J]. Anticancer Res,2005,25(6 c):4499
陈萍,E-mail:ZLK_CP@yahoo.cn
10.3969/j.issn.1008-8849.2014.30.35
R737.33
B
1008-8849(2014)30-3386-03
2013-08-01
——再论奈达对翻译本质属性的认知

