我国药品不良反应监测体系实施效果评价
邵 蓉 唐吉锋
1.中国药科大学国际医药商学院 江苏南京 211198
2.国家药物政策与医药产业经济研究中心 江苏南京 211198
·药物政策·
我国药品不良反应监测体系实施效果评价
邵 蓉1,2*唐吉锋1
1.中国药科大学国际医药商学院 江苏南京 211198
2.国家药物政策与医药产业经济研究中心 江苏南京 211198
本文搜集1998—2013年我国药品不良反应数据,同时运用文献分析法探究我国药品不良反应监测效果的内涵,以过程、产出、结果指标体系构建药品不良反应监测体系实施效果评价概念框架。研究认为我国药品不良反应监测体系已在近几年取得了快速的发展,一定程度上运作良好,监测网络建设、审核评价效率、每百万人口报告数等效果参数表现优异,而风险控制措施、严重不良反应报告比率、不良反应报告质量、生产企业报告比等表现较差,有待进一步完善提高。
药品不良反应; 药品安全性监测; 效果评价
近年来,我国药品不良反应(Adverse Drug Reaction,ADR)监测工作持续发展。药品不良反应报告数逐年上升,监测体系初步建立,但也存在着不良反应上报主体单一、报告质量参差不齐、风险预警滞后等诸多问题。目前已有的研究多从定性角度对药品不良反应监测情况进行分析[1],在食品领域、医疗机构也开展了一些定量的指标体系构建和效果评价的研究[2-3],但对于药品不良反应监测活动的效果评价仍是空白。而如何建立科学的药品不良反应实施效果评价体系,合理有效地评价我国药品不良反应监测发展状况,是当前我国药品不良反应监测工作的一大难题。
随着新一轮《药品管理法》修订工作的展开,药品不良反应监测也面临着监管理念、制度、机制与方式的重大变革。本文基于药品不良反应监测实施效果评价的概念框架,分析当前我国药品不良反应监测的效果,并结合《药品管理法》修订中关于药品不良反应监测的新动向,为优化我国药品不良反应监测体系和完善监测工作提出建议。
1 药品不良反应监测体系实施效果评价概念框架
1.1 效果内涵
从监管资源的投入产出角度出发,不良反应监测体系实施效果可以从过程效果、产出效果以及结果效果三方面进行评价。
1.1.1 过程效果
过程效果用于衡量变化过程中的建设进展,是整个体系履行基本职能和实现绩效目标的过程,关注如何投入与开展工作,而并非所产生的结果。[4]如在一个国家建立关于药品安全监测活动的专家咨询委员会、发布药品监管法律法规、组建药品安全监管队伍等。
就药品不良反应监测而言,过程效果可以分为法规制度、组织机构、监测人员、技术装备四部分。其中,法律制度是指药品不良反应监测配套的法律法规、工作文件、工作程序等的颁布实施;组织机构是指各级药品不良反应监测组织机构的建立和完善;监测人员包括数量、知识结构、专业技能等;技术装备是指药品不良反应监测的硬件及软件装备,包括不良反应监测基础设施、信息建设、网络覆盖情况等。
1.1.2 产出效果
产出效果是指用于衡量行动所产生的所有输出和提供的服务。[5]除了行动计划和规划,产出效果也包括改善社会和物质环境以支持采用更安全的行为,如促进提高干预措施的可及性、服务意愿、干预的质量、安全性、效率等。[6]
就药品不良反应监测而言,产出效果可以分为审核评价、信息反馈、风险控制三部分。其中,审核评价主要是指审核报告效率和评价产出;信息反馈是指对报告单位、药监部门及卫生部门的药品不良反应提出警示建议和反馈;控制处置是指采取修改说明书、实施暂停生产销售、召回等风险控制措施以及罚款、赔偿等处置措施。
1.1.3 结果效果
结果效果是指用于衡量行动所产生的最终影响,其可以是短期结果(如增加知识)、中期结果(如改变行为)或长期结果(如降低发病率)。结果效果可表现为干预措施的覆盖率,疾患的风险、行为的控制率,人群健康状况的改善程度等。
就药品不良反应监测而言,结果效果可分为报告数量、报告比率、报告质量、报告集中度四部分。报告数量是指药品不良反应的报告数;报告比率主要指新的、严重的药品不良反应报告比率;报告质量是指药品不良反应报告的真实性、完整性、准确性;报告集中度是指药品不良反应报告主体的类型、地域分布情况等。
1.2 概念框架
结合对药品不良反应监测效果内涵的分析,我国药品不良反应监测体系实施效果评价的概念框架如表1所示。
2 概念框架下我国药品不良反应监测现状及效果评价
2.1 过程效果
2.1.1 法规制度
我国现行的药品不良反应监测制度体系包括了法律、法规、规章三个层次(图1)。[7]
在法律层面,2001年颁布的《药品管理法》中关于药品不良反应报告与监测相关的规定是各项药品不良反应监测工作开展的法律基础。第七十一条规定国家实行药品不良反应报告制度,同时明确药品生产经营企业和医疗机构在不良反应报告中的责任和义务。

表1 我国药品不良反应监测效果评价概念框架

图1 我国药品不良反应监测制度体系
在法规层面,《药品管理法实施条例》(2002年)针对上市药品的监测提出了相应的处理措施。另外,《疫苗流通和预防接种管理条例》(2005年)、《放射性药品管理办法》(2011年)等法规也有对该类特殊药品的不良反应监测进行规定。
在规章层面,2011年颁布的《药品不良反应报告和监测管理办法》是全面实施药品不良反应监测的专门性规章。此外,《药品注册管理办法》(2007年)、《药物临床试验质量管理规范》(2003年)、《药品生产质量管理规范》(2010年)、《药品经营质量管理规范》(2013年)、《医疗机构药事管理规定》(2011年)、《药品召回管理办法》(2007年)等相关制度也涉及到了药品不良反应监测的内容。
2.1.2 组织机构
药品不良反应的组织机构主要包括行政监管机构和技术监督机构[8],两者共同构成了药品不良反应监测的工作平台(图2)。
药品不良反应监测的行政管理工作主要由药品监督管理部门负责,各级卫生行政部门协助参与。药品不良反应的技术监督机构则由国家级、省级及省级以下药品不良反应监测中心构成。截至2011年12月,全国已建立34个省级药品不良反应监测中心(包括31个省、自治区、直辖市监测中心,解放军、新疆生产建设兵团、计划生育药具监测中心各1个)和333个地市级药品不良反应监测中心。[9]在31个省、自治区、直辖市中,25个省级中心设置了市级监测机构,17个省份设置了县级监测机构。[10]
省级药品不良反应监测中心的主要建设模式为独立设置和挂靠其它单位,两种运作模式又可分为多种类型。截至2007年底,北京等22个省级中心为独立法人事业单位,江西等7个省级中心为非独立法人事业单位,上海等2个省级中心挂靠其它单位。[11]随着监测工作的发展,各省、市、县级所采取的机构设置形式也在不断调整中。

图2 我国药品不良反应监测行政管理与技术监督组织体系
2.1.3 监测人员
在人员配备方面,各省级药品不良反应监测中心的人员编制均为事业编制,编制数为3~30人。各省因地区发展情况差异,在机构设置和人员编制方面存在差别。[7]独立设置的市级药品不良反应监测机构的工作人员编制数为5~15人;其他市级监测机构工作人员数为1~15人,各市级监测机构间人员配备情况差别较大,对开展监测工作的广度和深度有一定影响。县级监测机构工作人员一般为1~3人,且多数并非专职设置。
在人员知识水平方面,各省级监测中心人员多来自药学、医学、工程、财务、统计、法学、行政、护理、化学、新闻、计算机等专业,学历普遍较高。市级、县级监测机构人员多来自医学、药学等专业。
2.1.4 技术装备
2001年,国家药品不良反应监测中心同世界卫生组织(World Health Organization,WHO)联网。2002年,国家药物不良反应监测中心完成了信息网络的一期建设,为各省级中心提供初级电子报告手段。2003年,国家药物不良反应信息网络二期试运行,全国药品不良反应病例报告实现在线录入。2011年新的药品不良反应监测信息网络系统试运行,2012年12月顺利验收。2014年,药品不良反应聚集性信号预警系统试运行,信号预警能力得到提升。
自2011年药品不良反应监测系统上线后,总注册单位增加了9.25万家(包括医疗器械不良事件报告单位),较上线前增长84.8%,系统用户数量达到241 205个。[12]截至2011年底,全国药品不良反应监测网络在线基层用户共50 312个,其中医疗机构用户2 903个,企业用户19 610个,监测机构用户2 903个,个人及其它用户633个。2012年监测网络覆盖面进一步扩大,在线报告单位继续增加,药品不良反应监测系统的网络终端机构用户数量达到15万个(图3)。[13]
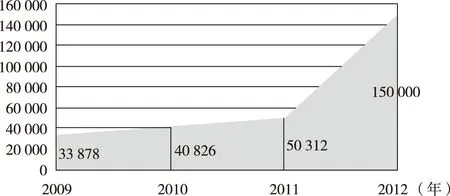
图3 2009—2012年我国药品不良反应监测网络基层用户数量
2.2 产出指标
2.2.1 审核评价
在审核效率方面,2004年颁布的《药品不良反应报告和监测管理办法》规定药品不良反应一般病例和严重病例的报告时限为3个月和15日,2011年版将其修改为30 日和15日,且死亡病例必须立即报告。这与国外不良反应报告时限基本一致。欧盟、美国、日本等地区对于意外且严重的药品不良反应的报告时限均为自发现之日起15日内;澳大利亚则要求报告主体在72小时内报告严重的非预期的药品不良反应。从实践来看,2012年一般病例报告时间距不良反应发生平均时间为23.6天,30日内报告比例达到83.8%;严重病例报告时间距不良反应发生时间平均为20 天,15 日内报告比例达到80.2%。[14]
在评价产出方面,近几年药品不良反应分析评价能力逐步提高。2006年,国家药品不良反应监测中心完成了包括葛根素注射液等在内的100多个品种的技术分析报告。[15]2012年共开展了丁咯地尔等30余个(类)品种的安全性评估。2013年重点加强基本药物、中药注射剂、生物制品等品种的安全评价,对细辛脑注射液等近50个(类)品种进行了评价。
2.2.2 信息反馈
国家药品不良反应监测中心主要通过《国家药品不良反应信息通报》、《药物警戒快讯》以及《药品不良反应监测年度报告》向社会反馈药品信息。
2001年11月国家药品不良反应监测中心发布了第1期《药品不良反应信息通报》,截至2013年12月,共发布了58期。2005 年发布了第1期《药物警戒快讯》,截至2013年12月,共发布128期(表2)。通过采取发布信息通报、药物警戒快讯等方式,有效提示了医药企业、医务工作者及公众注意相关药品存在的安全性问题。
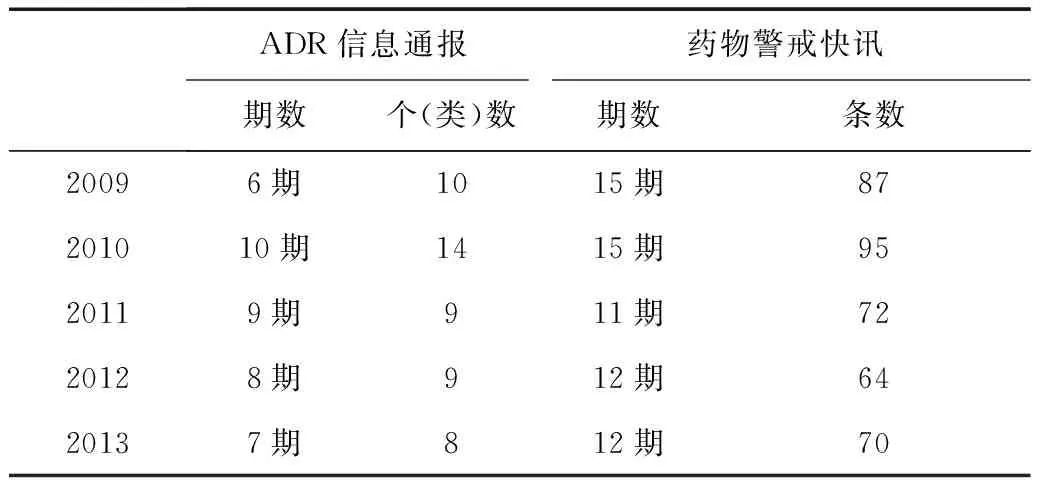
表2 2009—2013年药品不良反应监测信息反馈情况
此外,国家药品不良反应监测中心自2009年起每年发布《药品不良反应监测年度报告》,并定期通过举办全国监测中心主任会、企业沟通交流会等方式促进信息共享,为风险管理计划制定和风险控制决策提供信息服务。[16]
2.2.3 控制处置
关于风险控制,省级药品监督管理部门根据不良反应评价情况可采取暂停生产、销售、使用和召回药品等措施。国家药品监督管理部门在必要时可采取责令修改药品说明书,暂停生产、销售、使用和召回药品,撤销药品批准证明文件等措施。从实践来看,2012年国家食品药品监督管理局共修改了鼻炎宁胶囊(颗粒/冲剂)等15个(类)药品说明书,强化药品风险警示;针对监测中发现的问题及时约谈相关企业,全年共约谈企业11次,召开企业沟通会13次,并要求生产企业采取召回及主动暂停生产销售等控制措施(表3)。[17]
关于处罚处置,药品生产、经营企业或医疗机构若有违反药品不良反应报告与监测制度的情形,可处以警告、责令限期改正以及罚款,罚款额度通常是五千元以上三万元以下。事实上,目前还未有药品报告单位因未按照要求开展药品不良反应报告而受到处罚。

表3 2009—2013年药品不良反应监测风险控制措施情况
2.3 结果指标
2.3.1 报告数量
药品不良反应报告是开展监测工作的基础。近年来,我国的药品不良反应病例报告数量成持续增长趋势。1989—1999年,全国药品不良反应病例报告仅4 000余份[18],2000年则为4 700多份,2001—2006年报告数连续六年实现翻番,2007年达到540 000份,2012年突破1 000 000份,2013年则达到1 317 000份(图4)。
每百万人口平均报告数量是国际上衡量一个国家药品不良反应监测工作水平的重要指标之一。WHO要求,药物不良反应监测体系健全的国家,每年收到的病例报告数不应低于每百万人口300份。我国2004年的每百万人口平均报告数不足60份[19],2007年达到400份,2013年则达到968 份,可见我国药品不良反应监测工作取得了明显进步(图5)。但与发达国家相比仍存差距,如美国2011年每百万人口平均报告数量为1 000余份。[20]
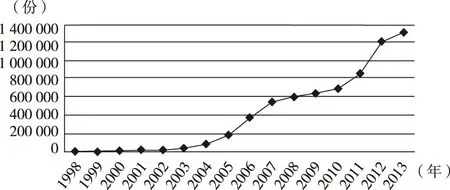
图4 1998—2013年我国药品不良反应报告数
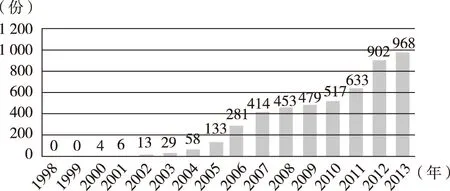
图5 1998—2013年我国每百万人口平均药品不良反应报告数量
我国各地区不良反应监测工作开展不平衡,每百万人口平均报告数地区间差异明显。截至2012年,仍有6个省份未达到每百万人口400份,而一些省份如安徽、山东、山西、上海均达到1 000份。同时,部分欠发达地区药品不良反应监测工作与发达地区的差距正逐步缩小,如内蒙古自治区2011年每百万人口报告数量为8份,2012年为256 份。[12]
2.3.2 报告比率
严重不良反应报告是发现药品安全风险的重要信息。根据WHO的标准,成熟的药品风险评估中心报告的30%不良反应病例应是新的、严重的病例。以英国为例,2011—2012年英国自发报告的严重报告比例达到94%。[21]我国目前收到的报告中,大部分是已知不良反应,新的、严重的报告较少,2004年仅占报告总数的2%~3%[17],2008年增至报告总数的13.3%,2013年达到22.1%,但仍未达到监测体系发现信号并开展风险管理的要求(图6)。
不同地区新的、严重的药品不良反应报告有所差别。如广东省清远市2010年第一季度的比例不到10%,同年江苏省的比例为16.1%,但部分省内城市接近30%。就不同省份进行比较可得,参与在线呈报单位数越多的省份,报告数量越多,新的、严重的报告占比也越高。在同一省份内,新的、严重的报告比例的差异则反映出不同地市的新的、严重的不良反应发生的实际概率和合理用药水平的差异。[22]

图6 2008—2013年新的严重的不良反应报告数量与报告比率
2.3.3 报告质量
2011年在药品不良反应监测新系统上线后,通过系统的标准化录入、数据规整、抽样质量评估等功能,采集数据标准和规范性得到大幅提升,药品不良反应报告有效性提升。系统使用前,商品名称规范化比例为25.3%,生产厂家规范化比例为53.6%,而使用后两者比例分别为72.4%和98.1%。[23]
我国当前药品不良反应报告质量普遍偏低,报告存在许多不足之处,主要表现为:患者基本信息存在一定缺失、专业术语不规范、不良反应名称和过程描述与处理过于简单、不良反应分析不够确切等。[24]与此同时,在全国收集的药品不良反应报告中,有警戒意义的报告数量相对较少。[25]
2.3.4 报告集中度
在发达国家的不良反应报告体系中,药品生产企业的报告占绝大多数,如2011年,加拿大81.8%的报告均来自药品生产企业。[26]在我国,尽管药品生产经营企业较多,但报送的药品不良反应报告数却相对较少。[4]90%以上的药品生产企业对于不良反应主动上报的积极性不高。[27]近几年,企业不良反应报告情况有所改观,2012—2013年企业不良反应报告率维持在20%以上(图7)。单独分析生产企业与经营企业的报告情况发现,生产企业报告率仍偏低,以2013年为例,生产经营企业总占比21%,而其中生产企业仅占1.4%(图8)。
在医疗机构报告单位中,基层医疗机构报告率相对较低。北京市2005年公布的各医疗机构上报的8 275份药物不良反应报告中,60%的报告集中在24家三级医疗机构,有12家三级医疗机构年报告量不足20份,还有两家三级医疗机构、16家二级医疗机构存在零报告现象。[28]
县级报告单位报告数量逐年提升。以2012年为例,全国药品不良反应县级报告比例为90.1%。[12]2013年,基层药品不良反应监测机构建设进一步加快,药品不良反应报告县级覆盖率达到93.8%。
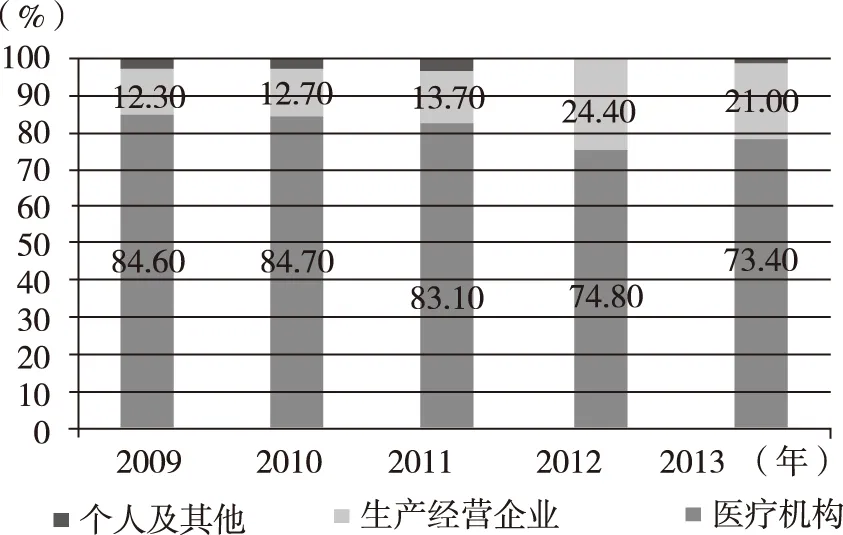
图7 2009—2012年我国药品不良反应报告来源情况
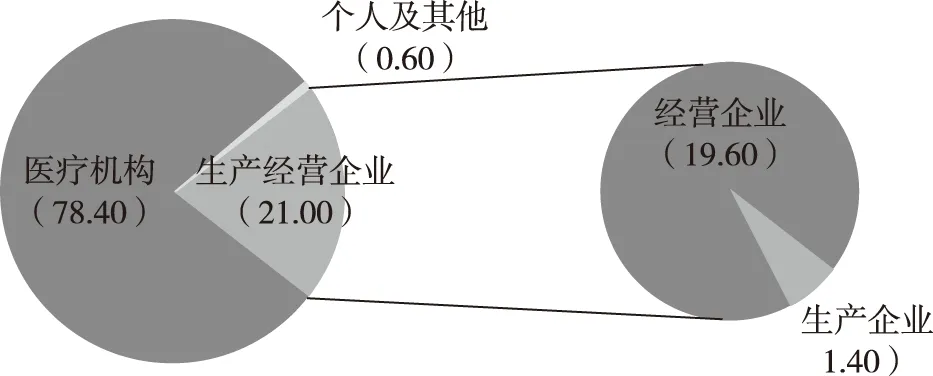
图8 2013年药品不良反应具体报告来源分布(%)
3 讨论
研究从过程效果、产出效果、结果效果三方面系统评价了我国药品不良反应监测的效果现状,从中可看出我国药品不良反应监测工作总体发展速度较快,推进良好,监测网络建设、审核评价效率、每百万人口报告数等方面表现优异,而在风险控制措施、严重不良反应报告比率、不良反应报告质量、生产企业报告比等方面表现不尽如人意,有待进一步提高。
之所以出现上述结果,可以从医疗机构、生产经营企业和监管部门等角度进行分析。医疗机构方面,医务人员对药品不良反应认识存在误区,对监测工作经费支持少,同时临床药师配备不足,专职报告人员少,中小医院报告率较低。生产经营企业方面,企业或人员资质较差,对不良反应认识不清,对上报工作不重视,风险管理意识与举措相对薄弱。监管部门方面,对于漏报、瞒报、虚报药品不良反应的情形惩罚力度较轻,同时对于医疗机构和企业缺乏有效的信息沟通,对于不良反应监测的宣传教育、技术指导工作开展不深入。
发达国家为应对这些问题开展了许多有益的实践。在药品不良反应监测体系上,法国采取“地方系统”模式,设立中央和地方相结合的管理体制,利于加强监测机构与报告单位之间的联系,使监测人员及时掌握第一手信息资料。[29]美国对药物不良反应信息的收集建立奖惩机制,美国法律规定不报告药品不良反应属于犯罪行为,单位和个人都要面临警告、罚金及若干年监禁等处罚,处罚力度之大足以使药品生产、经营企业自觉遵守法律,按要求报告药品不良反应。[30]同时,美国药品不良反应救济制度的建立也打消了报告单位的顾虑,在一定程度上提高了报告单位上报的积极性。
本研究也存有一定的不足之处。一方面,文章未将建立的评价概念框架细化为具体的指标体系,确定权重并赋值。另一方面,对于药品不良反应监测的成本暂未纳入评估,没有开展成本—效果比评价。这些也是本研究下一步工作重点。
4 建议
结合上文研究成果及部分国家应对措施借鉴,应从以下几个方面提升药品不良反应监测实施效果:(1)建立信用奖惩机制,促进药品安全信息的收集报告;(2) 加大财政投入,为上市后药品安全性评价提供资金保障;(3) 拓展沟通交流渠道,促进监测信息的反馈与公开;(4)强化企业责任意识,提升药品不良反应上报数量与质量;(5)建立和完善药品不良反应损害救济制度。
另外,新一轮《药品管理法》的修订工作已逐步展开,修订过程将围绕科学监管、市场机制、社会共治、药品创新等核心要素进行探讨。对于药品不良反应监测工作而言,修订的要点应包括:(1)转型监管理念,在制度体系引入关于 “风险管理”的概念、内容和模式;(2) 明确药品技术监管组织机构的职责和地位,加强科学监管和有效监管;(3) 强化企业责任,落实药品生产企业上市后安全性监测和主动研究的责任和义务。这其中,“风险管理”尤为值得关注,而这也关系到了未来药品不良反应监测工作的权责变化与重心转移。药品不良反应监测将逐步向药物警戒的理念推进,监测工作的效果评价也需要重点考量安全性监测方法与风险管理措施。
[1]汤林海.药品不良反应监测之政府监管研究[D].重庆: 西南政法大学, 2011.
[2]王珍, 袁梅.地方政府食品安全监管绩效指标体系的重要性分析[J].粮食科技与经济, 2010, 35(5): 9-10, 25.
[3]王晓燕, 徐燕, 林宇, 等.基层医疗机构主动监测评价指标体系研究[J].中国药物警戒,2014, 11(2): 81-87.
[4]World Health Organization.Framework to monitor and evaluate implementation of the Global Strategy on Diet, Physical Activity and Health[R].2009.
[5]熊占路.农村公共卫生体系绩效概念模型研究[D].华中科技大学, 2008.
[6]胡善联.国际组织对我国医药卫生体制改革监测与评价框架的建议[J].中国卫生政策研究, 2010, 3(3): 4-6.
[7]邹萍.我国药品不良反应监测体系的研究[D].哈尔滨: 黑龙江中医药大学, 2010.
[8]曹立亚, 陈易新, 沈璐.关于我国药品不良反应监测技术工作发展方向的思考[J].中国药物警戒, 2004, 1(2): 3-13.
[9]国家食品药品监督管理局.2011年国家药品不良反应监测年度报告[EB/OL].(2012-05-31)[2014-05-11].http://www.sda.gov.cn/WS01/CL0078/72193.html
[10]金丹, 魏晶, 杨华,等.我国药品不良反应监测组织体系建设现状及探讨[J].中国药物警戒, 2008, 5(2): 86-88, 92.
[11]公培献, 孔庆衍, 周勇, 等.我国药品不良反应监测体系建设有关制度研究[J].中国药物警戒, 2009, 6(2): 74-78.
[12]国家食品药品监督管理局.国家ADR监测体系建设项目通过总体验收[EB/OL].(2012-12-13) [2014-05-11].http://www.sda.gov.cn/WS01/CL0050/76918.html
[13]王丹, 程刚.药品不良反应监测数据年度趋势分析[J].药物流行病学杂志, 2013, 22(5): 238-241.
[14]王春梅.从数据看监测能力[N].中国医药报,2013-03-20.
[15]武志昂.全国药品不良反应监测中心主任工作会议工作报告[J].中国药物警戒,2007, 4(4): 194-199.
[16]李文武.辩证分析我国药品不良反应监测与评价工作现状[J].中国药物警戒, 2013, 10(6): 337-340, 343.
[17]国家食品药品监督管理局.2012年国家药品不良反应监测年度报告[EB/OL].(2013-03-14)[2014-05-11].http://www.sda.gov.cn/WS01/CL0051/79058.html
[18]金丹.省级以下药品不良反应监测组织体系构建模式的研究[D].沈阳: 沈阳药科大学, 2008.
[19]陈锋, 杨世民.我国药物不良反应监测体系建设现状与存在的问题[J].医药导报, 2006, 25(5): 486-488.
[20]USFDA.FDA Adverse Event Reporting System (FAERS) statistics [EB/OL].(2011-07-15)[2014-05-11].http://www.fda.gov/Drugs/Guidance Compliance Regulatory Information/Surveillance/Adverse Drug Effects/ ucm070093.htm
[21]UK MHRA.MHRA annual statistics 2010/11 [EB/OL].(2011-07-15)[2014-05-11].http://www.mhra.gov.uk/ home/ groups/ comms-ic/ documents/ website resources/ con224445.pdf
[22]王文沛, 邵蓉.我国新的和严重的药品不良反应报告现状及障碍分析[J].中国药事, 2011, 25(3): 227-230.
[23]国家药品不良反应监测体系建成[J].中国全科医学,2013(3): 331.
[24]郭辉, 丁卫东, 刘卫, 等.提高药品不良反应报告表质量的若干问题探讨[J].中国药物警戒, 2007, 4(4): 230-231.
[25]王晓瑜, 杜文民, 王宏敏, 等.药品不良反应报告中存在的问题及改进建议[J].上海医药, 2006, 27(5): 215-216.
[26]Health Canada.Adverse reaction and incident reporting 2011[J].Canadian Adverse Reaction Newsletter, 2012, 22(3): 3-6.
[27]于星.解析制药企业药品不良反应监测意识缺失[J].中国药物警戒, 2009, 6(4): 211-215.
[28]田春华, 曹亚丽, 陈易新.我国药物不良反应监测的发展现状及尚需解决的问题[J].中国药房, 2004, 15(3): 132.
[29]宋莉, 张宝库.美、法两国药物警戒体系简介及对我国的启示[J].中国药房, 2009,20(14): 1043-1045.
[30]祝眉娜.我国药物警戒体系建设的研究[D].沈阳: 沈阳药科大学, 2008.
(编辑 赵晓娟)
TheeffectevaluationofadversedrugreactionmonitoringsysteminChina
SHAORong1,2,TANGJi-feng1
1.SchoolofInternationalPharmaceuticalBusiness,ChinaPharmaceuticalUniversity,NanjingJiangsu211198,China
2.TheResearchCenterofNationalDrugPolicy&Ecosystem,NanjingJiangsu211198,China
The Literature analysis method was adopted to evaluate the adverse drug reaction(ADR) monitoring system in China.The conceptual framework was built including process, output and outcome.ADR data from 1998 to 2013 were collected from the National ADR Information Bulletin and Annual Report of National ADR Monitoring.China's ADR monitoring system had achieved rapid progress in recent years and functioned well to some extent.Some parameters such as monitoring network construction, efficiency of evaluation and ADR reports per million populations showed outstanding performance.Others such as risk control measures, the ratio of serious ADR reports, and quality of ADR reports showed poor effects, which needed further improvements.
Adverse drug reactions; Drug safety monitoring; Effect evaluation
邵蓉,女(1962年—),教授,博士生导师,主要研究方向为医药政策与法规。E-mail:shaorong118@163.com
R197
A
10.3969/j.issn.1674-2982.2014.08.007
2014-07-21
2014-08-10

