三种PCR方法检测柑橘黄龙病菌的效果比较
程保平, 彭埃天, 宋晓兵, 凌金锋, 陈 霞
(广东省农业科学院植物保护研究所;广东省植物保护新技术重点实验室, 广州 510640)
实验方法与技术
三种PCR方法检测柑橘黄龙病菌的效果比较
程保平, 彭埃天*, 宋晓兵, 凌金锋, 陈 霞
(广东省农业科学院植物保护研究所;广东省植物保护新技术重点实验室, 广州 510640)
为了比较常规PCR、巢式PCR和实时荧光定量PCR方法在大田检测中对柑橘黄龙病(Huanglongbing, HLB)的检测效果,首先比较了3种检测方法对柑橘黄龙病菌检测的灵敏度,结果发现:3种检测方法的灵敏度依次为常规PCR<巢式PCR<实时荧光定量PCR。运用3种检测方法对广东5个柑橘品种上的189个黄龙病疑似病样进行检测,结果发现:黄龙病检出率依次为常规PCR<巢式PCR<实时荧光定量PCR。研究表明:常规PCR适合以较低成本大规模检测黄龙病;实时荧光定量PCR具有最大的检测灵敏度;巢式PCR检测技术同时具有前两者的一些优点,但操作较复杂,适合技术熟练的研究者使用。
柑橘黄龙病; 常规PCR; 巢式PCR; 实时荧光定量PCR; 比较研究
柑橘黄龙病是世界柑橘生产上最为严重的病害,在我国及东南亚、非洲、阿拉伯半岛、印度、巴西和美国佛罗里达和加利福尼亚等国家和地区均有发生,严重制约着世界柑橘产业的发展[1]。
柑橘黄龙病的病原被认为是韧皮部杆菌属,有亚洲种、非洲种和美洲种3个种[2-3]。目前在我国传播的是亚洲种[4]。该病菌主要由接穗、苗木和木虱传播,还可通过菟丝子在柑橘间传播。植株感病后,传病速度快,目前尚无有效药剂和抗病品种,因此及时准确地诊断有助于及早清除传染源,对于防止病害的快速传播具有重要意义[5]。
柑橘黄龙病有一些典型的症状。初期症状:叶脉肿突,枝梢变黄,中质硬化、无光泽。中后期症状:病叶陆续脱落,病梢萌发早、短而纤弱,病叶细狭长、硬化、出现均匀黄化或斑驳症状,果实出现“红鼻子果”症状。最后植株根部腐烂,生长逐渐衰弱,以致整株死亡[6-7]。但该病的症状与缺素、病毒病等有相似的症状,而且症状诊断带有很多主观因素,因此诊断准确率不高[8]。
20 世纪90 年代后,随着分子生物学方法的发展,大量准确灵敏的分子检测方法已用于该病的检测[9]。目前最广泛用于黄龙病菌检测的是PCR方法[10]。1996年Jagoueix等依据黄龙病菌核糖体蛋白基因设计了特异引物,应用常规PCR 检测柑橘黄龙病菌[11]。2007 年Zhou 等为提高检测灵敏度,运用巢式PCR检测黄龙病菌[12]。同样基于该菌的核糖体蛋白基因,2006 年Wang 等建立实时荧光定量PCR方法来检测黄龙病菌[13]。本研究综合比较了这3种检测方法对广东柑橘黄龙病菌的检测灵敏度与田间检测率。
1 材料与方法
1.1 样品与材料
3种PCR检测所用的黄龙病疑似样品分别采自广东省的龙门、肇庆、云浮等地的柑橘基地,共189个样品。阴性对照样品为本研究室种植于防虫网内的健康柑橘叶片,阳性对照为种植于防虫网内的感染黄龙病柑橘植株的叶片。用于特异性检测的病原菌为本研究室保存于PDF培养基上的柑橘溃疡病菌、柑橘炭疽病菌、辣椒疫霉菌(可危害柑橘)、保存于防虫网室内柑橘上的柑橘衰退病病毒和柑橘碎叶病病毒。用于灵敏度测试的重组质粒为插入柑橘黄龙病菌16S rDNA的pMD19重组质粒,由本研究室构建。
1.2 检测叶片样品处理
田间采集叶片置于塑封袋,再保存于冰盒内。制样时清洗并晾干柑橘叶片,然后剪取叶片中脉放入灭菌研钵,加入液氮研磨成粉状,最后按爱思进公司试剂盒说明书提取样品总基因组。质粒提取方法同样参照爱思进公司的试剂盒说明书。在3种检测方法的灵敏度试验中,将重组质粒DNA原液10倍梯度稀释为10-10、10-9、10-8、10-7、10-6、10-5等系列稀释液,然后作为PCR的模板。以本研究室保存于防虫网室内的健株柑橘叶脉DNA为阴性对照,以保存于防虫网内的感染黄龙病的柑橘叶片为阳性对照。
1.3 PCR 引物
常规PCR:上游引物OI1:5′-GCGCGTATGC-AATACGAGCGGCA-3′,下游引物OI2c:5′-GCCTCGCGACTTCGCAACCCAT-3′[11]。巢式PCR 引物对:外侧引物为OI1/OI2c; 内侧引物的上游引物CGO3F:5′-RGGGAAAGATTTTATTGGAG-3′,下游引物对CGO5R: 5′-GAAAATAYCATCT-CTGATATCGT-3′[12]。SYBR GreenⅠ实时荧光定量PCR引物对上游引物CQULA04F: 5′-TGGAGGTGTAAAAGTTGCCAAA-3′,下游引物CQULA04R:5′-CCAACGAAAAGATCAGATATTCCTCTA-3′[13],引物对均由广州英骏公司合成。PCR 缓冲液、Taq酶、SYBR Premix ExTaq等购自大连宝生物公司。质粒DNA提取试剂盒和基因组DNA提取试剂盒等购自爱思进公司。使用仪器为:iCyclerTMABI 7500型实时荧光定量PCR,Molecular Imager Gel Doc XR+型凝胶成像系统。
1.4 PCR检测体系及扩增程序
50 μL 反应体系,包括 PremixTaq25 μL、10 μmol/L 的引物各2 μL,DNA 模板1 μL,补水至50 μL。扩增反应程序:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共35 个循环;72 ℃延伸10 min[11]。
1.5 巢式PCR 检测
采用常规PCR中的OI1/OI2c为巢式PCR外侧引物进行第1轮的PCR扩增,反应体系以及反应程序参照常规PCR反应。取1 μL第1轮PCR反应产物为模板,以CGO3F/CGO5R为内侧引物进行第2轮PCR扩增,反应体系与常规PCR相同。反应程序:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45s,共35个循环;72 ℃延伸10 min。扩增完成后将PCR产物进行琼脂糖凝胶电泳[12]。
1.6 SYBR GreenⅠ实时荧光定量PCR检测
20 μL 的反应体系,包括SYBR Premix ExTaq缓冲液10 μL、10 μmol /L 引物对各0.8 μL、模板1 μL、ROX-Dye2 0.4 μL、补水至20 μL。PCR反应程序:95 ℃预变性30 s;95 ℃ 5 s,59 ℃ 30 s,72 ℃ 45 s,45个循环;72 ℃延伸5 min[13]。PCR 扩增结束后进行熔解曲线分析,用于验证扩增的特异性。
2 结果与分析
2.1 常规PCR、巢式PCR 的检测灵敏度
通过对浓度稀释梯度为10-1~10-9的重组质粒DNA样品的检测发现:常规PCR和巢式PCR检测方法均可快速、特异、灵敏地检测出黄龙病菌的16S rDNA片段,常规PCR可在浓度梯度为10-1~10-5的5个重组质粒DNA稀释样品中检测出清晰的目标条带,其中对10-5稀释的样品检测中发现:凝胶电泳条带非常微弱(图1)。而巢式PCR检测结果显示:10-5稀释的样品中仍可检测到清晰的目标条带,10-6~10-8稀释的DNA中亦能检测到条带。10-9稀释模板后进行检测,无清晰的扩增条带出现。表明巢式PCR方法的检测灵敏度是普通PCR检测方法的1 000倍(图2)。

图1 常规PCR在柑橘黄龙病菌检测中的灵敏度测试
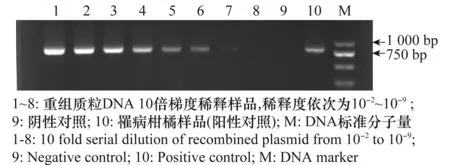
图2 巢式PCR在柑橘黄龙病菌检测中的灵敏度测试
2.2 SYBR GreenⅠ实时荧光定量PCR检测灵敏度
通过对浓度稀释梯度为10-2~10-9的重组质粒DNA样品的检测发现:实时荧光定量PCR可在浓度梯度10-2~10-9的重组质粒DNA模板中采集到阳性信号(图3)。反应呈现良好的线性关系。

图3 实时荧光定量PCR在柑橘黄龙病菌检测中的灵敏度测试
2.3 三种方法的检测特异性验证
为验证本文常规PCR、巢式PCR和实时荧光定量PCR(q-PCR)方法对柑橘黄龙病检测的特异性,运用3种检测方法对本研究室保存的柑橘溃疡病菌、柑橘炭疽病菌、辣椒疫霉菌(可危害柑橘)、柑橘衰退病病毒、柑橘碎叶病病毒及健康柑橘对照样品进行检测,结果均无阳性反应;而3种检测方法对感染黄龙病的柑橘样品均可检出阳性反应(表1)。
表1三种PCR检测技术对柑橘黄龙病菌的检测特异性验证
Table1SpecificitytestofthethreemoleculardetectionmethodsforHLB
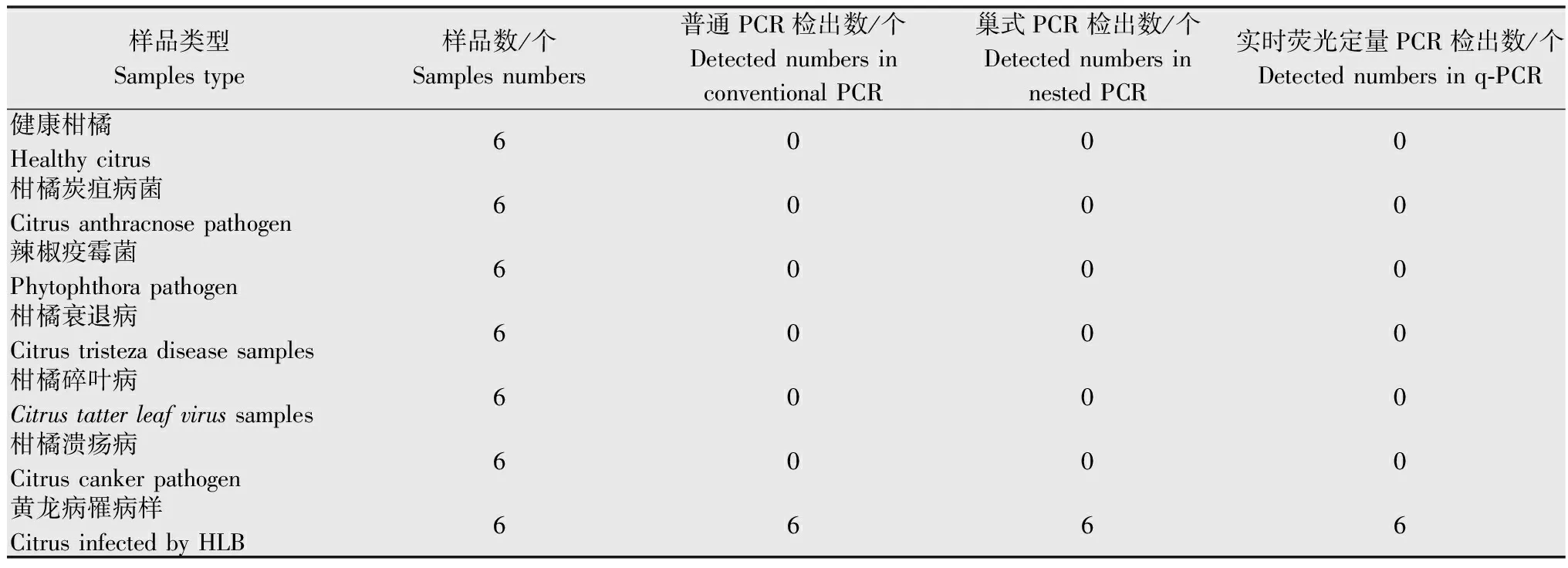
样品类型Samplestype样品数/个Samplesnumbers普通PCR检出数/个DetectednumbersinconventionalPCR巢式PCR检出数/个DetectednumbersinnestedPCR实时荧光定量PCR检出数/个Detectednumbersinq⁃PCR健康柑橘Healthycitrus6000柑橘炭疽病菌Citrusanthracnosepathogen6000辣椒疫霉菌Phytophthorapathogen6000柑橘衰退病Citrustristezadiseasesamples6000柑橘碎叶病Citrustatterleafvirussamples6000柑橘溃疡病Citruscankerpathogen6000黄龙病罹病样CitrusinfectedbyHLB6666
2.4 疑似黄龙病柑橘样品的实际检测
在广东龙门、肇庆、云浮等地多个柑橘品种上采集疑似黄龙病的斑驳黄化叶片,取叶脉提取DNA,使用常规PCR、巢式PCR、实时荧光定量PCR 3种检测方法进行检测。结果发现:3种检测方法对田间的189个样品的检测结果不同,阳性样品检出数分别为:111、141、152,检出率分别为58.7%、74.6%、80.4%。其检测效果为:常规PCR<巢式PCR<实时荧光定量PCR(表2)。
表23种PCR检测技术对广东柑橘黄龙病疑似样品与多种柑橘病原菌的实际检测结果
Table2DetectionofHLB-infectedsamplescollectedfromGuangdongbythethreemoleculardetectionmethods
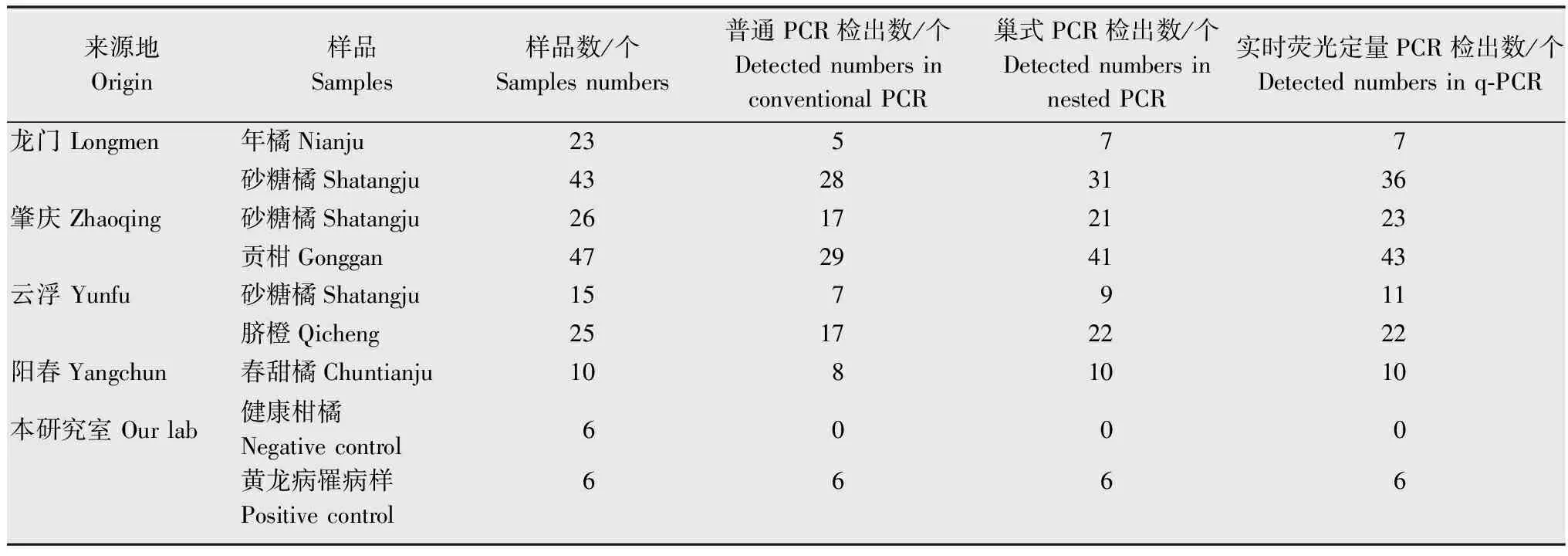
来源地Origin样品Samples样品数/个Samplesnumbers普通PCR检出数/个DetectednumbersinconventionalPCR巢式PCR检出数/个DetectednumbersinnestedPCR实时荧光定量PCR检出数/个Detectednumbersinq⁃PCR龙门Longmen年橘Nianju23577砂糖橘Shatangju43283136肇庆Zhaoqing砂糖橘Shatangju26172123贡柑Gonggan47294143云浮Yunfu砂糖橘Shatangju157911脐橙Qicheng25172222阳春Yangchun春甜橘Chuntianju1081010本研究室Ourlab健康柑橘Negativecontrol6000黄龙病罹病样Positivecontrol6666
3 结论与讨论
柑橘黄龙病树有一些典型的症状,人们常以此来判断黄龙病的发生。但症状诊断带有很多主观因素,且该病的症状与柑橘缺素症、柑橘病毒病等有很多相似之处,因此诊断准确率不高[6]。人们还开发出了一些其他诊断方法,如:指示植物鉴定法、组织染色观察法、电镜切片观察法、核酸杂交检测法等,但这些方法或者检测时间长、操作复杂,或者检测灵敏度不够,难以直接应用于黄龙病的田间实际检测[8]。
PCR 技术具有快速、灵敏、准确等优点, 已成为当前柑橘黄龙病检测的主要手段。PCR技术主要有:普通PCR、巢式PCR与实时荧光定量PCR[5]。这3种检测方法对广东省各种柑橘品种的田间检测效果还缺少评价和报道。
本研究首先对比了3种PCR方法对柑橘黄龙病菌的检测灵敏度。试验表明:普通PCR、巢式PCR、实时定量荧光PCR方法均可对黄龙病菌16S rDNA进行有效检测,但其检测灵敏度有所不同,依次为:常规PCR<巢式PCR <实时荧光定量PCR。在模板定量研究中发现:实时荧光定量PCR的灵敏度是巢式PCR的10倍,而巢式PCR的灵敏度是普通PCR的1 000倍。
与实验室的理想条件不同,田间检测样品中混杂了很多柑橘基因组和一些可能干扰PCR反应的抑制物[14]。对采自田间不同柑橘品种的样品进行检测后发现:3种检测方法可有效抵御抑制物对PCR反应的影响,均可顺利地在田间样品中检测出黄龙病菌。3 种PCR检测技术对本研究室保存的柑橘溃疡病菌、柑橘炭疽病菌、辣椒疫霉菌、柑橘衰退病病毒、柑橘碎叶病病毒及健康柑橘对照样品均无阳性反应,说明这3种检测方法的特异性较好。研究还发现:这3种检测方法的田间检测效果是:常规PCR<巢式PCR <实时荧光定量PCR。再次表明:田间条件下,实时荧光定量PCR对黄龙病菌仍有最高的检测灵敏度,而普通PCR由于其灵敏度的限制,可能会在大规模检测中出现一些漏检,但其检测成本远低于实时荧光定量PCR,适合田间大规模检测应用。巢式PCR同时具有前两者的一些优点,而其检测成本和田间检测效果介于普通PCR和实时荧光定量PCR之间,但考虑到其实验操作较为繁琐,且容易因开管操作形成溅射气溶胶而造成样品污染,因此认为该方法更适合技术熟练者使用[15]。
综上,普通PCR得益于其较低的成本,适合用于大规模的田间初次普查检测;实时荧光定量PCR非常适合对普通PCR没有检出的疑似样品进行进一步的确认,或可对黄龙病菌侵染早期,含菌量较低的样本,如种苗、接穗进行定量检测;巢式PCR同时具有前两者的一些优点,但由于对操作的要求较高,适合经验较为丰富的研究人员开展试验,且在试验中需严格遵守试验程序,确保试验用品的消毒,并严格控制样品污染,从而避免假阳性。
[1]Gottwald T. Current epidemiological understanding of citrus.[J]. Annual Review of Phytopathology, 2010, 48: 119-139.
[2]胡文召,周常勇.柑橘黄龙病病原研究进展[J].植物保护, 2010,36(3):30-33.
[3]Bové J. Huanglongbing: A destructive newly-emerging century-old disease of citrus[J]. Plant Pathology, 2006, 88(1): 7-37.
[4]Teixeira D, Danet J. Citrus huanglongbing in São Paulo State, Brazil: PCR detection of the ‘Candidatus’ Liberobicter species associated with the disease[J]. Molecular and Cellular Probes, 2005, 19(3):173-179.
[5]林亚玉,殷幼平,陈世钦,等.三种分子检测体系的比较及柑橘果园黄龙病监测[J]. 植物保护学报, 2012,39(6):503-507.
[6]Seph J, Bove M,付惠敏,等.有百年历史的日益严重的毁灭性柑桔病害——黄龙病[J]. 广西农学报,2011, 26(4):70-76.
[7]柏自琴,周常勇.柑橘黄龙病病原分化及发生规律研究进展[J].中国农学通报, 2012, 28(1):133-137.
[8]王爱民,邓晓玲. 柑桔黄龙病诊断技术研究进展[J]. 广东农业科学, 2008(6):101-103.
[9]张培,关磊,刘蕤, 等.砂糖橘红鼻子果与韧皮部杆菌侵染相关性研究[J]. 热带作物学报, 2011,32(4):738-742.
[10]丁芳,王国平,易干军,等.不同引物对检测柑桔黄龙病菌灵敏度比较[J]. 植物保护学报, 2007, 34(4):364-368.
[11]Jagoueix S, Bové J, Garnier M. PCR detection of the two ‘CandidatusLiberobacter’ species associated with greening disease of citrus[J]. Molecular and Cellular Probes, 1996,10(1):43-50.
[12]Zhou L, Gabriel D, Duan Y, et al. First report of dodder transmission of huanglongbing from naturally infectedMurrayapaniculatato citrus[J]. Plant Disease, 2007, 91:227-227.
[13]Wang Z, Yin Y, Hu H, et al. Development and application of molecular-based diagnosis for ‘CandidatusLiberibacter asiaticus’,the causal pathogen of citrus huanglongbing [J]. Plant Pathology, 2006, 55: 630-638.
[14]赵阳国,高崇洋,王继华,等.如何解除PCR反应中的抑制现象[J]. 哈尔滨师范大学自然科学学报, 2003,19(3):81-84.
[15]李振勇,刘明霞. 尿嘧啶DNA糖基化酶在PCR防污染中的应用[J]. 中国医药导刊, 2001,3(4):305-306.
Comparisonofcitrushuanglongbingmoleculardetectionmethods
Cheng Baoping, Peng Aitian, Song Xiaobing, Ling Jinfeng, Chen Xia
(PlantProtectionResearchInstitute,GuangdongAcademyofAgriculturalSciences;GuangdongProvincialKeyLaboratoryofHighTechnologyforPlantProtection,Guangzhou510640,China)
Detection sensitivity and detection rate of conventional PCR, nested PCR and real-time quantitative PCR were compared for detection of citrus huanglongbing. The results showed that the detection sensitivity was ranked from high to low as real-time quantitative PCR>nested PCR>conventional PCR. Then total 189 suspected citrus samples from five different cultivars with symptom of HLB in orchard of Guangdong were amplified and confirmed by the three methods. The results indicated that the detection rate was ranked from high to low as real-time quantitative PCR>nested PCR>conventional PCR. This research indicated that conventional PCR, du to its low cost, could be used in large scale diagnosis of HLB disease, real-time quantitative PCR had the highest detection sensitivity, and nested-PCR had the advantages of the other two, but its experimental operation was more complex.
CandidatusLiberibacter asiaticus; conventional PCR; nested-PCR; real time quantitative PCR; comparative research
2013-11-18
:2014-02-09
广东省农业科技推广专项资金重大技术研究项目(201201127);广东省现代农业产业技术体系建设专项(粤农[2009]380号);广东省农业科学院院长基金项目(201305);科技创新人才出国培养计划(粤农科[2013]74号)
S 412
:ADOI:10.3969/j.issn.0529-1542.2014.05.019
* 通信作者 E-mail:pengait@163.com

