复方苦参注射液对rBMSCs细胞增殖和迁移能力的影响
罗利琼,胡 林,冯 刚
(1.武汉科技大学附属天佑医院 肿瘤科,武汉 430064;2.武汉市普爱医院 肿瘤科,武汉 430033)
目前,越来越多研究示低氧环境培养能提高骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的增殖能力和迁移能力[1-3]。复方苦参注射液广泛用于多种晚期肿瘤的治疗和恶性胸腔积液治疗等方面。在一定浓度药物和不同氧浓度条件的作用下,BMSCs是否能继续存活进而发挥抗肿瘤的作用显得很重要。为此,在前期试验的基础上,本研究进一步观察携带目的基因的BMSCs在复方苦参注射液作用下和在常氧或缺氧条件下细胞增殖和迁移能力变化情况。
1 实验材料与方法
1.1 材料 大鼠肝癌细胞株Walker-256细胞购自武汉大学中国典型培养物保藏中心;rBMSCs为普爱医院实验室构建和保存;复方苦参注射液购自购自山西振东制药股份有限公司。
1.2 方法
1.2.1 MTT法 取对数生长期的rBMSCs种于96孔培养板,每组设12个复孔。置37 ℃常氧或低氧(5%)条件下,分别加入复方苦参注射液(浓度分别为300、200、100、50、25 μL/mL),培养6、12、24、48、72 h后,每孔加入20 μL MTT液,37 ℃孵育4 h后吸弃培养液,用酶标仪于570 nm波长下测量OD值。以不含复方苦参注射液组为阴性对照,以空白孔进行调零。细胞存活率=(加药组-空白组)/(对照组-空白组)×100%。
1.2.2 ELISA法 取对数生长期的Walker-256细胞种于24孔培养板,每组设6个复孔,待细胞贴壁完全后将Transwell小室放入24孔,在上室内加入不含血清的rBMSCs。置37 ℃常氧或低氧(5%)条件下,分别在复方苦参注射液(浓度分别为300、200、100 μL/mL)培养12、24、48 h后,吸取Transwell小室中的培养液。用ELISA法对上清液中SDF-1进行检测。室温显色后用酶标仪于450 nm处测吸光度值并制成标准曲线,测定各样本中含量。
1.2.3 Transwell法 取对数生长期的Walker-256细胞种于24孔培养板,每组设6个复孔,待细胞贴壁完全后将Transwell小室放入24孔,在上室内加入不含血清的rBMSCs。置37 ℃常氧或低氧(5%)条件下,分别在复方苦参注射液(浓度分别为300、200、100 μL/mL)培养12、24、48 h后,取出Transwell小室。棉棒轻轻擦去滤膜顶层的细胞。各选择5个无重叠区,于高倍镜(×200)下计数穿过基质膜滤膜底面的细胞数。
2 实验结果
2.1 细胞存活情况 随复方苦参注射液浓度增加和处理时间延长,细胞存活率呈逐渐下降趋势。25 μL/mL和50 μL/mL组在各处理时间段的细胞存活率与对照组比较,差异无统计学意义(P>0.05)。100 μL/mL、200 μL/mL和300 μL/mL组在处理24、48、72 h后细胞存活率与其他组比较,差异有统计学意义(P<0.05);但三者在处理后72 h的细胞存活率,与48 h组比较,差异无统计学意义(P>0.05)。100 μL/mL和200 μL/mL组能提高在低氧条件下的细胞存活率,见图1。
2.2 SDF-1变化情况 在200 μL/mL处理24 h组,上清液中SDF-1含量上升,差异有统计学意义(P<0.05);在100 μL/mL和300 μL/mL组,处理12、24、48 h上清液中SDF-1,其差异无统计学意义(P>0.05)。200 μL/mL组在低氧条件下其SDF-1含量较常氧条件下明显减少(P<0.05),见图2。
2.3 细胞迁移情况 200 μL/mL组细胞迁移率与其他组比较,差异有统计学意义(P<0.05);其余各组间比较无差异(P>0.05)。200 μL/mL处理24 h组,与处理12 h和48 h组比较,差异有统计学意义(P<0.05)。200 μL/mL组在低氧条件下处理12 h和48 h间比较有差异(P<0.05);在常氧条件下2组间比较无差异(P>0.05)。见图3。
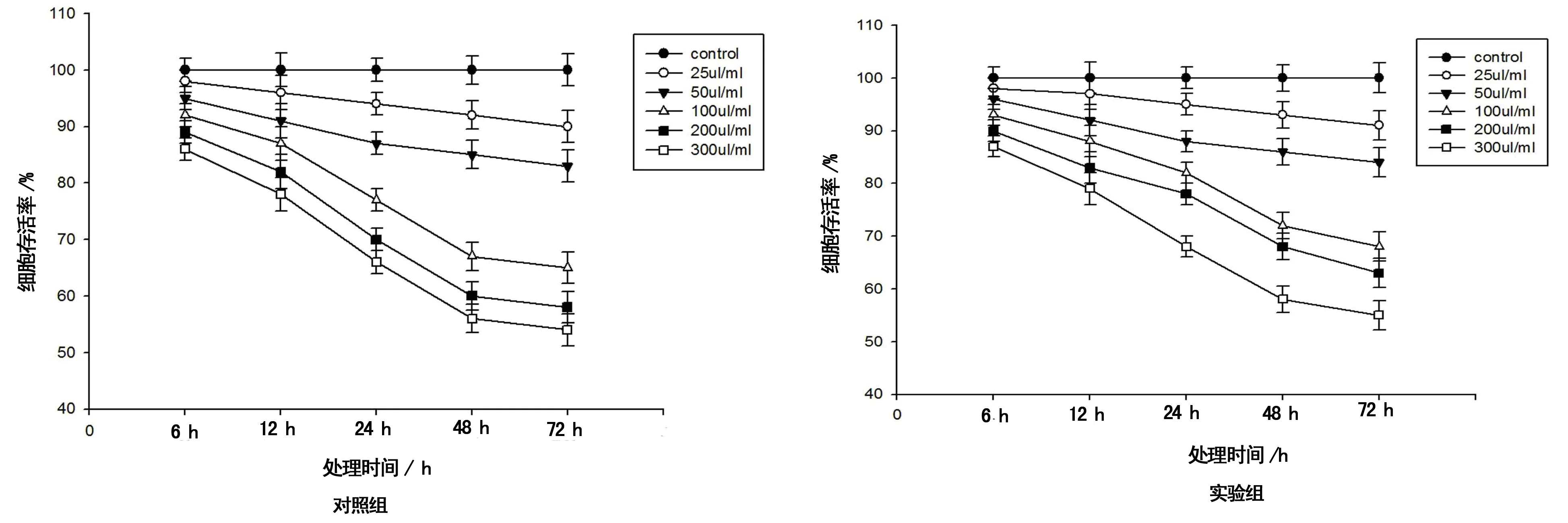
图1 对照组和实验组细胞的存活率比较(n=12)
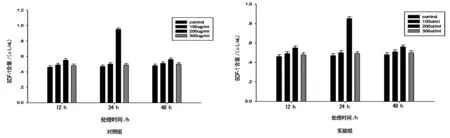
图2 细胞上清液中SDF-1含量(n=6)

图3 对照组和实验组细胞的跨膜迁移率比较(n=6)
3 讨论
BMSCs的移植可以用于治疗多种肝脏疾病[4-6],融合目的基因的BMSCs细胞移植疗法可能为恶性肿瘤的治疗提供一种新的治疗手段[7-9]。本实验室构建了表达纤维连接蛋白(fibronectin,Fn)重要结构域的真核表达载体pCE-GFP质粒,并在BMSCs中获得高效稳定表达,其在体外实验中影响癌细胞的增殖等[10]。复方苦参注射液是以苦参和土茯苓等为原料经科学提炼而制成的注射剂,其主要有效成分为苦参碱和氧化苦参碱等。研究证明,复方苦参注射液对多种肿瘤细胞有直接的杀伤作用;减弱多种肿瘤细胞黏附、侵袭和运动能力,抑制肿瘤细胞侵袭和转移等方面的作用[1-3,11-14]。BMSCs在体内体外复杂条件下细胞生物学行为的变化情况目前是不清楚的。为此,在前期试验的基础上,进一步研究BMSCs在复方苦参注射液作用下的细胞增殖和迁移能力的变化情况。
本研究发现,随复方苦参注射液浓度增加和处理时间延长,rBMSCs细胞存活率呈逐渐下降趋势。但在100 μL/mL、200 μL/mL和300 μL/mL组处理24 h和48 h后细胞存活率,组间差异有统计学意义(P<0.05);处理72 h和48 h后3组细胞的存活率无明显差异。进而得出,在低氧条件下,在100 μL/mL和200 μL/mL复方苦参注射液作用下,能提高rBMSCs在较复杂条件下的细胞存活率。在200 μL/mL处理24 h组,SDF-1含量上升,差异有统计学意义(P<0.05);200 μL/mL组在低氧条件下其SDF-1含量较常氧条件下明显减少(P<0.05)。rBMSCs分泌的SDF-1浓度,在复方苦参注射液作用下和在常氧或缺氧条件下,并未呈现一定的量效关系和时效关系。只有在适当浓度复方苦参注射液作用下,rBMSCs才可能分泌SDF-1。200 μL/mL组细胞迁移率与其他剂量组比较,差异有统计学意义;200 μL/mL处理24 h组,与12 h和48 h组比较,差异有统计学意义(P<0.05)。200 μL/mL组在低氧条件下12 h组与48 h组能增强细胞的迁移能力。分析可能原因,SDF-1含量在增强rBMSCs细胞向肿瘤细胞迁移能力方面发挥一定的作用,但不是唯一的因素。短时间的缺氧条件利于rBMSCs发生迁移,长时间的缺氧条件则不利于rBMSCs发生迁移。
综上所述,在适当浓度复方苦参注射液作用下,在低氧条件下能提高rBMSCs在复杂条件下的细胞存活率;能促进rBMSCs分泌SDF-1;短时间的缺氧条件利于rBMSCs发生迁移。rBMSCs在体内体外环境中各种化疗药物作用下,其细胞增殖和迁移能力等生物特性的变化值得进一步研究。
[1]蒋红艳,王贵学,唐舒棠.苦参总碱对血管内皮细胞增殖和迁移的抑制作用[J].中国药学杂志,2009,44(13):982-985.
[2]李晓红,张铁民.氧化苦参碱抑制MKN-45细胞迁移及其机制的研究[J].实用医学杂志,2013,29(1):28-30.
[3]冀润利,邸瑶,夏时海,等.氧化苦参碱对SW1990细胞MMP-2表达的抑制作用及对细胞侵袭力的影响[J].世界华人消化杂志,2011,19(1):19-24.
[4]Peng L,Xie D Y,Lin B L,et al.Autologous bone marrow mesenchymal stem cell transplantation in liver failure patients caused by hepatitis B:short-term and long-term outcomes[J].Hepatology,2011,54(3):820-828.
[5]Ju S,Teng G J,Lu H,et al.In vivo differentiation of magnetically labeled mesenchymal stem cells into hepatocytes for cell therapy to repair damaged liver[J].Invest Radiol,2010,45(10):625-633.
[6]Li T Z,Kim J H,Cho H H,et al.Therapeutic potential of bone-marrow-derived mesenchymal stem cells differentiated with growth-factor-free coculture method in liver injured rats[J].Tissue Eng Part A,2010,16(8):2649-2659.
[7]Cao Shi-bo,Meng Qing-hai,Jin Peng,et al.Construction and effects of bone marrow mesenchymal stem cells-cytosine deaminase/5-fluorocytosine suicide gene therapy system[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2010,14(27):4964-4969.
[8]Ren C,Kumar S,Chanda D,et al.Therapeutic potential of mesenchymal stem cells producing interferon-alpha in a mouse melanoma lung metastasis model[J].Stem Cells,2008,26(9):2332 -2338.
[9]Myers T J,Granero-Molto F,Longobardi L,et al.Mesenchymal stem cells at the intersection of cell and gene therapy[J].Expert Opin Biol Ther,2010,10(12):1663-1679.
[10]Feng G,Zhang L J,Luo L Q.Anti-tumor Effects of BMSCs Transfected with pCE-GFP on Walker-256 Cells[J].Acta Med Univ Sci Technol Huazhong,2010,40(2):204-208.
[11]刘益均,郑军,肖文波,等.氧化苦参碱对人胃癌SGC-7901细胞增殖及血管内皮生长因子表达的影响[J].中国癌症杂志,2010,20(1):22-26.
[12]万旭英,罗明,贺平,等.苦参碱和氧化苦参碱体外对人肝癌细胞的诱导分化作用[J].中国药理学通报,2009,25(7):977-979.
[13]姜子瑜,华海清,秦叔逵,等.复方苦参注射液对人肝癌细胞SMMC-7721增殖与细胞周期的影响[J].吉林中医药,2011,31(7):690-692.
[14]孙丽群.复方苦参注射液联合化疗治疗转移性结直肠癌临床研究[J].吉林中医药,2013,33(1):53-54.

