夏季黄东海中华哲水蚤种群分布、脂类含量和利用策略
王延清,李超伦,刘梦坛,孙晓霞
(1. 中国科学院海洋研究所海洋生态与环境科学重点实验室, 青岛 266071; 2. 中国科学院大学, 北京 100049;3. 中国科学院海洋研究所 山东胶州湾海洋生态系统国家野外科学观测研究站, 青岛 266071)
夏季黄东海中华哲水蚤种群分布、脂类含量和利用策略
王延清1,2,李超伦1,*,刘梦坛3,孙晓霞3
(1. 中国科学院海洋研究所海洋生态与环境科学重点实验室, 青岛 266071; 2. 中国科学院大学, 北京 100049;3. 中国科学院海洋研究所 山东胶州湾海洋生态系统国家野外科学观测研究站, 青岛 266071)
度夏过程对黄东海中华哲水蚤其种群延续具有重要的意义。通过2011年08月黄东海现场调查航次研究了中华哲水蚤夏季种群的分布和脂类含量,探讨了中华哲水蚤度夏期间的能量利用策略。结果表明,夏季在黄海中部以及浙江近岸存在中华哲水蚤的密集分布区域。其中,黄海冷水团内的中华哲水蚤以C5期(平均为77.4%)个体为主,而冷水团周边及浙江近岸站位则主要由C5期(分别为32.3%和33.2%)和雌体(分别为41.3%和51.8%)组成。脂类含量结果显示,冷水团内的C5期中华哲水蚤的总脂含量最高(平均43.1 μg/个), 浙江近岸雌体的总脂含量(平均24.6 μg/个)和黄海冷水团周边雌体的总脂含量(平均18.2 μg/个)较低。在完全饥饿的假设下,冷水团内的C5期中华哲水蚤具有明显的代谢优势,其储存的脂类可以维持超过18天的代谢需求。而在浙江近岸以及冷水团周边,中华哲水蚤储存的脂类则只可维持3—6d的需求。由此推测,黄海冷水团内的C5期中华哲水蚤依靠储存的油脂和较低的摄食率度夏,而冷水团以外的种群则需要在适宜温度下积极摄食才能顺利度夏。
中华哲水蚤;脂类;度夏;能量利用
中华哲水蚤是我国黄东海浮游动物优势种[1],其种群的数量变动对黄东海生态系统的结构和功能变化有重要影响[2- 3]。根据以往研究,夏季高温对中华哲水蚤具有伤害作用[4],因此,深入研究中华哲水蚤夏季种群采取何种度夏策略以保证种群延续,对于了解其种群动力学机制具有重要意义。针对黄海冷水团内中华哲水蚤度夏策略的研究已有很多[5- 6],这些研究表明黄海中华哲水蚤种群主要集中在低温稳定的黄海冷水团内完成度夏[7- 9]。冷水团的低温环境有利于度夏中华哲水蚤的能量代谢,Li等[5]通过实验发现黄海冷水团内中华哲水蚤具有较低代谢率,这有利于冷水团内中华哲水蚤的存活。另外,孙松等对南黄海中华哲水蚤种群油囊体积的研究,发现南黄海中华哲水蚤度夏C5种群含有较大油囊体积,推测脂类是维持度夏种群能量需求的主要来源[10]。
另外,研究表明,夏季东海近岸上升流区也存在着较高密度的中华哲水蚤种群[11- 12],但是对这些种群度夏策略的研究相对较少。同时,由于脂类物质是哲水蚤主要的能量储存方式,并且在哲水蚤的休眠及繁殖活动等过程中发挥着重要作用[13]。因此,本文对中华哲水蚤的脂类含量及组成进行了分析,并进一步从脂类角度对南黄海和东海近岸中华哲水蚤夏季种群的能量利用进行了初步的探讨,以期为系统揭示中华哲水蚤种群度夏机制提供营养动力学方面的证据。
1 材料和方法
1.1 取样
利用2011年8月在东海及南黄海进行的调查航次,完成了中华哲水蚤样品的采集工作,采样站位见图1。同时,在本航次的所有调查站位同步获得了温度和叶绿素数据(图1),其中水温数据由SBE911型CTD同步测定,叶绿素a数据根据海洋调查规范(GB/T12763.6—2007)进行分层采集获得。浮游动物样品采用标准浮游动物大网(网口直径0.8 m,网孔直径500 μm),从距海底4 m处垂直拖网至表层获得。用于种群鉴定的样品保存于5%福尔马林海水溶液中,回实验室后用OLYMPUS SZ61型解剖镜,分期(C4、C5、雌体和雄体)计数。另外,现场挑取50—100只中华哲水蚤用于脂类分析,将挑取的中华哲水蚤装入冻存管,放入液氮保存,回实验室后进行脂类分析。
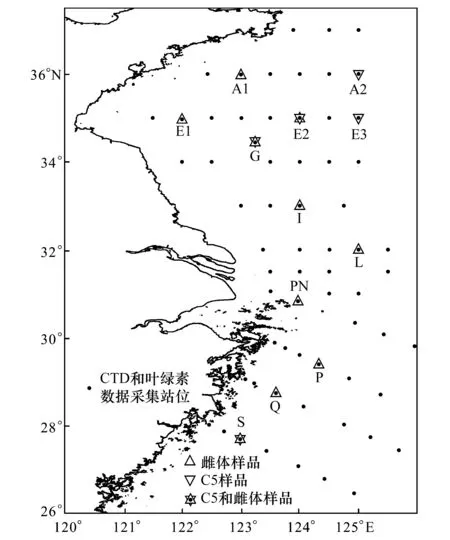
图1 采样站位Fig.1 Study area△表示只取得了雌体,▽表示只取得了C5,☆表示取得了C5和雌体; 叶绿素和CTD水温数据采集站位以小点表示;图中字母表示站位
1.2 脂类提取及分析
用真空冷冻干燥机对液氮保存样品进行干燥48 h,称重。参照Folch[14]方法对称重后的干燥样品进行脂类提取。具体提取步骤如下:先用二氯甲烷∶甲醇(2∶1,体积分数)提取3次,合并有机相;然后,用0.88%的KCl溶液洗涤萃取液,将萃取液进行低速离心(2000 r/min,5 min)分层,分离得到下层有机相;最后,用氮气吹干分离得到的有机相,用分析天平(±100 μg)称量,得到总脂重量。获得的总脂,用IATROSCAN MK- 6S型TLC/FID棒状薄层色谱仪进行脂类组成分析[15]。
1.3 能量消耗计算
能量消耗,利用T.lkeda等[16]的方法,将呼吸率转化为碳的消耗量,然后,脂类的含碳量取0.8转化为脂类的消耗速率(公式1),假设在无摄食的情况下,利用本文中获得的脂类含量,对维持时间进行了估算(公式 2)。
脂类消耗(μg 个-1d-1)=呼吸速率(个/D)×RQ×12/22.4×0.8-1
(1)
维持时间(d)=脂类含量(μg/个)/脂类消耗(μg 个-1d-1)
(2)
2 结果
2.1 水文及食物环境
2011年8月(夏季)航次期间,调查海区表层水温变化范围为21—29 ℃,由北向南逐渐升高(图2);底层水温受到黄海冷水团和黑潮次表层水影响明显(图2),黄海冷水团(以10 ℃等温线为界)分布在123°E以东的黄海海槽中,其边缘存在着等温线密集的锋面区。而在东海,黑潮次表层水的爬升导致底层温度小于20 ℃的海域主要分布在122°E以东,并且122°E附近等温线密集,水温由外海向近岸方向递增。黄东海交界处的长江口以外海域底表温度较高,均超过23 ℃。
水体平均叶绿素含量低于0.2 mg/m3的海域主要是123°E以东的黄海以及122°E以东的东海,而在底温>20 ℃的海域叶绿素含量均超过0.7 mg/m3,最高值出现在东海近岸,为2.45 mg/m3(图2)。
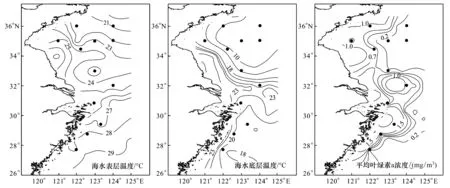
图2 海水表层温度、底层温度及平均叶绿素a浓度分布Fig.2 Distribution of surface temperature, bottom temperature and mean chla concentration•表示中华哲水蚤采样站位
2.2 中华哲水蚤水平分布
夏季,中华哲水蚤在南黄海和东海存在两个丰度较高的分布区(图3),黄海密集区种群丰度显著高于浙江近岸密集区。首先,在南黄海,中华哲水蚤丰度最高的区域位于底温≤10 ℃的黄海冷水团内,平均丰度242.6 个/m3;其次,在浙江近岸底温20 ℃等温线附近,也存在着中华哲水蚤的高密集区,平均丰度为91.0 个/m3。
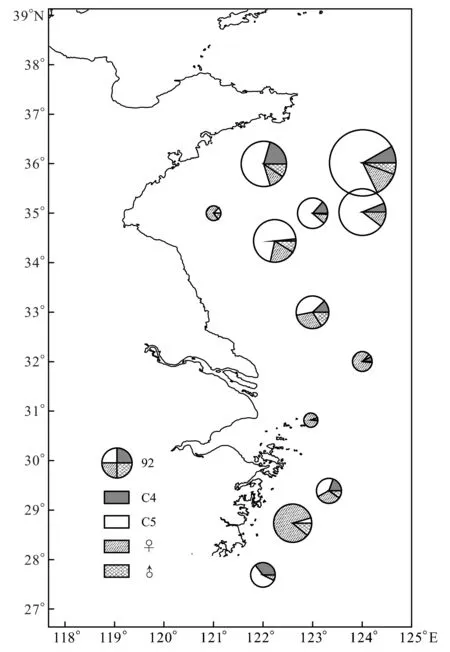
图3 中华哲水蚤丰度(个/m3)和C4期至成体组成的水平分布Fig.3 Population abundance (ind/m3) and stage composition (C4-adult) of C. sinicus
另外,分期计数结果显示,中华哲种群在黄海密集区和东海密集区的种群组成明显不同,在黄海密集区内,C5期个体占中华哲水蚤种群丰度比例为77.4%,呈现明显的度夏种群特征。而在浙江近岸密集区内,中华哲水蚤种群则主要由C5期个体和雌体组成,两者占种群丰度比例分别为33.2%和41.3%。黄海冷水团周边站位的种群结构与浙江近岸区域相似,C5期个体和雌体占种群丰度比例分别为32.3%和51.8%。
2.3 脂类含量及组成
总共获得12个站位采集的15份样品的干重、脂类含量及组成信息(表1),并在下文对数据进行了分析。
2.3.1 聚类分析
根据获得样品的干重及脂类组成和含量信息,对样品进行了聚类分析(图4)。结果表明,黄海冷水团内的雌体(E2站位)和浙江近海站位的雌体聚集为一类,标记为 group1,黄海冷水团周边站位雌体(L站位除外)和长江口外海的N站位雌体聚集为一类,标记为group2,所有的C5期中华哲水蚤聚集为一类,标记为group3。
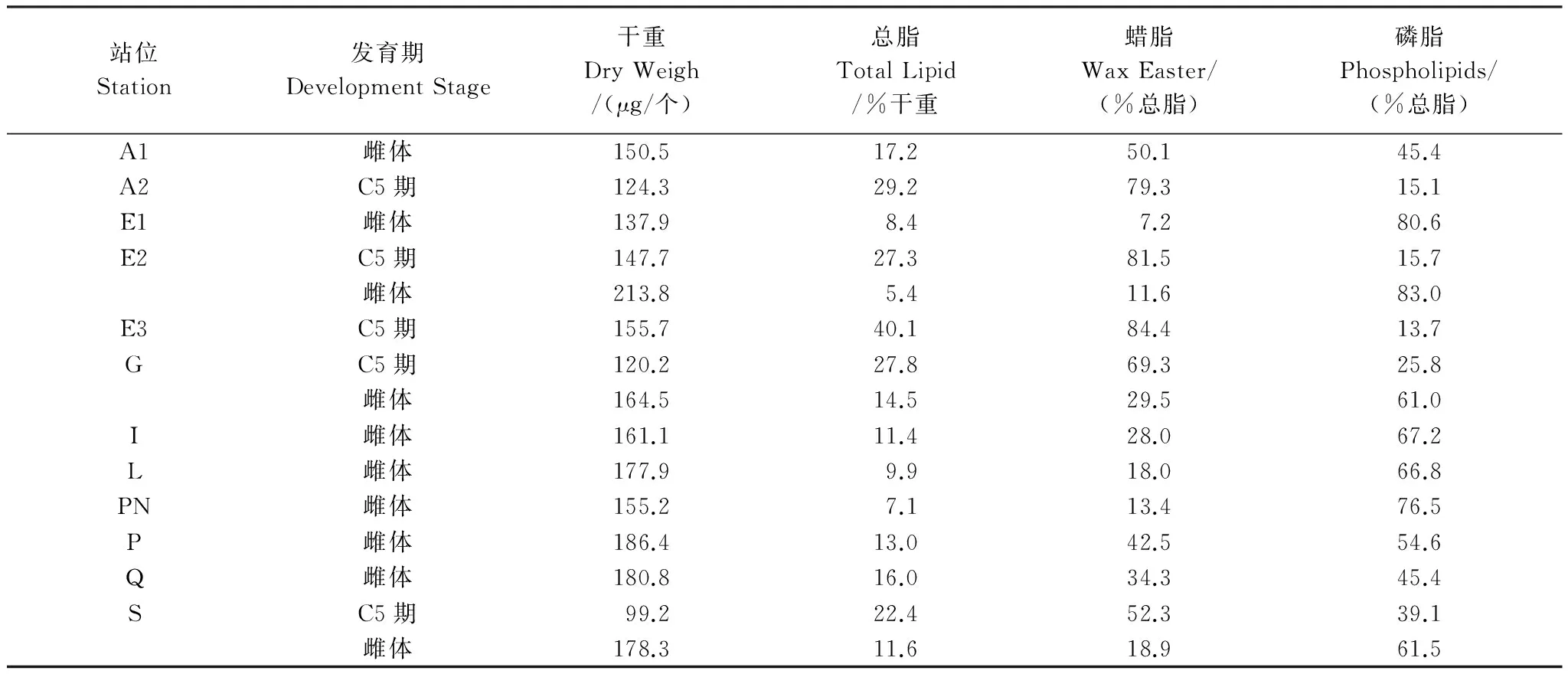
表1 中华哲水蚤干重、脂类含量及组成
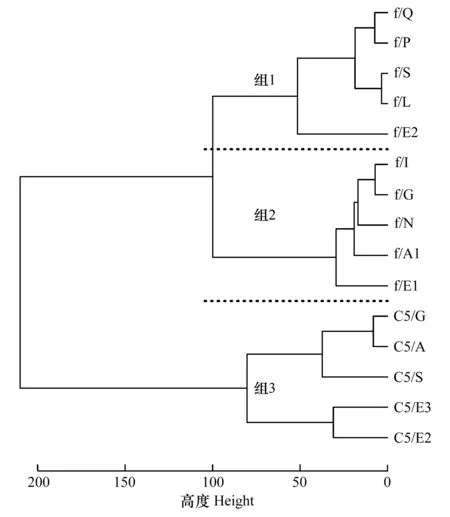
图4 聚类分析Fig.4 Hierachical clustering analysis of samplesC5表示种群,其它表示站位
2.3.2 各分组的特点
各类群的干重及脂类组成特点如图5所示。 group3(C5期个体)干重均值为129.4 μg/个,显著低于group1和group2的187.4和153.8 μg/个(P<0.01),而总脂平均含量为39.0 μg/个,高于另外两组的20.6和18.2 μg/个(P<0.05)。另外,C5期个体的总脂主要由蜡脂构成,蜡脂占总脂的比例平均为73.4%,而group1(雌体)和group2(雌体)的总脂中磷脂具有较高含量,平均为64.2%。group1和group2两组之间在总脂、蜡脂及磷脂含量上没有显著性差别,仅group1的干重显著高于group2(P<0.01)。
2.3.3 能量消耗计算
在不考虑摄食,并假设以脂类作为能量来源的前提下,结合以往呼吸率资料对各分组的能量利用情况进行了估算(表2)。结果表明,冷水团内C5期个体由于脂类含量高,代谢率低,可以维持较长时间的能量代谢需求(>18d),而浙江近海雌体由于代谢率高,体内储存能量可维持天数最少(3d),而冷水团外围的雌体和冷水团内雌体具有相似的维持天数(5d左右)。
3 讨论
夏季,黄海冷水团以及浙江近海仍然有较高密度的中华哲水蚤种群存在,这些区域的存在对于中华哲水蚤种群延续具有重要意义,下面主要从温度和饵料因素对种群的影响以及不同海域度夏种群的能量利用方面进行讨论。
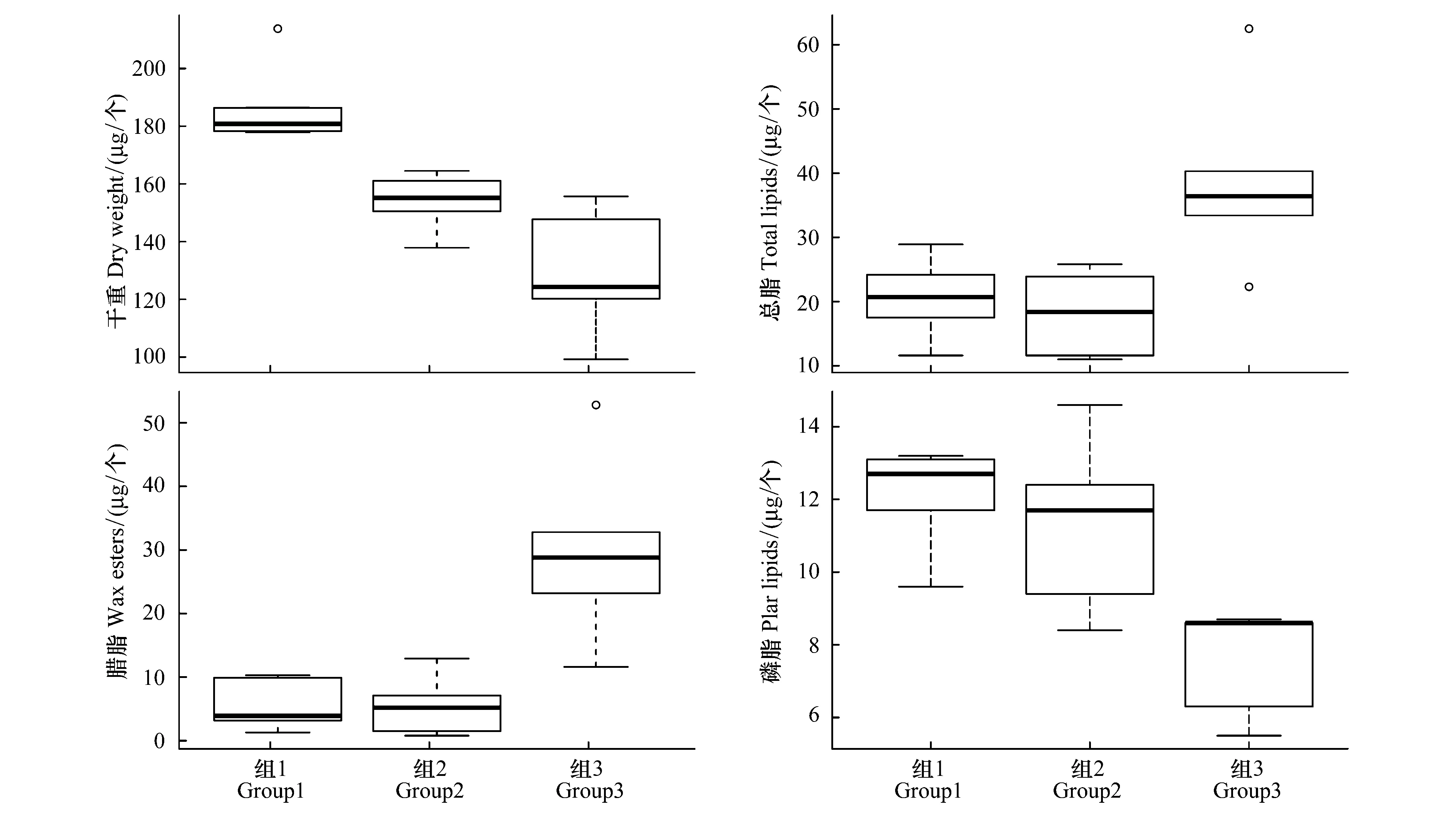
图5 各分组的干重、总脂、蜡脂及磷脂含量Fig.5 Dry weight, Total lipid, Wax easter and polar lipids of each group
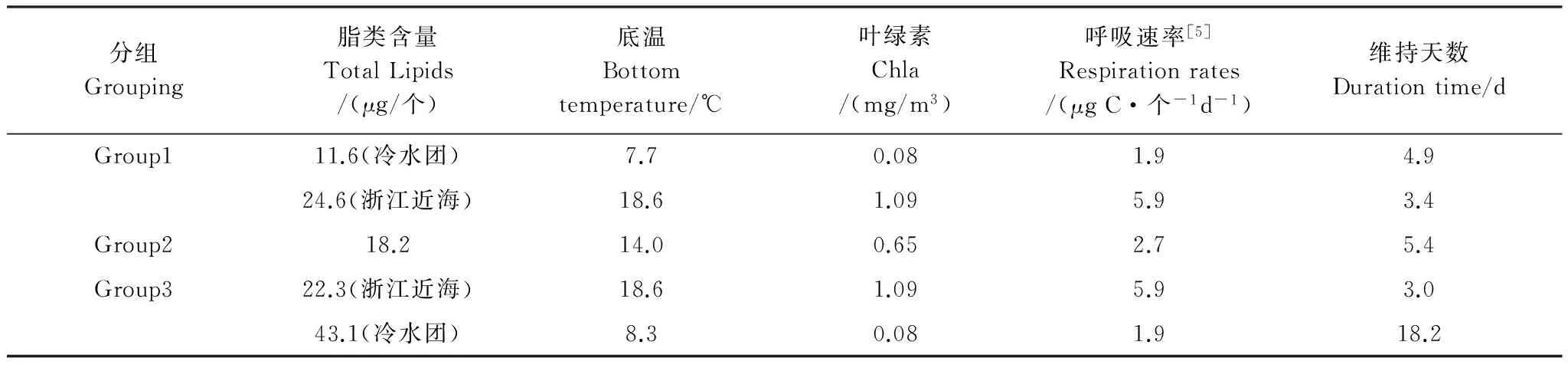
分组Grouping脂类含量TotalLipids/(μg/个)底温Bottomtemperature/℃叶绿素Chla/(mg/m3)呼吸速率[5]Respirationrates/(μgC·个-1d-1)维持天数Durationtime/dGroup111.6(冷水团)7.70.081.94.924.6(浙江近海)18.61.095.93.4Group218.214.00.652.75.4Group322.3(浙江近海)18.61.095.93.043.1(冷水团)8.30.081.918.2
呼吸率取自Li等[5]; 呼吸率转换中脂类RQ值取0.72[16]
3.1 温度对种群分布的影响
在已有的研究中,水温超过23 ℃中华哲水蚤就不能成功繁殖[17- 18],超过26—27 ℃便会造成中华哲水蚤的死亡[19- 20],也有研究显示,中华哲水蚤生长的适宜温度在20 ℃左右[21]。本航次调查的表层水温基本都在22 ℃以上(除A2站位),这样的温度可能已经开始不适于中华哲水蚤的大量存在。但是,由于研究海域受到黄海冷水团和浙江近岸上升流的影响,使得在这些海域的温跃层下仍然存在着适宜中华哲水蚤生长的温度环境。首先,南黄海水温适宜的区域(底温<20 ℃)覆盖了122°E以东、33°N以北的海域,冷水团(底温<10 ℃)主要分布在122°30′E以东的黄海海槽中。其次,在浙江近海,底温< 20 ℃的海域主要分布在122°E以东。种群丰度与底温分布明显相关(P<0.05),种群丰度高的站位均在底温20 ℃等温线以内,这些站位的平均种群丰度为143.4 个/m3,显著高于底温超过20 ℃的站位(平均丰度为29.8 个/m3),温度是限制夏季各海区中华哲水蚤种群分布的重要因素之一。
3.2 温度和饵料环境与种群组成
黄海冷水团内部种群主要由C5期个体构成,与以往的调查结果相同[9],而冷水团周边以及浙江近岸种群则含有较高比例的雌体和C5。对比这两个区域内温度和饵料的差异,可以为种群组成差别提供解释。许多研究表明,饵料和温度对中华哲水蚤生长、繁殖起到重要作用[22- 24]。蒲新明对冷水团内C5个体的平均发育时间进行推测发现,在9 ℃下由C5期发育至成体的时间至少为62d,然而在饵料充足情况下,Uye获得的室内10 ℃下从卵到成体的发育时间40d左右[17,25],良好的饵料条件明显加快了发育速度。冷水团内较低的温度和饵料限制了雌体的繁殖活动和幼体的发育,而C5期个体由于在度夏之前便储存了较多脂类,加之低的代谢率,适应冷水团内环境而大量存在。相对于冷水团内部,冷水团周边饵料环境较好,种群可以获得支持其个体生长发育所需的饵料补充,同时适宜温度下也不会延缓个体发育,所以在这些海域的中华哲水蚤种群结构与冷水内种群具有明显的差别。
3.3 不同环境下中华哲水蚤的能量利用策略
在不考虑摄食的假设下,冷水团周边以及浙江近岸的中华哲水蚤种群只能维持3—6d的代谢。因此,这些种群必须活跃摄食,才能维持能量需求,否则其种群会快速衰亡。 Li等在夏季黄海中华哲水蚤的摄食实验中也证明,冷水团外站位的中华哲水蚤摄食活跃[5]。而冷水团内的C5期中华哲水蚤,由于代谢速率低,同时其储存的脂类多,可以在完全没有饵料供给情况下存活18d以上(表2)。Pu等对度夏C5期个体在饥饿条件下培养27d的存活率超过80%[6],与本次调查结果较为一致。
另外,虽然冷水团内的度夏C5期中华哲水蚤具有明显的代谢优势,但这种估测与现场数据还存在着差异。根据以往资料,冷水团内C5期中华哲水蚤的度夏时间可以维持到10月末,并且在度夏结束后仍有较多的脂类剩余[12, 26]。由于本文调查取样时间是在8月下旬,估测时间不能与现场数据相吻合,所以,冷水团内的C5期个体在滞育期间可能需要依靠一定量的摄食获取能量。加入摄食因素后(摄食率取自Li等对冷水团内C5期中华哲水蚤的测定[5])重新估算得到的维持时间为114d,冷水团C5期中华哲水蚤可以成功度夏。冷水团内的雌体,加入摄食因素后,基本可以维持自身代谢平衡,每天还有少量的结余(0.5 μgC 个-1d-1),但这些少量的能量结余不足以支持积极的繁殖活动,这与黄海冷水团内雌体产卵率低的实际观测结果相一致[27]。而对冷水团周边和浙江近海的中华哲水蚤,加入摄食因素后,其能量结余较多(2.3—3.2 μgC 个-1d-1),可以支持雌体繁殖的能量需求,这也与王世伟在夏季黄海测得的产卵率结果相符合[27]。
综上所述,夏季黄东海中华哲水蚤为维持种群生存,在不同海域采取不同的能量利用方式。脂类作为主要的能源性物质,在冷水团内部的C5期个体中具有较高含量。在冷水团内较低的代谢速率和饵料环境下,C5期中华哲水蚤可以通过少量摄食和对储存脂类的消耗维持代谢需求,从而使种群顺利度夏。然而,对于具有较高代谢速率的黄海冷水团周边种群和浙江近岸种群,脂类提供的能量只可维持非常有限的存活时间(3—6d),这些区域的中华哲水蚤必须通过积极摄食才能维持代谢平衡,使种群在夏季得以延续。
致谢:中国科学院海洋研究所的王世伟、王彦涛、吉鹏以及科学三号船员在采样过程中给予协助,特此致谢。
[1] Chen Q C. A study of the breeding periods, variation in sex ratio and in size ofCalanussinicusbrodsky. Oceanologia Et Limnologia Sinica, 1964, 6(3): 272- 288.
[2] Tang Q S, Su J L, Zhang J. China GLOBEC II: A case study of the Yellow Sea and East China Sea ecosystem dynamics. Deep Sea Research Part II: Topical Studies in Oceanography, 2010, 57(11/12): 993- 995.
[3] Sun S, Huo Y Z, Yang B. Zooplankton functional groups on the continental shelf of the yellow sea. Deep Sea Research Part II: Topical Studies in Oceanography, 2010, 57(11/12): 1006- 1016.
[4] Zhang G T, Sun S, Yang B. Summer reproduction of the planktonic copepodCalanussinicusin the Yellow Sea: influences of high surface temperature and cold bottom water. Journal of Plankton Research, 2007, 29(2): 179- 186.
[5] Li C, Sun S, Wang R, Wang X. Feeding and respiration rates of a planktonic copepod (Calanussinicus) oversummering in Yellow Sea Cold Bottom Waters. Marine Biology, 2004, 145(1): 149- 157.
[6] Pu X M, Sun S, Yang B, Ji P, Zhang Y S, Zhang F. The combined effects of temperature and food supply onCalanussinicusin the southern Yellow Sea in summer. Journal of Plankton Research, 2004, 26(9): 1049- 1057.
[7] Wang R, Zuo T, Wang K. The Yellow Sea cold bottom water-an oversummering site forCalanussinicus(Copepoda, Crustacea). Journal of Plankton Research, 2003, 25(2): 169- 183.
[8] Sun S. Over-summering strategy ofCalanussinicus. [2013- 06- 10]. http: //www. igbp-cnc. org. cn/UserFiles/IGBP-Sun%20Song. Pdf.
[9] Pu X M, Sun S, Yang B, Zhang G T, Zhang F. Life history strategies ofCalanussinicusin the southern Yellow Sea in summer. Journal of Plankton Research, 2004, 26(9): 1059- 1068.
[10] Sun S, Wang S W, Li C L. Preliminary study on the oil storage ofCalanussinicusfifth copepodites (C5) in the Yellow Sea. Oceanologia Et Limnologia Sinica, 2011, 42(2): 165- 169.
[11] Xu Z l, Cui X S, Chen W Z. Species composition and dominant species study on pelagic copepods in the East China Sea. Journal of Fisheries of China, 2004, 28(1): 35- 40.
[12] Sun L F, Ke X, Xu Z L, Que J L, Tian F G. The influence of upwelling and water mass on the ecological group distribution of zooplankton in Zhejiang coastal waters. Acta Ecologica Snica, 2013, 33(6): 1811- 1821.
[13] Lee R F, Hagen W, Kattner G. Lipid storage in marine zooplankton. Marine Ecology Progress Series, 2006, 307: 273- 306.
[14] Folch J, Lees M, Sloane-Stanley G H. A simple method for the isolation and purification of total lipids from animal tissues. Journal of Biological Chemistry, 1957, 226(1): 497- 509.
[15] Ohman M D. On the determination of zooplankton lipid content and the occurrence of gelatinous copepods. Journal of Plankton Research, 1997, 19(9): 1235- 1250.
[16] lkeda T, Torres J J, Hernandez-Leon S, Geiger S P. Metabolism // ICES Zooplankton Methodology Manual. Harris R, Wiebe P, Lenz J, Skjoldal H R, Huntley M. London: Academic Press, 2000: 455- 532.
[17] Uye S I. Temperature-dependent development and growth ofCalanussinicus(Copepoda: Calanoida) in the laboratory. Hydrobiologia, 1988, 167- 168(1): 285- 293.
[18] Huang C, Uye S, Onbe T. Geographic distribution, seasonal life cycle, biomass and production of a planktonic copepodCalanussinicusin the Inland Sea of Japan and its neighboring Pacific Ocean. Journal of Plankton Research, 1993, 15(11): 1229- 1246.
[19] Huang J Q, Li S Q, Chen Y P. On the species composition and distribution of Zooplankton at Luoyuan Bay of Fujian, China. Journal of Xiamen University: Natural Science, 1989, 28(S1): 85- 95.
[20] Huang J Q, Chen B Y. Species composition and distribution of planktonic copepods in the Jiulong Jiang eastuary, Fujian. Taiwan Strait, 1985, 4(1): 79- 88.
[21] Chen L H, Chen G, Li S J, Guo D H. Influence of temperature and salinity on respiratory rate of spring′s dominant copepods in Xiamen Harbour. Taiwan Strait, 2001, 20(S1): 184- 189.
[22] Uye S I, Murase A. Relationship of egg production rates of the planktonic copepodCalanussinicusto phytoplankton availability in the Inland Sea of Japan. Plankton Biology and Ecology, 1997, 44(1/2): 3- 11.
[23] Zhang G T, Sun S, Zhang F. Seasonal variation of reproduction rates and body size ofCalanussinicusin the Southern Yellow Sea, China. Journal of Plankton Research, 2005, 27(2): 135- 143.
[24] Zhang G T, Li C L, Sun S, Zhang H Y, Sun J, Ning X R. Feeding habits ofCalanussinicus(Crustacea: Copepoda) during spring and autumn in the Bohai Sea studied with the herbivore index. Scientia Marina, 2006, 70(3): 381- 388.
[25] Pu X M. Life Strategy ofCalanussinicusin the Southern Yellow Sea in Summer [D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2003.
[26] Wang Y Q, Li C L, Liu M T, Jin X, Wang X D, Sun Y K. Lipid content and composition ofCalanussinicusin the Yellow Sea in spring and autumn. Acta Oceanologica Sinica, 2014, 32(2): 99- 107.
[27] Wang S W. Reproduction, Population Recruitment and Life History ofCalanussinicusin the Yellow Sea [D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2009.
参考文献:
[1] 陈清潮. 中华哲水蚤的繁殖, 性比率和个体大小的研究. 海洋与湖沼, 1964, 6(3): 272- 288.
[10] 孙松, 王世伟, 李超伦. 黄海中华哲水蚤 C5 发育期油脂积累初步研究. 海洋与湖沼, 2011, 42(2): 165- 169.
[11] 徐兆礼, 崔雪森, 陈卫忠. 东海浮游桡足类的种类组成及优势种. 水产学报, 2004, 28(1): 35- 40.
[12] 孙鲁峰, 柯昶, 徐兆礼, 阙江龙, 田丰歌. 上升流和水团对浙江中部近海浮游动物生态类群分布的影响. 生态学报, 2013, 33(6): 1811- 1821.
[19] 黄加祺, 李少青, 陈亚萍. 福建罗源湾浮游动物的种类组成和数量分布. 厦门大学学报: 自然科学版, 1989, 28(S1): 85- 95.
[20] 黄加祺, 陈柏云. 九龙江口浮游桡足类的种类组成和分布. 台湾海峡, 1985, 4(1): 79- 88.
[21] 陈丽华, 陈钢, 李少菁, 郭东晖. 温盐度对厦门港春季主要桡足类呼吸率影响的实验. 台湾海峡, 2001, 20(增刊): 184- 189.
[25] 蒲新明. 中华哲水蚤夏季在南黄海的生活策略 [D]. 青岛: 中国科学院海洋研究所, 2003.
[26] 王延清, 李超伦, 刘梦坛, 金鑫, 王晓东, 孙永坤. 黄海春、秋季中华哲水蚤脂类含量及组成分析. 海洋学报, 2014, 32(2): 99- 107.
[27] 王世伟. 黄海中华哲水蚤繁殖、种群补充与生活史研究 [D]. 青岛: 中国科学院海洋研究所, 2009.
Spatial distribution and lipid related energy-consumption strategies ofCalanussinicusin summer in the southern Yellow Sea and East China Sea
WANG Yanqing1,2, LI Chaolun1,*, LIU Mengtan3, SUN Xiaoxia3
1KeyLaboratoryofMarineEcologyandEnvironmentalSciences,InstituteofOceanology,ChineseAcademyofSciences,Qingdao266071,China2UniversityofChineseAcademyofSciences,Beijing100049,China3JiaozhouBayEcosystemResearchStation,InstituteofOceanology,ChineseAcademyofSciences,Qingdao266071,China
Calanussinicusis an ecologically important copepod species found in the shelf waters of the western part of the North Pacific Ocean. Over-summering strategies are important for the population dynamics ofC.sinicus. In this paper, we studied the lipid content as well as the abundance and structure of theC.sinicuspopulation in the southern Yellow Sea and East China Sea in summer to enhance our understating of the various over-summering strategies. In August 2011,C.sinicuswas collected using a 500 μm mesh ring net (mouth opening, 0.5 m2). The samples used for studying the abundance and structure of the population were preserved in 5% formalin seawater solutions. The total lipid content was extracted from fifth copepodite (C5) or femaleC.sinicuswith 3 mL chloroform: methanol (2∶1 v/v) at -20℃ for 16 h and weighted on a Cahn electrobalance (±100 μg). The lipid content was separated using a chromatographic method and analyzed in duplicate using Iatroscan® MKS- 6 with flame ionization detector (FID). The results showed that certain regions in the Yellow Sea Cold Bottom Waters (YSCBW, water temperature<10oC) had the highest amount ofC.sinicusranging from 93.3 ind/m3to 446.9 ind/m3(mean, 242.6 ind/m3). The area near the shore of the East China Sea also showed an abundantC.sinicuspopulation (range, 60.8—148.4 ind/m3; mean, 91.0 ind/m3). In addition, regional differences were observed with regard to the structure of the population. In the southern Yellow Sea, C5 accounted for 77.4% of the total population in the YSCBW, while C5 and females contributed to 32.3% and 51.8%, respectively, out of the YSCBW. In the East China Sea, the structure of the population was similar to that outside the YSCBW with 33.2% of C5 and 41.3% females. The results of the abundance and structure of the population indicate that the area near the shore of the East China Sea may also act as a preservation area forC.sinicusin summer along with the YSCBW. The total lipid content in femaleC.sinicuswas approximately 5.4—17.2% of their dry body mass, while C5 had higher lipid content (22.4%—40.1%). The lipid content of C5 in the YSCBW was 43.1 μg/ind, while the lipid content of the females in the YSCBW (mean, 24.6 μg/ind) and at the area near the shore of the East China Sea (mean, 18.2 μg/ind) was lower than C5 in YSCBW. The major lipid classes were wax ester and phospholipid and together they comprise of approximately 90% to the total lipid content. The C5 in the YSCBW can survive longer (18 days) thanC.sinicusin other areas (≤6 days) by utilizing the lipid content as their sole energy source for their basic metabolic needs. However, this is still insufficient for successful over-summering ofC.sinicus. The C5 in the YSCBW can use stored lipid and sustain on a limited food supply during over-summering, whileC.sinicusin other areas require active feeding to survive during the summer.
Calanussinicus; lipid; over-summering; energy-consumption
国家自然科学基金(41076099,41121064);国家重点基础研究发展规划(973)项目(2011CB403604)
2013- 06- 10;
2014- 06- 12
10.5846/stxb201306101596
*通讯作者Corresponding author.E-mail: lcl@qdio.ac.cn
王延清,李超伦,刘梦坛,孙晓霞.夏季黄东海中华哲水蚤种群分布、脂类含量和利用策略.生态学报,2014,34(16):4632- 4639.
Wang Y Q, Li C L, Liu M T, Sun X X.Spatial distribution and lipid related energy-consumption strategies ofCalanussinicusin summer in the southern Yellow Sea and East China Sea.Acta Ecologica Sinica,2014,34(16):4632- 4639.
——以“不同咖啡因饮料对水蚤心率的影响”为例

