胶州湾生物-物理耦合模型参数灵敏度分析
石洪华,沈程程,李 芬,王勇智
(1.国家海洋局第一海洋研究所,青岛 266061; 2.中国海洋大学环境科学与工程学院,青岛 266100;3.中国海洋大学数学科学学院,青岛 266100)
胶州湾生物-物理耦合模型参数灵敏度分析
石洪华1,*,沈程程1,2,李 芬3,王勇智1
(1.国家海洋局第一海洋研究所,青岛 266061; 2.中国海洋大学环境科学与工程学院,青岛 266100;3.中国海洋大学数学科学学院,青岛 266100)
参数灵敏度分析旨在评价模型中各参数对模拟结果的影响程度,是参数优化和模型校正的基础步骤,也是认识模型行为的重要工具。所建的胶州湾生物-物理耦合模型包括浮游植物、浮游动物、营养盐、碎屑和溶解氧5类状态变量,对其涉及的50个参数进行灵敏度分析,得到3个非常灵敏性参数、2个灵敏性参数、11个比较灵敏性参数和34个不太灵敏性参数。非常灵敏及灵敏性参数包括浮游植物生长速率(μPRPC)、暗反应修正因子(FAC)、光饱和强度(α)、浮游植物死亡率(μDEPC)和水体消光系数(bla),主要影响浮游植物生长和死亡过程,反映了浮游植物在生态系统中的基础性和重要性作用。这5个参数显著地影响碳和营养盐循环,是整个胶州湾生态系统最主要的影响参数,应优先进行优化。比较灵敏性参数的影响主要表现在营养盐对浮游植物生长或死亡的限制以及温度对光饱和量的限制,浮游动物生长、牧食和死亡过程以及浮游植物生物量对牧食的限制,叶绿素a的生产,缺氧条件下沉积物释放磷以及浮游植物对磷的摄取等过程,这些参数对于各状态变量的灵敏性存在不同程度的差异,从而表征不同的特点。与不太灵敏性参数相关的过程主要为叶绿素a和碎屑消光作用,温度对浮游植物生长、浮游动物牧食、碎屑和沉积物矿化的限制,碎屑和沉积物矿化与沉降,与无机氮相关的大部分过程,溶解氧浓度变化等,这些过程除了受模型内部参数影响外,还在很大程度上受水深、海水温度和陆源污染等外部因素影响。比较灵敏及不太灵敏性参数影响模型局部过程,是模型校正的重要依据,除了非常灵敏及灵敏性参数以外,叶绿素a、浮游动物、碎屑和无机磷四种状态变量可分别根据叶绿素a最大生产系数(KCHmax)、浮游动物一级死亡率(μDEZC1)、有机碎屑矿化率(μREDC)和浮游植物磷摄取的半饱和常数(hUPPP)进行校正。与营养盐相关参数的灵敏度分析表明,胶州湾浮游植物处于磷限制,无机氮主要受陆源排污影响。因此,对无机氮的校正主要通过合理设置沿岸河流径流量或陆源污染物浓度与比例以及无机氮初始场。溶解氧对各参数均不太灵敏。
胶州湾;生物-物理耦合模型;参数灵敏度分析
近海生态系统是人类缓解资源环境压力的重要区域,已成为经济活动的密集区和社会发展的支撑区[1]。近海生态系统的可持续发展是沿海地区经济社会发展的重要保障。近年来,在全球气候变化和人类活动的双重影响下,诸如有害赤潮、水母灾害等海洋生态灾害频发,表明近海生态系统正发生结构和功能演变甚至是结构转换[1]。加强海洋生态系统动力学模型研究,有助于人们了解自然和人为因素对海洋生态系统结构和功能的影响及生态系统的响应与反馈机制,为海洋生态系统可持续发展和基于生态系统的海岸带综合管理决策提供科学依据[1-3]。
海洋生态系统动力学模型的研究始于20世纪40年代[4],随着90年代以来以北大西洋为区域的模型研究日益增多,逐渐从垂直一维发展到二、三维模式,更加注重物理、化学和生物过程的耦合,研究对象主要是浮游生态系统[2,5]。我国海洋生态学研究始于20世纪50年代,90年代后期逐步走向多学科交叉的定量研究,适用于渤海、黄海和东海等海域的海洋生态系统动力学模型相继建立[3,6-7]。进入21世纪,海洋生态系统动力学模型研究不仅注重考虑海洋生态系统本身的复杂性[8],也关注全球气候变化对海洋生态系统的影响[9],并与社会经济系统耦合开始产量测算、环境评估、公共决策等领域的应用研究,研究对象大多为海洋渔业资源保护与管理[3,10-11]。
限制模型应用最主要的因素之一是模拟结果的不确定性,主要来源于模型参数的不确定性[12-13]。海洋生态系统动力学模型涉及参数众多,而用于确定参数取值的实验数据匮乏,参数优化计算成本高[12-13]。参数灵敏度分析旨在评价模型中各参数对模拟结果的影响程度,为参数优化提供科学依据,已广泛应用于大气科学、经济学和生态学等领域[12-13]。参数灵敏度分析在海洋生态模型研究中的应用,从最初仅作为模型分析的一部分[7,14],逐步发展成为参数优化和模型校正的基础步骤以及模型行为分析的主要手段[15-18],并开始作为分析生态系统对环境变化响应程度的重要工具[19];方法也从较为单一的局部灵敏度分析[14-15,20],发展到全局灵敏度分析以及多种方法的比较[16-17,19]。
本文以胶州湾为例,对构建的生物-物理耦合模型进行参数灵敏度分析,为参数优化与模型校正以及后续研究奠定基础。
1 研究区概况
胶州湾位于山东半岛南岸、黄海之滨,平均水深7.4 m,是典型的半封闭式浅海湾[21-22]。胶州湾沿岸如李村河、大沽河等入海河流众多,环湾地带均为青岛市辖区,受人类活动影响显著[23-24]。河流径流量和营养盐陆源输入的变化,使得胶州湾浮游植物从20世纪60年代的氮限制逐渐转换为磷限制和硅限制,导致大型硅藻减少并趋于小型化,浮游植物优势种类趋于单一化[24-25]。近年来,胶州湾富营养化、绿潮等频发,研究胶州湾营养盐循环和浮游生物的分布与变化,能为防治营养盐污染、抑制富营养化加剧提供科学依据。
2 研究方法
2.1 生物-物理耦合模型
营养盐、浮游植物、浮游动物和碎屑是海洋生态系统最基本的组成部分,胶州湾生物-物理耦合模型考虑潮流场、太阳辐射、海水温盐以及营养盐的河流输入等物理因素,模拟了胶州湾碳、氮、磷循环以及溶解氧平衡。模型模拟了营养盐、浮游植物、浮游动物、碎屑和溶解氧5类状态变量,共涉及50个参数。本文模型的概念模型如图1所示,具体方程参见文献[1]。

图1 生物-物理耦合模型的概念模型示意图Fig.1 The map of the conceptual model of coupled biological/physical model
对生物过程中状态变量的模拟主要以浮游植物碳含量(PC)为基础,考虑浮游植物生产、死亡、沉降及浮游动物牧食。浮游植物生产过程除取决于最大生长速率外,还受光、温度和营养盐限制;浮游植物死亡和沉降过程考虑本身的死亡和沉降速率以及氮、磷营养盐的限制作用;浮游动物牧食过程考虑最大牧食速率以及温度、溶解氧和浮游植物生物量的限制作用。叶绿素a浓度(Chlorophyll-a,CH)的变化基于浮游植物含量,考虑其生产、死亡和沉降过程。浮游动物碳含量(ZC)受自身生长和死亡的影响。碎屑碳含量(DC)来源于死亡浮游植物未矿化而转化为碎屑的部分和浮游动物排泄,同时碎屑又通过矿化和沉降过程减少。模型模拟无机氮(IN)和无机磷(IP)两种营养盐的循环过程。营养盐的源包括生物化学过程释放和外部供给,前者考虑浮游动物呼吸释放以及碎屑和沉积物的矿化过程释放,后者考虑沿岸七条季节性河流的营养盐输入;营养盐的汇主要是浮游植物摄取。溶解氧含量(DO)考虑浮游植物呼吸过程的产氧量,浮游动物呼吸以及碎屑和沉积物矿化过程的耗氧量,同时考虑大气复氧。
2.2 参数灵敏度分析
本文对胶州湾生物-物理耦合模型的参数进行灵敏度分析。参数灵敏度分析通过扰动输入参数,用统计学方法定性或定量地评价模型参数对模拟结果的影响程度[14-18,20]。灵敏度一般定义为状态变量的变化率与参数变化率的比值,即第i个状态变量(y)对第j个参数(x)的灵敏度如下所示[14,20]:
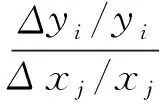
(1)
式中,Δxj为第j个参数的变化量,Δyi为相应的第i个状态变量的变化量。
根据灵敏度大小不同,本文确定灵敏度等级划分标准为:灵敏度的绝对值小于0.1时认为该参数不太灵敏,0.1到0.5之间认为比较灵敏,0.5到1之间认为灵敏,大于1认为非常灵敏。
3 结果分析
3.1 参数灵敏度分析结果
将式(1)中各个参数变化率Δxj/xj均取为10%,计算得到的7个状态变量对50个参数的灵敏度,灵敏度取值从-2.89(DC对α的灵敏度)到4.81(PC对μPRPC和FAC的灵敏度)不等,说明在相同变化率下不同参数对模型结果的影响程度不同。其中,灵敏度绝对值大于等于0.1的占25.7%,大于1的占5.1%。根据本文灵敏度等级划分标准,得到至少对一个状态变量存在比较灵敏性及以上的参数22个(图2)。结果显示,各参数对溶解氧含量来说均不太灵敏,故以下对参数灵敏性的分析主要针对胶州湾生态系统的碳、氮和磷循环。

图2 模型各状态变量对参数的灵敏度的等级划分Fig.2 The grade classification of parameters′ sensitivities on each state variable“-”指该处灵敏度取负值,说明该参数对状态变量的影响呈现负向效应,即该参数取值越大,对应的状态变量取值越小;MAV指各状态变量对参数的灵敏度的绝对平均值
与浮游植物相关的参数中,浮游植物生长速率(μPRPC)和暗反应修正因子(FAC)对于碳循环非常灵敏,对于营养盐循环灵敏(由于μPRPC和FAC在模型方程中的地位相同,因此两者的灵敏度完全相同,以下对μPRPC的分析同样代表FAC的特征);浮游植物死亡率(μDEPC)对于浮游植物、叶绿素a和碎屑非常灵敏,对于浮游动物和磷循环灵敏,对于氮循环比较灵敏;浮游动物最大牧食速率(μGRPC)对于碳循环比较灵敏,对于营养盐循环不太灵敏。根据绝对平均值得出,μPRPC和FAC是本文模型的非常灵敏性参数,μDEPC是灵敏性参数,μGRPC是比较灵敏性参数。
由各状态变量对参数灵敏度的正负性可知,μPRPC对浮游植物产生正向效应,即μPRPC越大,浮游植物生物量越大,从而影响其它状态变量。比如:浮游植物产生的叶绿素a和溶解氧的浓度增大;浮游动物因饵料增多而生物量增大;碎屑因浮游生物死亡或排泄增多而浓度增大;浮游植物对营养盐的摄取增加,导致营养盐浓度减小。限制条件下浮游植物磷摄取率(μUPPP)与μPRPC有相同的效应。μDEPC越大,浮游植物的死亡量越大,从而产生与μPRPC相反的效应。其它如光饱和强度(α)、叶绿素和水体消光系数(pla,bla)、浮游植物细胞内最大磷浓度(PPmax)等与μDEPC有相同的效应。
浮游植物生长过程受光、温度和营养盐的限制,死亡过程受营养盐限制。与光限制相关的参数中,α对于碳、磷循环非常灵敏,对于氮循环比较灵敏;bla对于碎屑和浮游植物分别为非常灵敏和灵敏(两者仅相差0.06且均约为1),对于除溶解氧外的其它状态变量比较灵敏;pla对于浮游生物和碎屑比较灵敏,对于其它状态变量不太灵敏;碎屑消光系数(dla)对于所有状态变量均不太灵敏性。光饱和强度的温度系数(βα)和浮游植物生长的温度系数(βPRPC)是浮游植物生长过程中与温度限制相关的两个参数,βα对于除溶解氧外的状态变量均比较灵敏,βPRPC对于浮游动物和碎屑比较灵敏,对于浮游植物和营养盐循环不太灵敏。与营养盐限制相关的参数中,浮游植物细胞内最大氮和磷浓度(PNmax,PPmax)对于碳循环比较灵敏或灵敏,对于氮循环比较灵敏,对于磷循环不太灵敏。PNmax和PPmax均对碳循环产生负向效应,均对磷循环产生正向效应,而对氮循环分别产生负向和正向效应;PPmax的影响程度略大于PNmax。根据绝对平均值可知,α是非常灵敏性参数,bla、βα、PNmax和PPmax是比较灵敏性参数,pla、dla和βPRPC是不太灵敏性参数。
浮游动物对浮游植物的牧食作用受浮游植物生物量、氧浓度和温度3个因素限制。0级和1级牧食率的浮游植物生物量系数(KPC0,KPC1)和氧依赖系数(KDO)对于碳循环比较灵敏,对于营养盐循环不太灵敏,KPC0对于叶绿素a比较灵敏,KPC1和KDO对于叶绿素a不太灵敏;浮游动物牧食的温度系数(βGRPC)对于各状态变量均不太灵敏。KPC0和KPC1的影响效应相反,且KPC0影响程度较大;KPC1和KDO的影响效应一致,影响程度类似。根据绝对平均值可知,KPC0是比较灵敏性参数,KPC1、KDO和βGRPC是不太灵敏性参数。
除牧食作用外,与浮游动物相关的参数中,浮游动物一级死亡率(μDEZC1)对于浮游动物非常灵敏,对于浮游植物、叶绿素a和碎屑比较灵敏,对于营养盐循环不太灵敏;浮游动物二级死亡率(μDEZC2)对于各状态变量均不太灵敏;浮游动物生长速率(μPRZC)对于碳循环比较灵敏,对于营养盐循环不太灵敏。μDEZC1和μPRZC的影响效应相反,μDEZC1对浮游动物的影响程度远大于μPRZC,对其它状态变量则略小。根据绝对平均值可知,μDEZC1和μPRZC是比较灵敏性参数,μDEZC2是不太灵敏性参数。
与叶绿素a相关的参数中,叶绿素a的最小和最大生产系数(KCHmin,KCHmax)对于浮游植物、叶绿素和碎屑比较灵敏,对于浮游动物和营养盐循环不太灵敏。根据绝对平均值判断,两者均为比较灵敏性参数,且影响效应一致、程度类似。
与碎屑相关的参数中,碎屑矿化率(μREDC)对于浮游植物和碎屑比较灵敏,对于其它状态变量不太灵敏,总体上是不太灵敏性参数。碎屑矿化作用在一定程度上影响碳循环,对营养盐循环影响不大。
与营养盐相关的参数中,除了PNmax和PPmax是比较灵敏性参数,缺氧条件下沉积物释放磷的比例(PREL)对于碳和磷循环比较灵敏,对于氮循环不太灵敏,限制条件下浮游植物磷摄取率(μUPPP)和浮游植物磷摄取的半饱和常数(hUPPP)对于浮游植物和磷循环比较灵敏,hUPPP对于碎屑均比较灵敏,对于其它状态变量均不太灵敏。μUPPP和hUPPP的影响效应相反。根据绝对平均值可知,PREL和hUPPP是比较灵敏性参数,μUPPP是不太灵敏性参数
3.2 参数灵敏度的聚类分析
对图2中17个参数的灵敏度进行聚类分析。结果表明,若将17个参数聚为4类,则分别为μPRPC和FAC、α、bla和μDEPC以及其它(图3)。根据本文参数灵敏度等级划分标准可知,μPRPC、FAC、α和μDEPC是灵敏性及以上参数,bla是比较灵敏性参数。聚类分析将bla和μDEPC聚为一类,说明浮游植物死亡过程和水体消光作用的扰动对模拟结果产生的影响具有一定的相似性;另一方面,bla的灵敏度绝对平均值(0.497)非常接近0.5。因此,根据聚类分析的结果将其划分为本文模型的灵敏性参数。
除了上述5个非常灵敏及灵敏性参数,对其它17个参数的灵敏度进行聚类分析。由结果可知,若将22个参数聚为4类,则分别为μDEZC1,PPmax,μGRPC、μPRZC、KPC1、KDO、pla、hUPPP和PNmax以及其它(图3)。由此可知,某些比较灵敏性参数和不太灵敏性参数可以聚为一类,说明这些参数对整体的灵敏性产生效应相似的影响。
4 结论与讨论
4.1 模型参数的灵敏性
通过上述分析可知,本文模型涉及的50个参数中,共有3个非常灵敏性参数、2个灵敏性参数、11个比较灵敏性参数和34个不太灵敏性参数。非常灵敏及灵敏性参数为μPRPC、FAC、α、μDEPC和bla,主要影响浮游植物生长和死亡过程。其中,生长过程占主导,光对生长过程的限制作用最明显,且水体消光对光限制作用影响最大。这5个参数通过显著地影响碳和营养盐循环,影响整个胶州湾生态系统,反映了浮游植物在生态系统中的基础性和重要性作用[14-18]。
比较灵敏性参数的影响主要表现在限制因素、浮游动物、叶绿素a和无机磷等方面,具体为:营养盐对浮游植物生长或死亡的限制(PNmax,PPmax)以及温度对光饱和量的限制(βα),浮游动物生长、牧食和死亡过程(μPRZC,μGRPC,μDEZC1)以及浮游植物生物量对牧食的限制(KPC0),叶绿素a的生产(KCHmin,KCHmax),缺氧条件下沉积物释放磷(PREL)以及浮游植物对磷的摄取(hUPPP)。这些参数对于各状态变量的灵敏性存在不同程度的差异,从而表征不同的特点。比如,对于与浮游动物相关的3个比较灵敏性参数μPRZC、μDEZC1和μGRPC,通过比较各状态变量对这3个参数的灵敏度大小可知:浮游动物死亡对其生物量影响最大;浮游动物生长对其生物量影响程度略大于牧食;牧食对浮游植物和碎屑的影响大于浮游动物生长和死亡过程;浮游动物生物量变化基本不影响营养盐循环。
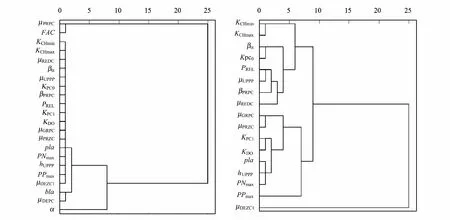
图3 参数灵敏度的聚类树形图Fig.3 The graph of cluster analysis to parameter sensitivities左图的聚类对象是至少对一个状态变量存在比较灵敏性及以上的22个参数,右图的聚类对象是在左图的基础上除去μPRPC、FAC、α、bla和μDEPC这5个参数后剩下的17个参数
不太灵敏性参数包括6个至少对一个状态变量比较灵敏但绝对平均值不太灵敏的参数(βPRPC,pla,KPC1,KDO,μREDC,μUPPP)以及28个对于各状态变量均不太灵敏的参数,与这些参数相关的过程主要为叶绿素a和碎屑消光作用,温度对浮游植物生长、浮游动物牧食、碎屑和沉积物矿化的限制,碎屑和沉积物矿化与沉降,与无机氮相关的大部分过程,溶解氧浓度变化等。这些过程除了受模型内部参数影响外,还在很大程度上受外部因素影响。胶州湾水深较浅[21-22],消光和沉降过程均依赖于水深,因此不占主导;海水温度作为模型外部作用力输入,是生态系统重要的环境因子,对生态系统影响较大且复杂,但温度系数仅对部分过程起调节作用,而对于整个生态系统影响不大;胶州湾入海污染排放量大[23-24],营养盐主要受陆源排污影响。
4.2 营养盐结构在参数灵敏度上的表征
沿岸污染物大量入海,导致氮磷营养盐过剩且结构失调,从而使浮游植物群落结构由硅藻占绝对优势演变为硅藻和甲藻共同占优势。胶州湾浮游植物处于磷限制,大型硅藻小型化,优势种单一化[24-25]。这一变化体现在模型上,除了浮游生物自身与营养盐相关的参数趋于甲藻的特征外,还表现在以下几个方面:
(1)诸如μPRPC和μDEPC等对于浮游植物生物量很灵敏的参数对于磷循环的灵敏度绝对值高于氮循环,说明浮游植物生物量变化引起的无机磷变化幅度大于无机氮。
(2)PREL对于碳和磷循环比较灵敏,说明缺氧条件下沉积物矿化作用对无机磷的补充在一定程度上促进了浮游植物的生长。上述两方面的影响效应,说明浮游植物生物量和无机磷浓度之间存在明显的正相关。
(3)PPmax对浮游植物的影响大于PNmax,由于两者对浮游植物死亡的限制作用相同,说明PPmax对浮游植物生长的限制作用大于PNmax。
(4)除了限制浮游植物的生长与死亡,PNmax和PPmax还影响非限制条件下浮游植物对营养盐的摄取。PNmax对于氮循环比较灵敏,PPmax对于磷循环不太灵敏,说明胶州湾浮游植物氮摄取是非限制条件占主导,而磷摄取则是限制条件占主导。
(5)与限制条件下浮游植物营养盐摄取相关的参数中,μUPPP和hUPPP对于浮游植物和磷循环比较灵敏,进一步说明胶州湾处于磷限制[14,24]。
4.3 优化参数的选取
将参数按照对于不同状态变量的灵敏度绝对值从高到低排序(表1),结果可知,每个状态变量的前5位参数基本上都包括对浮游植物有主要影响作用的4个参数,即μPRPC、α、μDEPC和bla,且浮游植物的前5位参数与绝对平均值相同,说明浮游植物是本文模型最基本的状态变量,对其主要影响参数的优化是模型校正的首要工作。浮游植物排在第5位的参数为PPmax,说明浮游植物生长过程的限制因素除光照外,无机磷限制作用较大。
其它状态变量除了主要由浮游植物决定外,也受其它因素影响。叶绿素a受最大生产系数的影响较大,可通过优化KCHmax正向校正。浮游动物受自身生长和死亡过程影响较大,可通过优化μPRZC正向校正或通过优化μDEZC1负向校正,而μDEZC1对浮游动物的影响程度远大于其它状态变量(图2),因此建议优化μDEZC1负向校正。无机磷受限制条件下浮游植物磷摄取影响较大,可通过优化hUPPP正向校正。本文模拟得到的胶州湾生态系统溶解氧平衡相对稳定,溶解氧浓度不太受参数变化影响,虽然可通过优化KDO进行微小的负向校正,但会较大程度地影响其它状态变量,因此不建议校正。碎屑和无机氮在生态系统内部主要受浮游植物影响。此外,碎屑可通过优化μREDC负向校正。无机氮受陆源排污影响大,对无机氮的校正主要通过合理设置沿岸河流径流量或陆源污染物浓度与比例以及无机氮初始场。
根据上述讨论与分析,本文建议进行优化的参数为μPRPC、FAC、α、μDEPC、bla、PPmax、KCHmax、μDEZC1、hUPPP和μREDC,且前5个参数应优先优化。
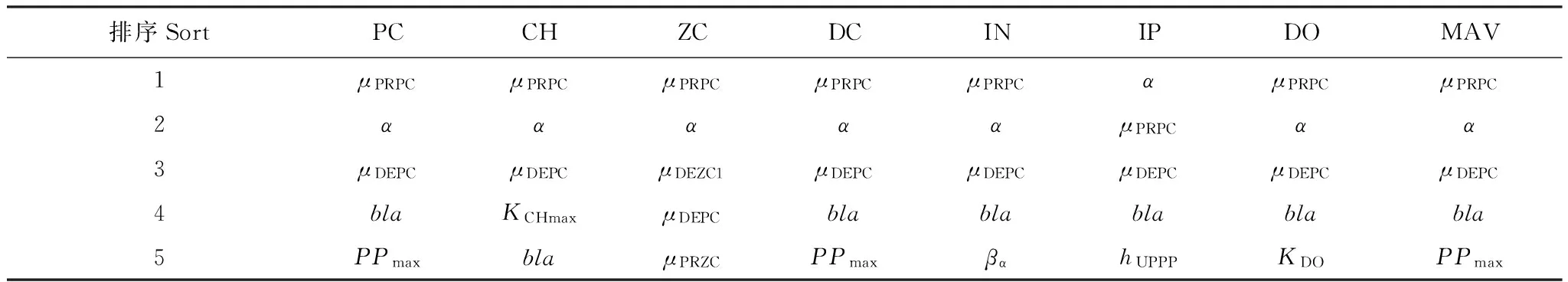
表1 各状态变量对应的参数灵敏度从高到低排序Table 1 The sequence of parameters in order of the parameter sensitivities of each state variables from high to low
4.4 局部灵敏度分析的局限性
本文采用的的参数灵敏度分析只检验单个参数变化对模拟结果的影响程度,属于局部灵敏度分析[14,20]。局部灵敏度分析方法思路简单,可操作性强,应用比较广泛,但存在一定的局限性[12-13]。
(1)海洋生态模型中的参数取值有一定的范围,对式(1)中的Δxj人为地取固定值可能会造成部分参数超过取值范围而不符合生态学意义。
(2)参数取不同的变化量会影响其本身的灵敏度大小,且对不同状态变量的影响不同。以μPRPC为例,将其参数变化率分别取为-10%,10%,20%和50%,计算各状态变量对μPRPC的灵敏度(图4)。结果表明,不同状态变量对μPRPC的灵敏度绝对值大体上随着变化率的增加有不同程度的增加。浮游植物的增长最显著(从3.1增长到10.1),其次为叶绿素a和碎屑,无机氮变化不太显著。
(3)模型中各参数之间可能存在非线性关系,而局部灵敏度分析只考虑单个参数变化的影响,因而没有检验参数之间的相互作用对结果的影响。与μPRPC类似,将α变化率取不同的值,得到各状态变量对α的灵敏度(图4)。由结果可知,随着参数变化率的增加,不同状态变量对α的灵敏度的变化趋势大体上与μPRPC一致,浮游植物对α的灵敏度绝对值随着变化率的增加从1.5增长到了4.9。上述分析说明了α和μPRPC存在非常显著的非线性关系,而本文的参数灵敏度分析结果只说明了两者均为非常灵敏性参数,并没有表征两者的相互作用对模型的影响程度。同时,由参数灵敏度的聚类分析结果可知(图3),比较灵敏性参数和不太灵敏性参数虽然在灵敏性上有显著不同,但某些参数可以聚为一类,说明不同灵敏性的参数之间也具有相互作用关系。由于各参数之间可能存在相关性,因此对单个参数分析时,其它参数的取值会影响其灵敏度大小。上述分析表明,局部灵敏度分析对参数初始值的选取有较高的要求,会对参数灵敏度结果产生不可预测的影响。
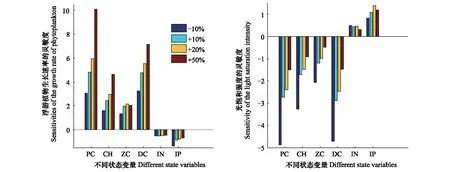
图4 各状态变量对μPRPC和α在不同变化率下的灵敏度Fig.4 The sensitivity of each state variable on μPRPC and α under different change rates of parameters
考虑到上述局限性,全局灵敏度分析同时检验多个参数变化对模拟结果的影响,且采用随机抽样的方法确定各参数变化量,使得各参数可以在各自定义域内同时变化[12-13,16-17]。虽然由此带来的计算代价较高,但能从全局上考虑模型各参数及其相互作用对结果的影响。本文后续研究将对模型进行全局灵敏度分析,并通过与本文结果比较,进一步认清模型行为,确定需要进行优化的参数,并据此进行参数优化和模型校正的研究。
[1] Shi H H,Ding D W,Zheng W.Key Technology and Its Application of Evaluation,Simulation and Regulation of Coastal Zone Complex Ecosystem.Beijing:Ocean Press,2012:3-14,224-248.
[2] Gao H W,Feng S Z,Guan Y P.Progress in marine planktonic ecosystem modeling.Oceanologia et Limnologia Sinica,2000,31(3):341-348.
[3] Ren X X,Li H,Wu H D.A review of marine ecosystem dynamics model.Marine Forecasts,2012,29(1):65-72.
[4] Riley G A,Stommel H,Bumpus D F.Quantitative ecology of the plankton of the Western North Atlantic // Bulletin Bingham Oceanographic Collection.New Haven:Peabody Museum of Natural History,1949,12:1-169.
[5] Moll A.Regional distribution of primary production in the North Sea simulated by a three-dimensional model.Journal of Marine Systems,1998,16(1/2):151-170.
[6] Cui M C,Wang R,Hu D X,Yuan Y C.Simple ecosystem model of the central part of the East China Sea in Spring.Chinese Journal of Oceanology and Limnology,1997,15(1):80-87.
[7] Wu Z M,Yu G Y,Zhang Z N,Lu X K,Gao S H,Zhang X L.A pelagic ecosystem model and simulation of the northern part of Jiaozhou Bay Ⅱ.A simulation study on the pelagic ecosystem seasonal variations.Journal of Ocean University of Qingdao,1999,29(3):429-435.
[8] Castellani M,Rosland R,Urtizberea A,Fiksen Ø.A mass-balanced pelagic ecosystem model with size-structured behaviourally adaptive zooplankton and fish.Ecological Modelling,2013,251:54-63.
[9] van der Molen J,Aldridge J N,Coughlan C,Parker E R,Stephens D,Ruardij P.Modelling marine ecosystem response to climate change and trawling in the North Sea.Biogeochemistry,2013,113(1/3):213-236.
[10] Shi J,Wei H,Zhao L,Fang J G,Zhang J H.Study on ecosystem model for multi-species culture in Sanggou Bay Ⅰ.Establishment of the culture ecosystem model and sensitivity analyses of the parameters.Marine Fisheries Research,2010,31(4):26-35.
[11] Dowling N A,Wilcox C,Mangel M,Pascoe S.Assessing opportunity and relocation costs of marine protected areas using a behavioural model of longline fleet dynamics.Fish and Fisheries,2012,13(2):139-157.
[12] Saltelli A.What is sensitivity analysis // Saltelli A,Chan K,Scott E M,eds.Sensitivity Analysis.Chichester,England:John Wiley and Sons,2000:3-12.
[13] Xu C G,Hu Y M,Chang Y,Jang Y,Li X Z,Bu R C,He H S.Sensitivity analysis in ecological modeling.Chinese Journal of Applied Ecology,2004,15(6):1056-1062.
[14] Wang Z Y.Modeling and Analysis of the Change of Plankton Ecosystem in Jiaozhou Bay for 40 Years [D].Qingdao:Ocean University of China,2007.
[15] Gao H W,Sun W X,Qu X M.Sensitive analysis of the parameters of a pelagic ecosystem dynamic model.Journal of Ocean University of Qingdao,1999,29(3):398-404.
[16] Zheng W,Shi H H,Fang G H,Hu L,Peng S T,Zhu M Y.Global sensitivity analysis of a marine ecosystem dynamic model of the Sanggou Bay.Ecological Modelling,2012,247:83-94.
[17] Zheng W,Shi H H,Song X K,Huang D R,Hu L.Simulation of phytoplankton biomass in Quanzhou Bay using a back propagation network model and sensitivity analysis for environmental variables.Chinese Journal of Oceanology and Limnology,2012,30(5):843-851.
[18] Gibson G A,Spitz Y H.Impacts of biological parameterization,initial conditions,and environmental forcing on parameter sensitivity and uncertainty in a marine ecosystem model for the Bering Sea.Journal of Marine Systems,2011,88(2):214-231.
[19] Chu-Agor M L,Muoz-Carpena R,Kiker G,Emanuelsson A,Linkov I.Exploring vulnerability of coastal habitats to sea level rise through global sensitivity and uncertainty analyses.Environmental Modelling & Software,2011,26(5):593-604.
[20] Solidoro C,Crise A,Crispi G,Pastres R.An a priori approach to assimilation of ecological data in martine ecosystem models.Journal of Marine System,2003,40-41:79-97.
[21] Wu S Y,Wang W H,Feng A P,Chi W Q.Human Activities in Bays of China and Its Environmental Effects.Beijing:Ocean Press,2011:95-95,101-102.
[22] Compilation Committee of China Bay Records.China Bay Records (the 1st to 14th Volume).Beijing:Ocean Press,1991-1999.
[23] Li L,Liang S K,Shi X Y,Wang X L.Contaminative conditions analysis of main rivers flowing into Jiaozhou Bay in 2007.Environmental Science and Management,2009,34(6):23-28.
[24] Shen Z L.Long-term changes in nutrient structure and its influences on ecology and environment in Jiaozhou Bay.Oceanologia et Limnologia Sinica,2002,33(3):322-331.
[25] Liu D Y,Sun J,Qian S B.Study on the phytoplankton in Jiaozhou Bay Ⅱ.Influence of the environmental factors to phytoplankton community.Journal of Ocean University of Qingdao,2002,32(3):415-421.
参考文献:
[1] 石洪华,丁德文,郑伟.海岸带复合生态系统评价、模拟与调控关键技术及其应用.北京:海洋出版社,2012:3-14,224-248.
[2] 高会旺,冯士筰,管玉平.海洋浮游生态系统动力学模式的研究.海洋与湖沼,2000,31(3):341-348.
[3] 任湘湘,李海,吴辉碇.海洋生态系统动力学模型研究进展.海洋预报,2012,29(1):65-72.
[7] 吴增茂,俞光耀,张志南,陆贤昆,高山红,张新玲.胶州湾北部水层生态动力学模型与模拟Ⅱ.胶州湾北部水层生态动力学的模拟研究.青岛海洋大学学报,1999,29(3):429-435.
[10] 史洁,魏皓,赵亮,方建光,张继红.桑沟湾多元养殖生态模型研究:Ⅰ 养殖生态模型的建立和参数敏感性分析.渔业科学进展,2010,31(4):26-35.
[13] 徐崇刚,胡远满,常禹,姜艳,李秀珍,布仁仓,贺红士.生态模型的灵敏度分析.应用生态学报,2004,15(6):1056-1062.
[14] 王震勇.胶州湾浮游生态系统四十年变化的模拟与分析 [D].青岛:中国海洋大学,2007.
[15] 高会旺,孙文心,瞿雪梅.水层生态系统动力学模式参数的敏感性分析.青岛海洋大学学报,1999,29(3):398-404.
[21] 吴桑云,王文海,丰爱平,迟万青.我国海湾开发活动及其环境效应.北京:海洋出版社,2011:95-95,101-102.
[22] 中国海湾志编纂委员会.中国海湾志(第一至第十四分册).北京:海洋出版社,1991-1999.
[23] 李莉,梁生康,石晓勇,王修林.2007年环胶州湾入海河流污染状况和污染物入海通量分析.环境科学与管理,2009,34(6):23-28.
[24] 沈志良.胶州湾营养盐结构的长期变化及其对生态环境的影响.海洋与湖沼,2002,33(3):322-331.
[25] 刘东艳,孙军,钱树本.胶州湾浮游植物研究Ⅱ.环境因子对浮游植物群落结构变化的影响.青岛海洋大学学报,2002,32(3):415-421.
Parameter sensitivity analysis of a coupled biological-physical model in Jiaozhou Bay
SHI Honghua1,*,SHEN Chengcheng1,2,LI Fen3,WANG Yongzhi1
1TheFirstInstituteofOceanography,StateOceanicAdministration,Qingdao266061,China2CollegeofEnvironmentalScienceandEngineering,OceanUniversityofChina,Qingdao266100,China3MathematicsandScienceSchool,OceanUniversityofChina,Qingdao266100,China
The marine ecological models have been widely applied.The key factor limiting application of ecological models is the uncertainty of these models,primarily due to the uncertainty of the parameters used.The purpose for sensitivity analysis of parameters for ecological models was to assess influential degrees of various parameters on simulating outcomes with a particular model,which are the essential procedures for parameter optimization and model calibration and the important tools for understanding the behaviors of the model.In this study,we conducted sensitivity analysis on 50 parameters for five state variables i.e.phytoplankton,zooplankton,nutrient,detritus and dissolved oxygen included in the coupled biological-physical model for Jiaozhou Bay.We found that among 50 parameters,three were highly sensitive,two were sensitive,11 were moderately sensitive and 34 were less sensitive.The highly sensitive and sensitive parameters included phytoplankton growth rate (μPRPC),factors for dark reaction correction (FAC),light saturation intensity (α),phytoplankton death rate (μDEPC) and light extinction coefficient of water (bla).They have major impacts on plant growth and death,reflecting the essentialness and importance of phytoplankton in ecosystem.The plant growth process has the most important impacts on the stimulating results.The key factor limiting plant growth is light whereas light extinction of water is the most important factor limiting light intensity.These five parameters have significant impacts on carbon and nutrient cycles,and are the most important parameters in Jiaozhou Bay ecosystem.Thus,they should be optimized with the first priority.The impacts of moderately sensitive parameters are mediated mainly via the influence of nutrient on phytoplankton growth and death,temperature influence on light saturation intensity and the influence on zooplankton growth,grazing and death as well as the impacts of phytoplankton biomass on grazing,chlorophyll a generation,phosphorus release from disposed substances under hypoxia condition and phosphorus absorption by plants.There are different degrees of variations in sensitivity of the state variables and thus,they have different characteristics.The less sensitive parameters-related processes are mainly light extinction of chlorophyll a and detritus,temperature limitation to zooplankton growth,zooplankton grazing,and mineralization of detritus and sediment,mineralization/deposition of detritus and sediment,the inorganic nitrogen-related processes and changes in dissolved oxygen concentration.These processes are influenced not only by model′s internal parameters but also by external factors such as water depth,sea water temperature and pollutions from land-based sources.Moderately and less sensitive parameters affect model′s local processes,and thus are the important basis for model calibration.Additionally,four state variables i.e.chlorophyll a,zooplankton,detritus and inorganic phosphorus,are calibrated according to the maximal production constant of chlorophyll a (KCHmax),first-order zooplankton death rate (μDEZC1),mineralization rate of organic detritus (μREDC) and half-saturation constant of phosphorus absorption by zooplankton (hUPPP).The sensitivity analysis of nutrient-related parameters has shown that phytoplankton in Jiaozhou Bay is limited by phosphorus and however inorganic nitrogen is principally effected by pollutions from land-based sources.Dissolved oxygen is less sensitive on each parameter.
Jiaozhou Bay; coupled biological-physical model; parameter sensitivity analysis
国家自然科学基金资助项目(41206111,41206112);海洋公益性行业科研专项经费资助项目(201005009); 国家海洋局第一海洋研究所中央级科研院所基本科研业务经费资助项目(2013G30,2013G27)
2013-04-28;
2013-10-29
*通讯作者Corresponding author.E-mail:shihonghua@fio.org.cn
10.5846/stxb201304280854
石洪华,沈程程,李芬,王勇智.胶州湾生物-物理耦合模型参数灵敏度分析.生态学报,2014,34(1):41-49.
Shi H H,Shen C C,Li F,Wang Y Z.Parameter sensitivity analysis of a coupled biological-physical model in Jiaozhou Bay.Acta Ecologica Sinica,2014,34(1):41-49.

