香加皮杠柳苷对人肺癌QG56细胞抑制作用的研究*
张 静 杨 光 赵学涛 单保恩 刘江惠
细胞与分子生物学
香加皮杠柳苷对人肺癌QG56细胞抑制作用的研究*
张 静1杨 光2赵学涛3单保恩3刘江惠3
目的研究香加皮杠柳苷(CPP)对人肺癌QG56细胞的抑制作用及其作用机制。方法体外培养人肺癌QG56细胞,设对照组和终浓度为1.25、2.50、5.00、10.00、20.00 μg/L的CPP(CPP 1~5)组,每组设3个平行孔,分别培养24、48、72 h。采用MTT法检测CPP对QG56细胞增殖的影响;倒置显微镜观察CPP处理前后细胞形态变化;流式细胞术检测细胞凋亡和周期分布;RT-PCR法检测CPP作用后QG56细胞中凋亡相关基因bax mRNA表达情况;免疫细胞化学法检测CPP对QG56细胞bax蛋白表达的影响。结果随CPP浓度的增加、作用时间的延长,细胞增殖抑制率明显增高。显微镜下可见CPP处理后的QG56细胞变圆,皱缩,呈悬浮状态。随CPP浓度的增加,G0/G1期细胞比例增高,而S期和G2/M期细胞比例减少,QG56细胞凋亡率明显增高。CPP 2组经CPP作用48 h后,细胞凋亡率高于对照组,CPP 3组经CPP作用24 h后,细胞凋亡率均高于对照组,CPP 4组经CPP作用12 h后,细胞凋亡率均高于对照组(均P<0.05)。CPP 2~4组经CPP作用48 h时QG56细胞中bax mRNA和蛋白的表达明显增强。结论CPP可通过阻滞细胞周期和诱导凋亡发挥对人肺癌QG56细胞的抑制作用。
肺肿瘤;香加皮;杠柳;细胞增殖;细胞周期;细胞凋亡;原癌基因蛋白质c-bcl-2;香加皮杠柳苷;bax
肺癌是常见恶性肿瘤,其发病率和死亡率均居我国恶性肿瘤的第一位[1]。鳞癌是肺癌中最常见的病理类型,占原发性肺癌的40%~50%。然而,目前尚缺乏针对肺鳞癌的靶向药物,临床现有的化疗药物总体疗效也并不理想,且不良反应较大。本课题组前期研究发现,中药香加皮的提取物具有明显的抗肿瘤作用[2],香加皮杠柳苷(periplocin from cortex periplocae,CPP)是从香加皮中分离提取的单体化合物[3]。本研究在前期工作的基础上,进一步探索CPP对人肺癌QG56细胞增殖的影响及机制,以期发现对肺鳞癌有效的药物。
1 材料与方法
1.1 材料 CPP分离纯化自中药香加皮,由华北制药集团新药研究开发中心提供。人肺癌QG56细胞株由日本产业医科大学馈赠。RPMI1640培养基、RT-PCR酶混合物、Trizol液(美国GIBCO公司);噻唑蓝(MTT)、碘化丙啶(PI,美国Sigma公司);bax及β-actin引物(上海生物工程公司);兔抗人bax多克隆抗体(美国Santa Cruz公司);SP试剂盒、DAB显色试剂盒(北京中山生物技术公司)。PCR仪(美国ABI公司),Epics-XLⅡ流式细胞仪(FCM,美国Beckman Coulter公司)。
1.2 方法
1.2.1 细胞培养 将人肺癌QG56细胞按常规方法复苏后,置于含10%胎牛血清(FBS)的RPMI1640完全培养基中,37℃、5%CO2培养箱中培养,每2~3 d用0.25%胰酶消化传代。取对数生长期的细胞备用。
1.2.2 MTT法测定细胞增殖活性 调整QG56细胞悬液细胞浓度为1×105个/mL,接种于96孔板中,每孔100 μL。设对照组和终质量浓度为1.25、2.50、5.00、10.00、20.00 μg/L的CPP(CPP 1~5)组,每组设3个平行孔,分别培养24、48、72 h。终止实验时每孔加入5 g/L的MTT 10 μL,4 h后弃去上清,每孔加入150 μL DMSO,震荡5 min。酶标仪内于波长570 nm测定光密度(OD)值,计算细胞增殖抑制率(inhibitory rate,IR)=(1-CPP组平均OD值/对照组平均OD值)×100%。
1.2.3 倒置显微镜下观察细胞形态 应用倒置显微镜观察CPP处理前后QG56细胞的形态学变化。
1.2.4 流式细胞仪检测细胞周期和细胞凋亡 取对照组和CPP 2、CPP 3、CPP 4组QG56细胞,培养6、12、24、48、72 h,分别收集细胞1×106个,以70%乙醇固定过夜,PBS离心洗去乙醇,加入PI染色,应用FCM分析细胞周期和细胞凋亡率。
1.2.5 RT-PCR检测bax mRNA表达 取对照组和CPP 2、CPP 3、CPP 4组QG56细胞培养48 h,用Trizol提取液提取各组细胞总RNA,并检测RNA的纯度和完整性。以β-actin为内参照,每批PCR均设空白对照。引物序列为bax上游5′-GTTTCATCCAGGATCGAGC-3′,下 游 5′-GGAAGTCCAATGTCCAGC-3′,扩增片段大小为 345 bp;β-actin 上游 5′-CGCTGCGCTGGTCGTCGACA-3′,下 游 5′-GTCACGCACGATTTCCCGCT-3′,扩增片段大小为619 bp[4-5]。按RT-PCR酶混合物试剂盒说明进行实验,反应30个循环。将RT-PCR产物行琼脂糖凝胶电泳,应用FOTODYNE凝胶成像系统成像分析。
1.2.6 免疫细胞化学法测定bax蛋白的表达 取对照组和CPP 2、CPP 3、CPP 4组QG56细胞接种于6孔板中爬片培养,48 h后弃去培养基,PBS洗涤,按SP免疫细胞化学法和试剂盒说明书进行染色、固定,镜下观察。
1.3 统计学方法 采用SPSS 13.0软件进行统计分析,计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 CPP对QG56细胞增殖的影响 随着CPP浓度的增加、作用时间的延长,OD值明显降低(均P<0.05),IR明显增高,见表1。
2.2 CPP作用后细胞形态学变化 对照组QG56细胞呈单层贴壁生长,为多边形;经CPP作用后,细胞脱离生长面,皱缩变圆,折光减弱,见图1。
2.3 CPP对QG56细胞周期的影响 经不同质量浓度(2.50、5.00、10.00 μg/L)CPP 作用 24 h后,各组QG56细胞周期变化明显。随着CPP质量浓度的增加,G0/G1期细胞比例增高,而S期和G2/M期细胞比例减少,见图2、表2。
2.4 CPP对QG56细胞凋亡的影响 随着CPP浓度的增加、作用时间的延长,QG56细胞凋亡率明显增高。CPP 2组经CPP作用48 h,细胞凋亡率均高于对照组,CPP 3组经CPP作用24 h后,细胞凋亡率高于对照组,CPP 4组经CPP作用12 h后,细胞凋亡率高于对照组(均P<0.05),见图3。
2.5 CPP对QG56细胞bax基因表达的影响 CPP 2~4组经CPP作用48 h时QG56细胞中bax mRNA的表达明显增强,空白对照组无任何条带,见图4。
Table 1 The effect of CPP on the proliferation of QG56 cells表1 CPP对QG56细胞增殖的影响 (n=3±s)
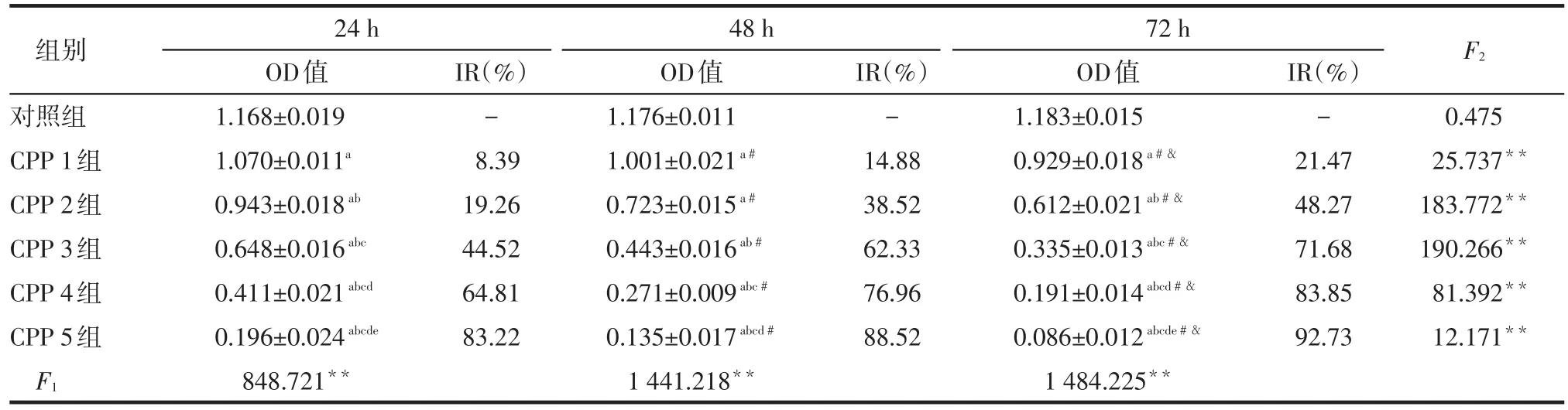
Table 1 The effect of CPP on the proliferation of QG56 cells表1 CPP对QG56细胞增殖的影响 (n=3±s)
F1:同一时点组间OD值比较;F2:组内不同时点OD值比较;**P<0.01;a与对照组比较,b与CPP1组比较,c与CPP2组比较,d与CPP3组比较,e与CPP4组比较,P<0.05;#与24 h时比较,&与48 h时比较,P<0.05
F2组别对照组CPP 1组CPP 2组CPP 3组CPP 4组CPP 5组IR(%)-8.39 19.26 44.52 64.81 83.22 IR(%)-14.88 38.52 62.33 76.96 88.52 IR(%)-21.47 48.27 71.68 83.85 92.73 0.475 25.737**183.772**190.266**81.392**12.171**F1 24 h OD值1.168±0.019 1.070±0.011a0.943±0.018ab0.648±0.016abc0.411±0.021abcd0.196±0.024abcde848.721**48 h OD值1.176±0.011 1.001±0.021a#0.723±0.015a#0.443±0.016ab#0.271±0.009abc#0.135±0.017abcd#1 441.218**72 h OD值1.183±0.015 0.929±0.018a#&0.612±0.021ab#&0.335±0.013abc#&0.191±0.014abcd#&0.086±0.012abcde#&1 484.225**
Table 2 Comparison of the QG56 cell cycle distributions after treatment with CPP for 24 h表2 CPP作用24 h后QG56细胞周期分布的比较 (n=3,%,±s)
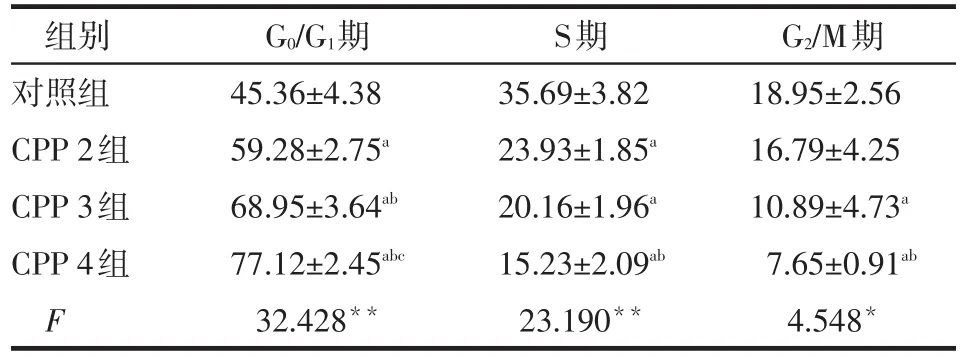
Table 2 Comparison of the QG56 cell cycle distributions after treatment with CPP for 24 h表2 CPP作用24 h后QG56细胞周期分布的比较 (n=3,%,±s)
*P<0.05,**P<0.01;a与对照组比较,b与CPP 2组比较,c与CPP 3组比较,P<0.05
组别对照组CPP 2组CPP 3组CPP 4组F G0/G1期45.36±4.38 59.28±2.75a68.95±3.64ab77.12±2.45abc32.428**S期35.69±3.82 23.93±1.85a20.16±1.96a15.23±2.09ab23.190**G2/M期18.95±2.56 16.79±4.25 10.89±4.73a7.65±0.91ab4.548*
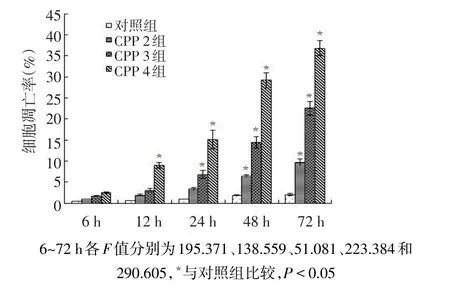
Figure 3 Effects of CPP on the apoptotic rate of QG56 cells图3 CPP对QG56细胞凋亡率的影响
2.6 CPP对QG56细胞bax蛋白表达的影响 bax蛋白主要分布在胞浆和核膜周围,胞质中呈棕黄色或棕褐色颗粒着色者为阳性细胞。与对照组相比,CPP药物组QG56细胞中的阳性细胞明显增多,bax蛋白表达显著增强,见图5。
3 讨论
本课题组前期研究表明香加皮乙酸乙酯提取物对人乳腺癌MCF-7细胞具有增殖抑制活性[2]。CPP是在香加皮粗提物的基础上进一步分离纯化得到的单体。本研究结果显示CPP能显著抑制QG56细胞的增殖,且随药物浓度增加和作用时间延长,其抑制活性增强,提示CPP具有体外抗肿瘤作用。肿瘤的发生、发展与细胞周期和细胞凋亡密切相关[6-7]。阻滞细胞周期和诱导细胞凋亡是抗肿瘤药物的重要作用机制[8-9]。本研究结果显示,CPP组QG56细胞中G0/G1期细胞显著增多,S期和G2/M期细胞明显减少,提示CPP可使QG56细胞发生细胞周期阻滞,将细胞阻滞于G0/G1期。另外,CPP组QG56细胞的凋亡率明显升高,提示CPP可诱导肿瘤细胞凋亡。本研究结果与课题组前期有关香加皮抑制乳腺癌细胞的作用机制一致[2],再次验证CPP抗肿瘤作用与阻滞细胞周期和诱导细胞凋亡有关。
bax是研究最广泛的bcl-2家族中的促凋亡基因,其翻译产物可与bcl-2等抑凋亡蛋白,通过细胞线粒体途径,调节细胞凋亡[10]。本研究结果显示,CPP可使QG56细胞中bax基因的mRNA和蛋白表达水平显著增强,进一步提示CPP对人肺癌QG56细胞的抑制作用与诱导细胞凋亡有关,并可能通过上调bax基因的表达而发挥诱导凋亡作用。但本研究仅在分子水平对CPP的作用进行了初步探讨,具体的分子机制和作用途径,以及是否有bcl-2家族中其他成员或信号转导通路的多个靶点参与,有待进一步的深入研究。

Figure 1 The morphological changes of QG56 cells after CPP treatment(×200)图1 CPP作用后QG56细胞形态学变化(×200)
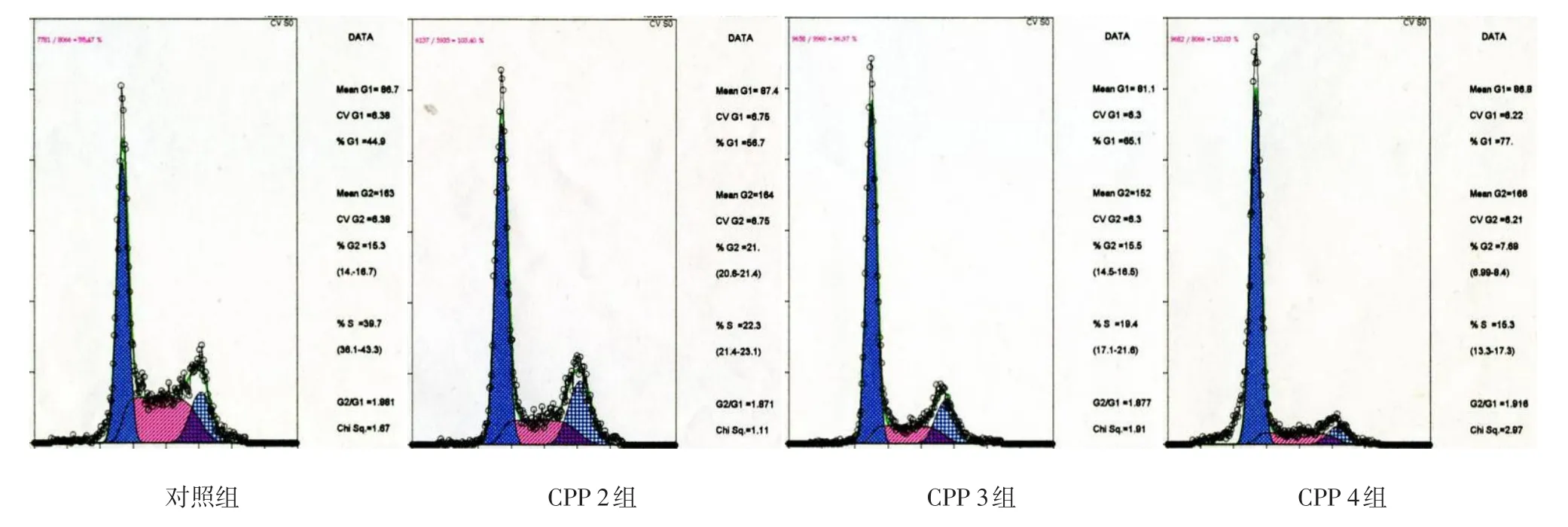
Figure 2 The QG56 cell cycle distributions detected by flow cytometry图2 FCM分析细胞周期时相分布
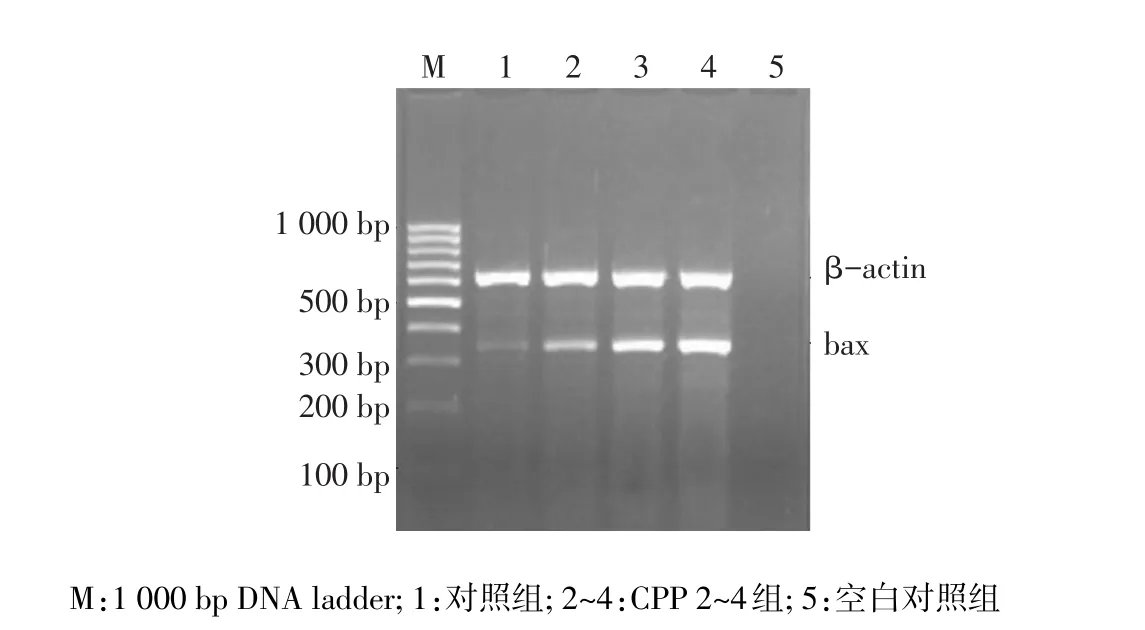
Figure 4 Effects of CPP on the expression of bax mRNA图4 CPP对bax mRNA表达的影响

Figure 5 The effect of CPP on the expression of bax in QG56 cells(SP,×400)图5 CPP对QG56细胞中bax蛋白表达的影响(SP,×400)
[1]郝捷.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:12.
[2]张静,单保恩,刘刚叁,等.香加皮乙酸乙酯提取物诱导人乳腺癌MCF-7细胞凋亡的研究[J].肿瘤,2006,26(5):418-421.
[3] 陈书红,杨峻山,任风芝,等.香加皮的抗肿瘤活性成分研究(Ⅱ)[J].中草药,2006,37(4):519-520.
[4]Lee Y,Kim H,Lee J,et al.Anticancer activity of S-allylmercapto-L-cysteine on implanted tumor of human gastric cancer cell[J].Biol Pharm Bull,2011,34(5):677-681.
[5]Schmidt GW,Delaney SK.Stable internal reference genes for normalization of real-time RT-PCR in tobacco(Nicotiana tabacum)during development and abiotic stress[J].Mol Genet Genomics,2010,283(3):233-241.
[6] Casimiro MC,Crosariol M,Loro E,et al.Cyclins and cell cycle control in cancer and disease[J].Genes Cancer,2012,3(11-12):649-657.
[7]Sayers TJ.Targeting the extrinsic apoptosis signaling pathway for cancer therapy[J].Cancer Immunol Immunother,2011,60(8):1173-1180.
[8] Alabsi AM,Ali R,Ali AM,et al.Apoptosis induction,cell cycle arrest and in vitro anticancer activity of gonothalamin in a cancer cell lines[J].Asian Pac J Cancer Prev,2012,13(10):5131-5136.
[9]王巨存,胡永成,潘振华,等.小檗胺对大鼠骨肉瘤UMR-106细胞增殖的抑制作用[J].天津医药,2012,40(10):1030-1033.
[10]Renault TT,Manon S.Bax:Addressed to kill[J].Biochimie,2011,93(9):1379-1391.
(2013-07-10收稿 2013-10-20修回)
(本文编辑 陈丽洁)
Inhibitory Effects of Periplocin from Cortex Periplocae on Human Lung Cancer Cell Line QG56
ZHANG Jing1,YANG Guang2,ZHAO Xuetao3,SHAN Baoen3,LIU Jianghui3
1 Department of Rehabilitation,The Fourth Hospital of Hebei Medical University,Shijiazhuang 050011,China;2 Department of Radiology,3 Research Center
ObjectiveTo investigate the inhibitory effects of periplocin from cortex periplocae(CPP)on human lung cancer cell line QG56 and to discuss its mechanism.MethodsQG56 cells were cultured in vitro.The final concentrations of CPP in control group were 1.25,2.50,5.00,10.00 and 20.00 μg/L.QG56 cells were treated with ascending concentration of CPP for 24 h,48 h and 72 h.The cell proliferation was measured using MTT method.The morphological changes of QG56 cells were observed under inverted microscope.Flow cytometry(FCM)was used to detect the effects of CPP on cell cycle and cell apoptosis.The expression of apoptosis associated gene bax mRNA in QG56 cells was detected by RT-PCR.The expression of bax protein before and after treatment of CPP was examined by SP immunocytochemistry.ResultsThe inhibitory effect of CPP on the proliferation of QG56 cells was increased with the increasing concentrations of CPP and the prolonged duration of treatment.The morphological changes were displayed in QG56 exposed to CPP.The results of FCM showed that CPP caused cell cycle arrest at G0/G1phase.The apoptotic rate of QG56 cells was significantly increased after CPP treatment for 48 h(P<0.05).The expression of bax mRNA was increased in QG56 exposed to CPP.The result of immunocytochemistry indicated that CPP up-regulated the expression of bax protein.ConclusionCPP showed significant inhibitory effect on human lung cancer cell lines QG56 through inducing cell cycle arrest and apoptosis.
lung neoplasms;Cortex Periplocae;Periploca Sepium;cell proliferation;cell cycle;apoptosis;proto-oncogene proteins c-bcl-2;periplocin from cortex periplocae;bax
R734.2 【
】 A 【DOI】 10.3969/j.issn.0253-9896.2014.03.002
*国家自然科学基金资助项目(项目编号:30772752)
1河北医科大学第四医院康复科(邮编050011),2放射科,3科研中心

