人结肠癌细胞系SP细胞microRNA表达谱的初步分析*
夏忠胜, 钟 娃, 于 涛, 练国达, 周慧敏, 陈广成
(中山大学孙逸仙纪念医院消化内科,广东 广州 510120)
结肠癌是西方国家最常见的胃肠道恶性肿瘤,是导致肿瘤患者死亡的第二常见原因。在过去的20年,结肠癌的发病率在中国一直不断增长。结肠癌、肺癌及乳腺癌成为近20年中国增长最快的3种恶性肿瘤。因此,结肠癌已成为越来越严重的社会健康问题。大多数结肠癌患者诊断时已是中晚期,因此,单纯靠外科手术不能完全治愈这些患者,必须同时辅以化疗或放疗等治疗方法。因此,化疗在中晚期结肠癌患者治疗中仍具有非常重要的作用。但迄今为止,大多数结肠癌患者对化疗药物反应有限,即使是最佳的联合化疗方案,也只有不到50%的结肠癌患者有效。而且,在这些不到50%有效的结肠癌患者中,化疗缓解后停药一段时间又会复发[1]。导致这些现象的根本原因就在于结肠癌细胞获得了多药耐药性(multidrug resistance, MDR)。
导致肿瘤细胞耐药的传统经典机制包括肿瘤细胞表达P-糖蛋白(P-glycoprotein, P-gp)、多药耐药相关蛋白(multidrug resistance-associated protein, MRP)或肺癌耐药蛋白(lung cancer resistance protein, LRP)等膜蛋白[2],这些跨膜蛋白能将化疗药物泵出细胞外,从而使肿瘤细胞内化疗药物浓度降低,导致肿瘤细胞对化疗药物产生抵抗。针对这些蛋白的MDR逆转剂,包括钙拮抗剂、反义核酸、小干扰RNA[3]等,在体外实验中虽然能逆转肿瘤细胞的多药耐药性,但在体内特别是在人体,与化疗药联用并不能改善肿瘤患者的预后。
近年来肿瘤干细胞概念的出现为解释上述现象提供了一种新的思路。目前认为肿瘤干细胞在肿瘤产生多药耐药性过程中起到非常重要的作用。为了靶向杀灭肿瘤干细胞,人们一直在努力寻找肿瘤干细胞的特异标记。CD133、CD44 等曾被认为是包括结肠癌在内的肿瘤干细胞的特异标志[4],但有学者发现在某些肿瘤中,CD133阴性的肿瘤细胞亦具有肿瘤干细胞特性[5],因此CD133是否能作为肿瘤干细胞的特异标志物及肿瘤细胞多药耐药的靶点仍存有争议。
肿瘤细胞中的侧群(side population,SP)细胞现已被公认为具有肿瘤干细胞样特性,其具有自我更新及分化的特点,并对多种化疗药物耐药[6]。SP细胞通常会表达MDR1、BCRP1或ABCG2等膜蛋白。但同时也有研究指出, 在多种非SP 细胞中也有一定程度的BCRP1表达, 提示这些转运蛋白对SP 细胞的表型有作用, 但并不是特异的标志物[7]。Behbod等[8]曾探讨过乳腺癌SP细胞的基因标志,但目前尚未见有关探讨结肠癌SP细胞与非SP细胞在microRNA表达谱方面差异的报道。本文通过比较几种结肠癌细胞系中SP细胞与非SP细胞microRNA表达谱的差异,探讨结肠癌SP细胞的microRNA标志物,为结肠癌SP细胞的靶向治疗寻找新的特异靶点。
材 料 和 方 法
1 材料与试剂
RPMI-1640培养液、Hoechst 33342、MTT和二甲基亚砜(dimethyl sulfoxide,DMSO)均购自Sigma-Aldrich;胎牛血清及RNA提取试剂TRIzol购自Invitrogen;5-氟尿嘧啶(5-fluorouracil)购自上海旭东海普药业有限公司;草酸铂(oxaliplatin)购自Sanofi-Synthelabo;阿霉素(adriamycin)购自Pharmacia & Upjohn;miRNeasy Mini Kit 购自Qiagen;microRNA芯片采用Exiqon的miRCURY LNATMmicroRNA Array (v.18.0);逆转录试剂盒由上海康成生物技术公司提供;PCR扩增仪采用Applied Biosystems的GeneAmp® PCR System 9700;流式细胞仪为BD Biosciences产品。
2 细胞培养
结肠癌细胞系HCT-15、HT-29及LoVo均购自中国科学院上海细胞库。3种细胞株均采用含有10%胎牛血清的RPMI-1640培养液在5% CO2、37 ℃的培养箱培养。
3 主要方法
3.1SP细胞的分选 参照文献[9]的方法,并进行部分改良。培养的细胞用胰酶消化处理后再用PBS洗涤,然后用含5%的胎牛血清的RPMI-1640培养液于37 ℃重新混悬细胞。预孵育10 min后,采用5 mg/L Hoechst 33342染料标记细胞90 min(加或不加维拉帕米;维拉帕米是ATP结合转运蛋白的抑制剂,工作浓度为50 μmol/L)。采用1 mg/L碘化丙啶标记死亡细胞进行对比染色。接下来,每组细胞采用BD FACSAia II荧光激活细胞分选系统对1×106活细胞进行分析及分选。Hoechst 33342染料的激发波长为355 nm,其荧光强度采用双波长滤光镜(分别为450 nm的Hoechst蓝和635 nm的Hoechst红)检测。通过630/BP30滤光镜测量碘化丙啶标记从而将死亡细胞区分开来。
3.2IC50测定 细胞活力的测定采用MTT法,细胞接种于96孔板,每孔细胞数为1×104,生长24 h 后加入抗肿瘤药。用倍比稀释浓度的5-氟尿嘧啶(2~256 mg/L)、草酸铂(0.5~64 mg/L)及阿霉素(1~128 mg/L)分别处理结肠癌HCT-15、HT-29及LoVo细胞。细胞置于37 ℃、5%CO2培养箱内孵育72 h后每孔加30 μL 5 g/L MTT,37 ℃孵育4 h,弃培养液,加150 μL DMSO,室温振荡5 min,在Synergy HT酶联仪上以570 nm波长读取吸光度(A)。未经任何处理的对照组细胞活力设为100%,通过与对照组比较计算其它各组细胞活力。根据各细胞系不同浓度抗肿瘤药处理3 d 时的A值,计算各细胞系各抗肿瘤药3 d 的IC50。
3.3MicroRNA芯片分析 MicroRNA芯片分析由上海康成生物技术公司完成。(1)RNA的提取:总RNA的分离采用Invitrogen的TRIzol试剂和Qiagen的miRNeasy Mini Kit试剂盒,具体方法参照厂家的说明书进行,其中miRNeasy Mini Kit试剂盒能有效地恢复所有种类的RNA,包括miRNAs。RNA的定性及定量检测采用Nanodrop Technologies的ND-1000光谱仪。采用凝胶电泳检测RNA的完整性。(2)RNA标记和杂交:从样本分离得到RNA后,采用Exiqon的miRCURY LNATMmicroRNA Hy3/Hy5 Power Labeling Kit标记试剂盒进行miRNA的标记。RNeasy Mini Kit(Qiagen)浓缩标记样品, 然后应用miRCURY LNATMmicroRNA Array (v.18.0) (Exiqon)和Hybridization System (Nimblegen Systems Inc.)进行芯片杂交。 具体步骤按各试剂说明书进行。(3)数据分析:杂交后芯片用Axon GenePix 4000B Microarray Scanner (Axon)进行图像扫描, 所得数据使用GenePix Pro 6.0软件(Axon)分析。每个样本重复检测4次,各样本microRNA芯片分析的重复性检测采用相关性分析,计算相关系数R。通过原始值减去背景值来做修正, 并用中值做标准化,分别计算出每组2个样本中miRNA的标准值及比值,以比值差异大于或等于2为差异有显著性。
3.4MicroRNA表达的RT-PCR验证 实时荧光定量PCR检测目的miRNA表达量:根据microRNA芯片分析结果,挑选出在3种细胞系的SP细胞中表达均上调2倍以上的microRNA,包括miR-5000-3p、miR-5009-3p和miR-552,对这3种microRNA的表达上调进行RT-PCR验证。取0.8 μg总RNA, 应用miRNA Isolation Kit (Ambion)分离小于100 nt的小分子RNA, 然后应用MMLV reverse transcriptase (Epicentre)逆转录合成cDNA,逆转录引物分别为:5’-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAAT-TGCACTGGATACGACTCCAAG-3’(miR-5000-3p),5’-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCA-ATTGCACTGGATACGACTTTTGG-3’(miR-5009-3p),5’-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAAT-TGCACTGGATACGACTTGTCTA-3’(miR-552),5’-CGCTTCACGAATTTGCGTGTCAT-3’(U6),U6为内参照。再进行定量PCR检测,PCR扩增引物序列见表1。PCR条件:95 ℃ 15 s,60 ℃ 60 s,共40个循环。采用U6 RNA作为内标,进行归一化。样品目的基因的相对表达率(relative expression, RE)采用ΔΔCt方法计算,RE = 2ΔΔCt(Ct表示反应荧光强度显著大于背景值时的循环数,ΔCtsample=Ctsample-CtU6 sample,ΔCtcontrol=Ctcontrol-CtU6 control,ΔΔCt =ΔCtsample-ΔCtcontrol)。

表1 实时定量PCR使用引物列表
4 统计学处理
计量资料用均数±标准差(mean±SD)表示,2组之间均数的比较采用独立样本的t检验。采用SPSS 16.0统计软件包分析。以P<0.05为差异有统计学意义。
结 果
1 SP细胞的分选
采用Hoechst 33342标记结肠癌细胞,利用流式细胞术分选结肠癌SP细胞。图1显示,不同结肠癌细胞系都有一定比例的SP细胞,只是比例不同。HCT-15、HT-29及LoVo细胞中SP细胞的比例分别为16.75%、13.02%及9.52%;采用50 μmol/L维拉帕米处理后,HCT-15、HT-29及LoVo细胞中SP细胞的比例分别降至1.76%、0.58%及0.11%。
2 各抗肿瘤药对结肠癌SP细胞和非SP细胞的IC50
HCT-15、HT-29及LoVo细胞分选后的SP细胞及非SP细胞分别采用不同浓度的5-氟尿嘧啶、草酸铂及阿霉素处理3 d,然后测定各细胞的细胞活力。不同浓度的5-氟尿嘧啶处理HCT-15结肠癌细胞3 d 后,在同一浓度的5-氟尿嘧啶作用下,HCT-15结肠癌细胞中SP细胞的细胞活力均高于非SP细胞。从表2可见,5-氟尿嘧啶对HCT-15细胞中SP细胞的IC50较非SP细胞提高了近5倍。不同浓度的草酸铂处理HCT-15结肠癌细胞3 d后,在同一浓度的草酸铂作用下,HCT-15结肠癌细胞中SP细胞的细胞活力均高于非SP细胞,阿雷素对HCT-15细胞中SP细胞的IC50较非SP细胞提高了近4倍,见表2。不同浓度的阿霉素处理HCT-15细胞3 d 后,在同一浓度的阿霉素作用下,HCT-15结肠癌细胞中SP细胞的细胞活力均高于非SP细胞,阿霉素对HCT-15细胞中SP细胞的IC50较非SP细胞提高了近6倍,见表2。
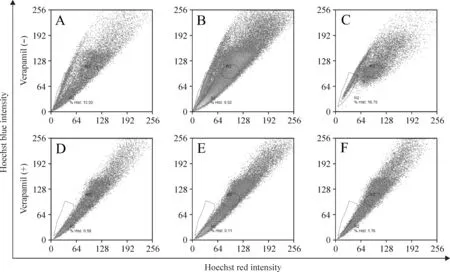
Figure 1. Side population analysis of 3 kinds of colon cancer cell lines. A: the ratio of SP cells in HT-29 cell line; B: the ratio of SP cells in LoVo cell line; C: the ratio of SP cells in HCT-15 cell line; D: the ratio of SP cells in HT-29 cell line treated with verapamil; E: the ratio of SP cells in LoVo cell line treated with verapamil; F: the ratio of SP cells in HCT-15 cell line treated with verapamil.
不同浓度的5-氟尿嘧啶处理HT-29结肠癌细胞3 d后,在同一浓度的5-氟尿嘧啶作用下,HT-29结肠癌细胞中SP细胞的细胞活力均高于非SP细胞。从表2可见,5-氟尿嘧啶对HT-29细胞中SP细胞的IC50较非SP细胞提高了近5倍。不同浓度的草酸铂处理HT-29结肠癌细胞3 d 后,在同一浓度的草酸铂作用下,HT-29结肠癌细胞中SP细胞的细胞活力均高于非SP细胞,草酸铂对HT-29细胞中SP细胞的IC50较非SP细胞提高了近5倍,见表2。不同浓度的阿霉素处理HT-29结肠癌细胞3 d后,在同一浓度的阿霉素作用下,HT-29结肠癌细胞中SP细胞的细胞活力均高于非SP细胞,阿霉素对HT-29细胞中SP细胞的IC50较非SP细胞提高了近5倍,见表2。
不同浓度的5-氟尿嘧啶处理LoVo细胞3 d后,在同一浓度的5-氟尿嘧啶作用下,LoVo结肠癌细胞中SP细胞的细胞活力均高于非SP细胞,从表2可见,5-氟尿嘧啶对LoVo细胞中SP细胞的IC50较非SP细胞提高了近5倍。不同浓度的草酸铂处理LoVo结肠癌细胞3 d 后,在同一浓度的草酸铂作用下,LoVo细胞中SP细胞的细胞活力均高于非SP细胞,草酸铂对LoVo细胞中SP细胞的IC50较非SP细胞提高了近6倍,见表2。不同浓度的阿霉素处理LoVo细胞3 d 后,在同一浓度的阿霉素作用下,LoVo细胞中SP细胞的细胞活力均高于非SP细胞,阿霉素对LoVo细胞中SP细胞的IC50较非SP细胞提高了近4倍,见表2。
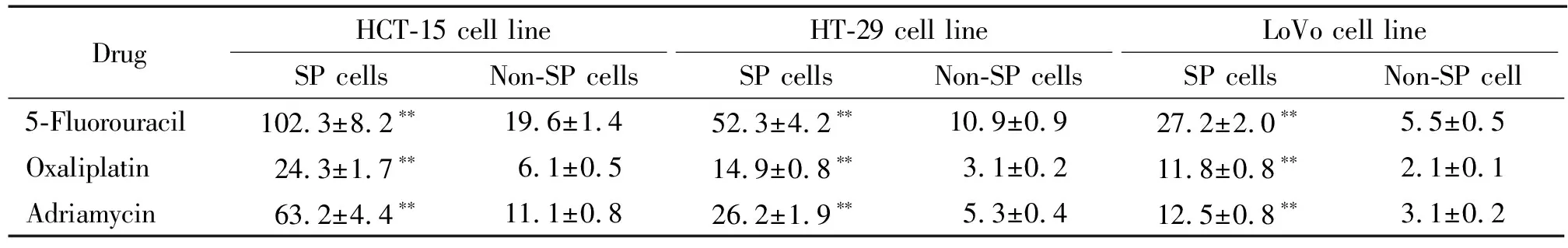
表2 抗肿瘤药对3种人结肠癌细胞系SP细胞和非SP细胞的IC50
3 MicroRNA芯片检测的重复性检验
HCT-15、HT-29及LoVo细胞经流式细胞术分选出SP细胞及非SP细胞,共6个样本进行 microRNA芯片检测,每个样本重复检测4次,计算各样本的相关系数R(反映样本检测的重复性),结果见表3。
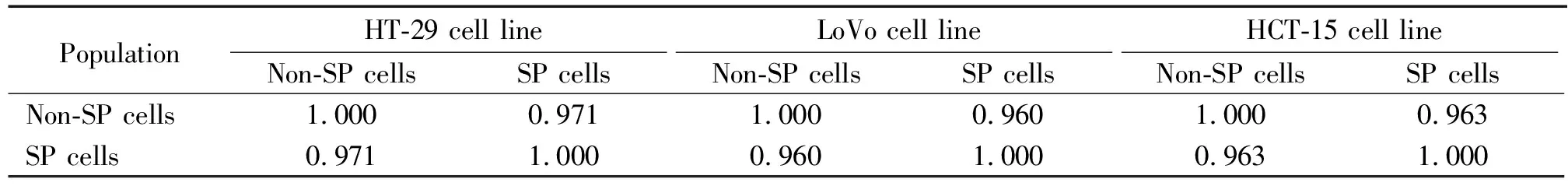
表3 各样本microRNA芯片检测的相关系数R值
4 结肠癌SP细胞的microRNA表达谱分析
HCT-15、HT-29及LoVo细胞经流式细胞术分选出SP细胞及非SP细胞,采用miRCURY LNATMmicroRNA Array (v.18.0) 检测各细胞系SP细胞与非SP细胞microRNAs的表达谱,并比较每一细胞系中SP细胞与非SP细胞microRNAs的表达差异,从中筛选出差异达到2倍以上的microRNAs。结果发现,在HCT-15细胞系,SP细胞中microRNAs表达上调的有106种,包括miR-5000-3p、miR-5009-3p、miR-552、miR-17-5p、miR-3146、miR3619-3p等;表达下调的有52种,包括miR-4664-3p、miR-940、miR-133b、miR-4667-3p、miR-484、miR-4312等(见表4,因版面所限,表中仅分别列出10种表达上调及10种表达下调的microRNAs)。在HT-29细胞系,SP细胞中microRNAs表达上调的有58种,包括miR-5000-3p、miR-5009-3p、miR-552、 miR-611、miR-365b-5p、miR-3667-3p等;表达下调的有63种,包括miR-125b-5p、miR-30b-5p、miR-101-3p、miR-23a-3p、miR-24-3p、let-7g-5p等(见表5,因版面所限,表中仅分别列出10种表达上调及10种表达下调的microRNAs)。在LoVo细胞系,SP细胞中microRNAs表达上调的有47种,包括miR-5000-3p、miR-5009-3p、miR-552、miR-3915、miR-4777-5p、miR-301a-3p等;表达下调的有22种,包括miR-34a-5p、miR-30e-3p、miR-33b-5p、miR-199a-5p、miR-125b-5p、miR-1275等(见表6,因版面所限,表中仅分别列出10种表达上调及10种表达下调的microRNAs)。在3种细胞系中,miR-5000-3p、miR-5009-3p及miR-552在SP细胞中均表达上调,而没有1种microRNA在3种细胞系的SP细胞中表达均下调。
5 3种表达上调microRNAs的实时荧光定量PCR验证
microRNA表达谱分析发现,miR-5000-3p、miR-5009-3p及miR-552在3种结肠癌细胞系的SP细胞中均表达上调,为确认此结果,我们采用实时荧光定量PCR对该结果进行验证。以U6为内参照,计算SP细胞与非SP细胞各microRNAs的相对表达量。将3种microRNAs的实时荧光定量PCR结果与microRNA芯片检测结果比对,在HCT-15细胞系,microRNA芯片检测显示SP细胞较非SP细胞miR-5000-3p、miR-5009-3p及miR-552的表达量分别增加6.76倍、2.37倍和6.96倍,而实时荧光定量PCR检测结果显示SP细胞较非SP细胞miR-5000-3p、miR-5009-3p及miR-552的表达量分别增加2.20倍、2.01倍和3.85倍;在HT-29结肠癌细胞系,microRNA芯片检测显示SP细胞较非SP细胞miR-5000-3p、miR-5009-3p及miR-552的表达量分别增加2.25倍、2.26倍和2.81倍,而实时荧光定量PCR检测结果显示SP细胞较非SP细胞在miR-5000-3p、miR-5009-3p及miR-552表达量分别增加2.35倍、3.46倍和2.63倍;在LoVo细胞系,microRNA芯片检测显示SP细胞较非SP细胞miR-5000-3p、miR-5009-3p及miR-552的表达量分别增加3.28倍、2.35倍和8.13倍,而实时荧光定量PCR检测结果显示SP细胞较非SP细胞miR-5000-3p、miR-5009-3p及miR-552的表达量分别增加2.57倍、2.00倍和2.59倍。上述结果显示出microRNA芯片检测结果与实时荧光定量PCR检测结果具有良好的一致性。

表4 HCT-15人结肠癌细胞系SP细胞与非SP细胞间microRNA的差异表达

表5 HT-29人结肠癌细胞系SP细胞与非SP细胞间microRNA的差异表达

表6 LoVo人结肠癌细胞系SP细胞与非SP细胞间microRNA的差异表达
讨 论
在本研究中,我们采用Hoechst 33342荧光染料,利用流式细胞术从结肠癌细胞系中成功分离出结肠癌SP细胞。SP细胞最先由Goodell等[9]于1996年报道描述。Haraguchi等[10]从胃肠道肿瘤细胞系中分离出SP细胞,尽管他们从肝癌细胞系Huh7中分离出SP细胞,并报道了该SP细胞的基因表达谱以及对化疗药物的耐药性,但他们尚未报道SP细胞的microRNA表达谱。Schetter等[11]和Callari等[12]报道了结肠癌细胞的microRNA表达谱,但他们采用的结肠癌细胞来源于结肠癌患者的组织标本,他们并未报道结肠癌SP细胞的microRNA表达谱。在本研究中,我们从3种结肠癌细胞系包括HCT-15、HT-29及LoVo细胞系中成功分离纯化出结肠癌SP细胞。流式细胞术分析检测发现,HCT-15、HT-29及LoVo细胞系的SP细胞比例分别为16.75%、13.02% 及9.52%。Inoda等[13]报道HCT-15、HT-29及LoVo细胞系的SP细胞比例分别为11.1%、10.4%和9.1%。本研究测定的HCT-15、HT-29及LoVo细胞系的SP细胞比例与Inoda等[13]报道的比例相似。这说明每一种结肠癌细胞系均含有一定比例的SP细胞,只是SP细胞的比例有所不同。
从HCT-15、HT-29及LoVo细胞系分选出的SP细胞和非SP细胞分别采用不同浓度的5-氟尿嘧啶、草酸铂及阿霉素处理3 d。本研究发现,不论是HCT-15及HT-29细胞系,还是LoVo细胞系,在相同浓度的5-氟尿嘧啶作用下,从这3种结肠癌细胞系中分选出的SP细胞的细胞活力均明显高于非SP细胞的细胞活力。这表明结肠癌细胞系中的SP细胞比非SP细胞对5-氟尿嘧啶更耐药。类似的结果在采用草酸铂或阿霉素处理时同样也可见到。由此可见,结肠癌细胞系中的SP细胞比非SP细胞对化疗药更耐药。Inoda等[13]报道从结肠癌细胞系SW480、HT-29及HCT-15中分选出的SP细胞比非SP细胞对诸如irinotecan或etoposide等化疗药更耐药。所有这些均表明结肠癌细胞中的SP细胞比非SP细胞对化疗药物更具抵抗性。由此可见,结肠癌细胞中的SP细胞在结肠癌的多药耐药性中起着非常重要的作用。
既然SP细胞在结肠癌的多药耐药性中起着非常重要的作用,因此本研究想探讨结肠癌SP细胞的特异的生物标志,以便通过靶向调节这些生物标志的表达而达到逆转结肠癌细胞的多药耐药性。在以往的研究中,Behbod等[8]曾探讨过乳腺癌SP细胞的基因标志,基因芯片分析提示乳腺癌细胞中的SP细胞是一类表达调节细胞周期关键基因的乳腺细胞亚群。本研究采用microRNA芯片对结肠癌细胞系中的SP细胞及非SP细胞进行了microRNA表达谱的分析,通过比较SP细胞与非SP细胞microRNA表达的差异,旨在探索结肠癌SP细胞的microRNA生物标志。本研究采用的microRNA检测芯片为Exiqon的miRCURYTMLNA Array (V.18.0),该microRNA芯片是目前最新版本的microRNA芯片检测系统,可同时检测2 000多种microRNAs。表3显示的是各样本microRNA芯片重复检测的相关系数R值,同一样本,R值越大则表示芯片检测的重复性越好,从表3可以看出,各样本重复检测的相关系数R值均接近1,说明各样本芯片检测的重复性非常好,同时也说明该芯片检测结果的可靠性。
通过对各样本进行microRNA芯片检测,我们发现,在HCT-15、HT-29 及LoVo细胞系,有3种microRNAs包括miR-5000-3p、miR-5009-3p及miR-552在这3种结肠癌细胞系的SP细胞中均表达上调。但没有发现一种microRNA在这3种结肠癌细胞系的SP细胞中均表达下调。而且这些发现通过RT-PCR的方法同时也得到了证实。在以往的研究中,Schetter等[11]和Callari等[12]曾报道结肠癌细胞的microRNA表达谱。但他们采用的结肠癌细胞样本来源于结肠癌患者的结肠癌组织标本。Alexander等[14]报道了结肠癌患者的粪便microRNAs表达谱,但该研究比较的是结肠癌患者与健康志愿者的粪便标本。Hofsli等[15]探讨了结肠癌患者的血清microRNAs表达谱,但该研究比较的是结肠癌患者与健康对照者的血清标本。尽管Zhang等[16]和Fang等[17]曾探讨过结肠癌干样细胞microRNAs的表达谱,但他们采用的结肠癌干样细胞是基于CD133或CD133/CD44细胞标记分选获得的细胞,而不是SP细胞。除此之外,该研究仅采用一种结肠癌细胞系来比较结肠癌干样细胞与非干样细胞microRNAs表达谱的差异。上述所有的研究均未进行对结肠癌SP细胞microRNA表达谱的探讨。因此,本研究是首次报道结肠癌SP细胞microRNA表达谱的检测,并比较结肠癌SP细胞与非SP细胞microRNA表达谱的差异,以探索结肠癌SP细胞的microRNA生物标志。
本研究通过分析比较3种结肠癌细胞系包括HCT-15、HT-29及LoVo的SP细胞与非SP细胞microRNA表达谱,发现有3种microRNA包括miR-5000-3p、miR-5009-3p 及miR-552在这3种结肠癌细胞的SP细胞中均表达上调,而其它的microRNA在结肠癌SP细胞中表达没有变化,或者只是在其中的1种或2种结肠癌SP细胞中有改变,提示miR-5000-3p、miR-5009-3p 及miR-552可能是结肠癌SP细胞潜在的microRNA生物标志。我们知道,SP细胞在结肠癌的多药耐药性中具有重要的作用,针对SP细胞的靶向治疗有可能逆转结肠癌的多药耐药性,因此这3种microRNA有可能成为结肠癌治疗的潜在靶点。在将来的研究中,可以采用针对这3种microRNA的反义RNA靶向抑制特异microRNA的表达,以进一步探讨靶向miR-5000-3p、miR-5009-3p或miR-552的反义RNA能否逆转结肠癌细胞的多药耐药性。
[参 考 文 献]
[1] Douillard JY, Cunningham D, Roth AD, et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal can-cer: a multicentre randomised trial[J]. Lancet, 2000, 355(9209): 1041-1047.
[2] van den Heuvel-Eibrink MM, Sonneveld P, Pieters R. The prognostic significance of membrane transport-asso-ciated multidrug resistance (MDR) proteins in leukemia[J]. Int J Clin Pharmacol Ther, 2000, 38(3): 94-110.
[3] 夏忠胜, 朱兆华, 陈其奎, 等. 靶向MDR1基因的RNAi稳定逆转结肠癌细胞的多药耐药性[J]. 中国病理生理杂志, 2009, 25(5): 898-903.
[4] Todaro M, Francipane MG, Medema JP, et al. Colon cancer stem cells: promise of targeted therapy[J]. Gastroenterology, 2010, 138(6): 2151-2162.
[5] Zheng X, Shen G, Yang X, et al. Most C6 cells are can-cer stem cells: evidence from clonal and population analyses[J]. Cancer Res, 2007, 67(8): 3691-3697.
[6] Szotek PP, Pieretti-Vanmarche R, Masiakos PT, et al. Ovarian cancer side population defines cells with stem cell-like characteristics and Mullerian Inhibiting Substance responsiveness[J]. Proc Natl Acad Sci U S A, 2006, 103(30): 11154-11159.
[7] Zhou S, Schuetz JD, Bunting KD, et al. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype[J]. Nat Med, 2001, 7(9): 1028-1034.
[8] Behbod F, Xian W, Shaw CA, et al. Transcriptional profiling of mammary gland side population cells[J]. Stem Cells, 2006, 24(4): 1065-1074.
[9] Goodell MA, Brose K, Paradis G, et al. Isolation and functional propertied of murine hematopoietic stem cells that are replicatinginvivo[J]. J Exp Med, 1996, 183(4): 1797-1806.
[10] Haraguchi N, Utsunomiya T, Inoue H, et al. Characterization of a side population of cancer cells from human gastrointestinal system[J]. Stem Cells, 2006, 24(3): 506-513.
[11] Schetter AJ, Leung SY, Sohn JJ, et al. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J]. JAMA, 2008, 299(4): 425-436.
[12] Callari M, Dugo M, Musella V, et al. Comparison of microarray platforms for measuring differential microRNA expression in paired normal/cancer colon tissues[J]. PLoS One, 2012, 7(9): e45105.
[13] Inoda S, Hirohashi Y, Torigoe T, et al. Cytotoxic T lymphocytes efficiently recognize human colon cancer stem-like cells[J]. Am J Pathol, 2011, 178(4): 1805-1813.
[14] Alexander L, Francesc B, Yan S, et al. Fecal microRNAs as novel biomarkers for colon cancer screening[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(7): 1766-1774.
[15] Hofsli E, Sjursen W, Prestvik WS, et al. Identification of serum microRNA profiles in colon cancer[J]. Br J Can-cer, 2013, 108(8): 1712-1719.
[16] Zhang H, Li W, Nan F, et al. MicroRNA expression profile of colon cancer stem-like cells in HT29 adenocarcinoma cell line[J]. Biochem Biophys Res Commun, 2011, 404(1): 273-278.
[17] Fang Y, Xiang J, Chen ZY, et al. miRNA expression profile of colon cancer stem cells compared to non-stem cells using the SW1116 cell line[J]. Oncol Rep, 2012, 28(6): 2115-2124.

