红景天苷对内皮祖细胞功能及其PI3K/Akt通路的影响*
周芝兰, 王林静, 刘革修, 朱锦灿, 陈小宇, 刘善淘
(1国防科技大学医院,湖南 长沙 410073; 2广东药学院公共卫生学院,广东 广州 510006;3暨南大学医学院血液病研究所,广东 广州 510632)
藏药红景天不仅在抗疲劳、抗缺氧、延缓衰老等保健制剂方面被广泛接受,而且在心脑血管疾病治疗方面也显示显著效果[1-2]。研究显示其重要提取物红景天苷(salidroside,Sal)具有扩张阻力血管和容量血管、降低周围阻力,使动脉血压和左室舒张末压下降。说明其对血管平滑肌细胞或者内皮细胞具有重要作用。内皮祖细胞(endothelial progenitor cells, EPCs)是血管内皮细胞的前体细胞,具有增殖、分化成新生血管和更新与修复动脉内皮的功能,在创伤愈合和心血管系统中具有重要作用,EPCs数量已被作为心血管疾病诊断及预后评价的重要指标[3-5]。本文通过研究红景天苷对内皮祖细胞功能的影响并初步了解其信号途径机制,为红景天的应用提供基础。
材 料 和 方 法
1 材料
内皮细胞基础培养基2(endothelial basal me-dium-2,EBM-2)和内皮细胞生长培养基-2(endothelial growth medium-2,EGM-2)购自Clonetics;人纤维连接蛋白(human fibronectin,HFN)购自Chemicon;FITC-UEA-I 为Sigma 产品; acLDL-DiI 购自Molecular Probe;小鼠抗人Akt单克隆抗体和小鼠抗人磷酸化Akt单克隆抗体(Millipore);小鼠抗人GAPDH (Chemicon International);Transwell小室购自Corning;红景天苷购自中国食品药品检定所;PI3K抑制剂LY294002 (Sigma)用DMSO配制成1 mmol/L的储存液,-20 ℃保存。
2 EPCs的分离与培养
5名在校健康志愿男生,年龄18~21岁,肘静脉取血45 mL,肝素抗凝,Ficoll液密度梯度离心法获取单个核细胞,PBS洗涤2次后种于含20% 胎牛血清的EBM-2和EGM-2混合培养基、HFN(5 μg/cm2)包被的培养板,37 ℃、5% CO2、饱和湿度培养。4 d后用PBS 洗去非贴壁细胞, 换培养液,6 d后用PBS洗掉非贴壁细胞, 贴壁细胞供实验用。每份血液完成1组实验, 包括对照组和药物干预组的EPCs数量及功能检测。
3 方法
3.1MTT法检测Sal对EPCs增殖的影响 EPCs 培养7 d 后,用0.25%胰酶消化内皮祖细胞,接种到HFN包被的96孔培养板,培养24 h、48 h或72 h后,每孔加MTT (5 g/L)10 μL,培养4 h。弃去上清液,再加入DMSO(150 μL/well)充分振荡10 min后,在酶标仪下于波长490 nm处测吸光度(A)值。实验分成8组: (1) 对照组: 含10% 胎牛血清的EBM-2和EGM-2混合培养基培养;(2) Sal各浓度组(共7组): 在含10% 胎牛血清的EBM-2和EGM-2混合培养基中加入Sal(2.5、5.0、10.0、20.0、40.0、80.0和160.0 μmol/L);(3) LY294002组:Sal+LY294002,选择20 μmol/L Sal是根据预实验结果,选择10 μmol/L LY294002是根据文献资料。红景天苷用培养基配制。设3复孔。
3.2细胞染色与鉴定 培养7 d后去培养基,PBS洗2遍,加稀释的acLDL-DiI(用培养基按1∶100稀释),37 ℃下孵育2 h,PBS洗2遍,4%多聚甲醛固定10 min,PBS洗2遍后,1%曲拉通孵育20 min,PBS洗2遍,加1∶100稀释的lectin孵育1 h,PBS洗2遍,DAPI染色,荧光显微镜下鉴定UEA-I和acLDL 双染色阳性的EPCs,随机选择10个×200 视野计数。
3.3EPCs 黏附能力检测 用0.25%胰蛋白酶消化贴壁细胞, 收集、悬浮在500 μL培养液, 计数。然后将同等数目的EPCs 接种在HFN包被的培养板,Sal干预,在37 ℃下培养30 min,计数贴壁细胞。
3.4EPCs 迁移能力检测 用0.25%胰酶消化经鉴定的细胞, 收集并计数。将含不同浓度Sal 500 μL培养液加入Transwell小室的下室, 含1×104EPCs 培养液100 μL注入上室, Sal干预,培养24 h, 刮去滤膜上面的未移动细胞, 用甲醇固定, Giemsa 染色, 随机选择3 个显微镜视野(×400), 计数迁移的细胞。
3.5细胞一氧化氮(nitric oxide,NO)检测 收集各组细胞培养上清,按NO检测试剂盒操作说明,通过比色法测知NO浓度。
3.6Westertn blotting检测细胞Akt蛋白的表达 处理24 h后收集细胞提取总蛋白,采用BCA法进行蛋白定量。取等量蛋白30 μg上样,进行10% SDS-PAGE及转膜,然后用含5%脱脂奶粉的TBST对膜封闭30 min,加入稀释的Ⅰ抗于4 ℃孵育过夜,次日加入辣根过氧化物酶(horseradish peroxidase, HRP)标记的相应Ⅱ抗IgG(1∶3 000)于室温孵育1 h,TBST洗膜10 min×3次。化学荧光法检测 (Boehringer Mannheim),采集图像,采用Gelpro4.0软件对目的蛋白进行定量分析。以GAPDH作为内参照。
4 统计学处理
采用SPSS 15.0统计软件处理,计量资料以均数±标准差(mean±SD)表示,各组间比较采用单因素方差分析(ANOVA);计数资料采用卡方检验。以P<0.05为差异有统计学意义。
结 果
1 EPCs 的培养与鉴定
分离获得的单个核细胞经过内皮细胞培养基培养7 d 后形成了圆形或梭形细胞。采用DAPI(图1A)、FITC-UEA-I(图1B)和acLDL-DiI(图1C)对细胞染色后, 通过荧光显微镜可以观察到, 大部分细胞呈UEA-I和acLDL染色阳性,为EPCs。
2 Sal对EPCs增殖的影响
结果显示,在2.5~160 μmol/L浓度范围内,不同浓度的Sal与EPCs培养均能显著促进EPCs增殖,并且随着浓度的增加EPCs数量增加。2.5 μmol/L Sal在48h时与对照组相比有明显差异,10 μmol/L Sal在24 h时即有明显差异,80 μmol/L Sal则产生最大效应,72 h时较对照组增加了1.67倍(P<0.05),而LY294002(10 μmol/L)则能抑制红景天苷的促EPCs增殖作用,见表1。
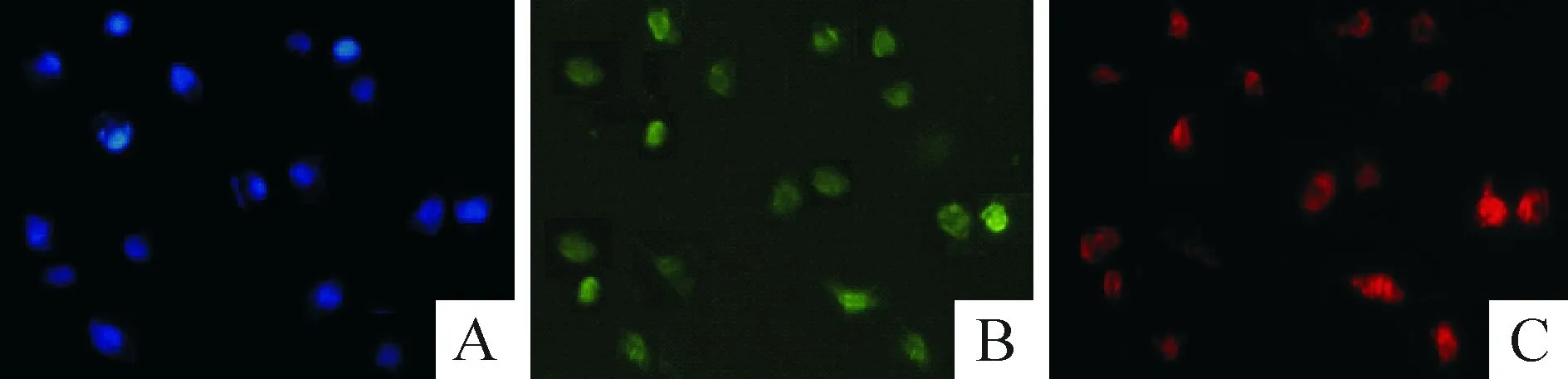
Figure 1. Identification of EPCs (×200). A: the nuclei of adherent cells with DAPI were blue; B: cells binding to FITC-UEAI were green; C: adherent cells with acLDL-DiI were red.
3 Sal对EPCs 迁移功能的影响
采用Transwell小室检测Sal对EPCs 迁移功能的影响, 在400倍显微镜下计数迁移的细胞结果显示,Sal明显改善了EPCs 的迁移功能。2.5 μmol/L Sal组迁移的细胞数是49±14,是对照组(32±11)的1.5倍(P<0.05);80 μmol/L Sal效果最显著,其迁移的细胞数是对照组4.3倍(P<0.05),见图2。
4 Sal对EPCs 黏附能力的影响
结果显示, Sal作用24 h显著增加了贴壁细胞数,并且贴壁细胞数随着Sal浓度的增加而增加, 5 μmol/L Sal组即有显著增加(P<0.05), 80 μmol/L Sal组达到最大效应,见图3。2.5 μmol/L Sal组与对照组比无显著差异。
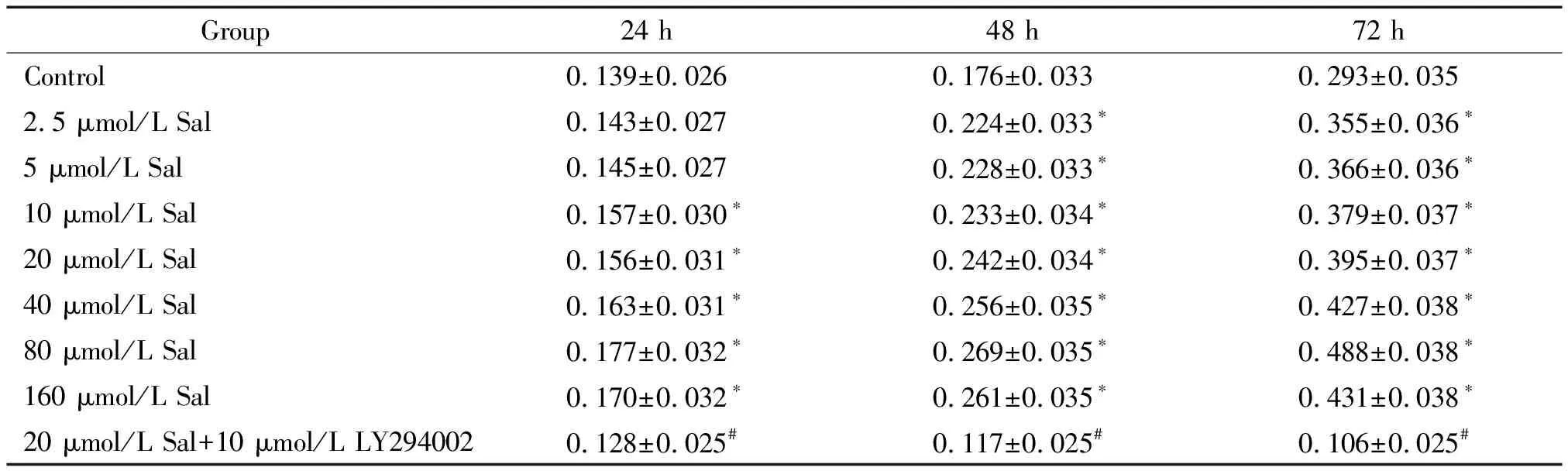
表1 MTT法检测Sal对EPCs增殖的作用
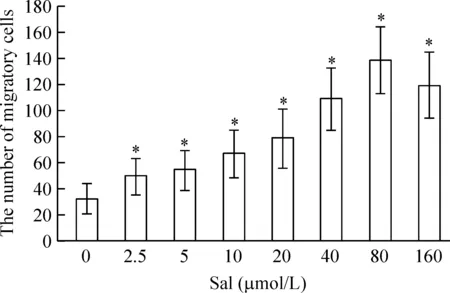
Figure 2. The effects of Sal on the migration of EPCs.Mean±SD. n=3.*P<0.05 vs 0 μmol/L.
5 Sal对EPCs合成NO的影响
结果显示,在2.5~160 μmol/L Sal浓度范围内,不同浓度的Sal与EPCs培养均能显著促进EPCs合成NO,并且随着浓度的增加,NO的合成也增加, 48 h时2.5 μmol/L Sal组培养基中NO的浓度为(16.75±3.41) μmol/L,与对照组[(11.63±3.30) μmol/L]比有明显差异(P<0.05);80.0 μmol/L Sal则产生最大效应[(21.63±3.49) μmol/L],较对照组增加了1.86倍,见图4。
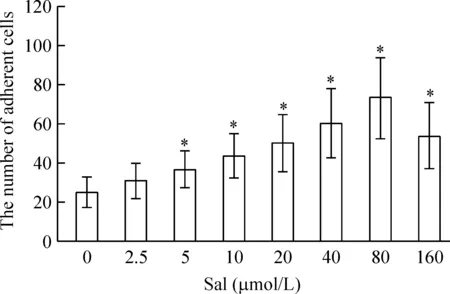
Figure 3. Effects of Sal on adhesion of EPCs.Mean±SD. n=3.*P<0.05 vs 0 μmol/L.
6 红景天苷对EPCs内Akt蛋白水平的影响
结果显示,Sal (20 μmol/L)对细胞内Akt总蛋白水平影响不明显,但显著增加p-Akt蛋白水平;LY294002(10 μmol/L)则能抑制Sal增加p-Akt蛋白水平,见图5。而且LY+Sal组的p-Akt比对照组少。
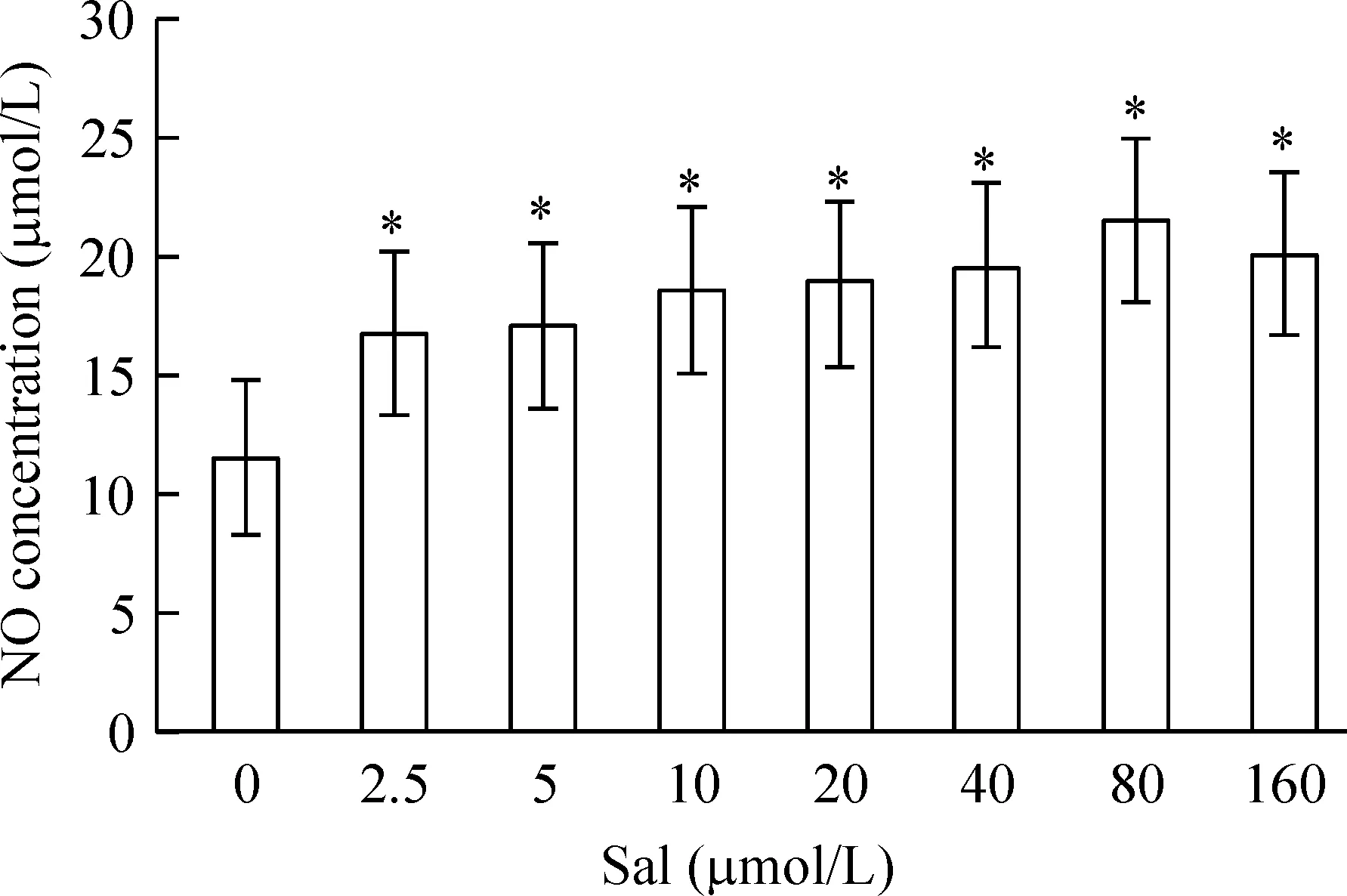
Figure 4. The effects of Sal on NO secretion from EPCs.Mean±SD.n=3.*P<0.05 vs 0 μmol/L.
这是因为对照组EPCs本身处于增殖状态,且存在PI3K/Akt通路活化,应用LY294002则抑制了该部分PI3K和红景天苷将激活的PI3K,所以,LY+Sal组p-Akt蛋白水平较对照组下降。这些结果说明Sal 能影响PI3K/Akt活性。
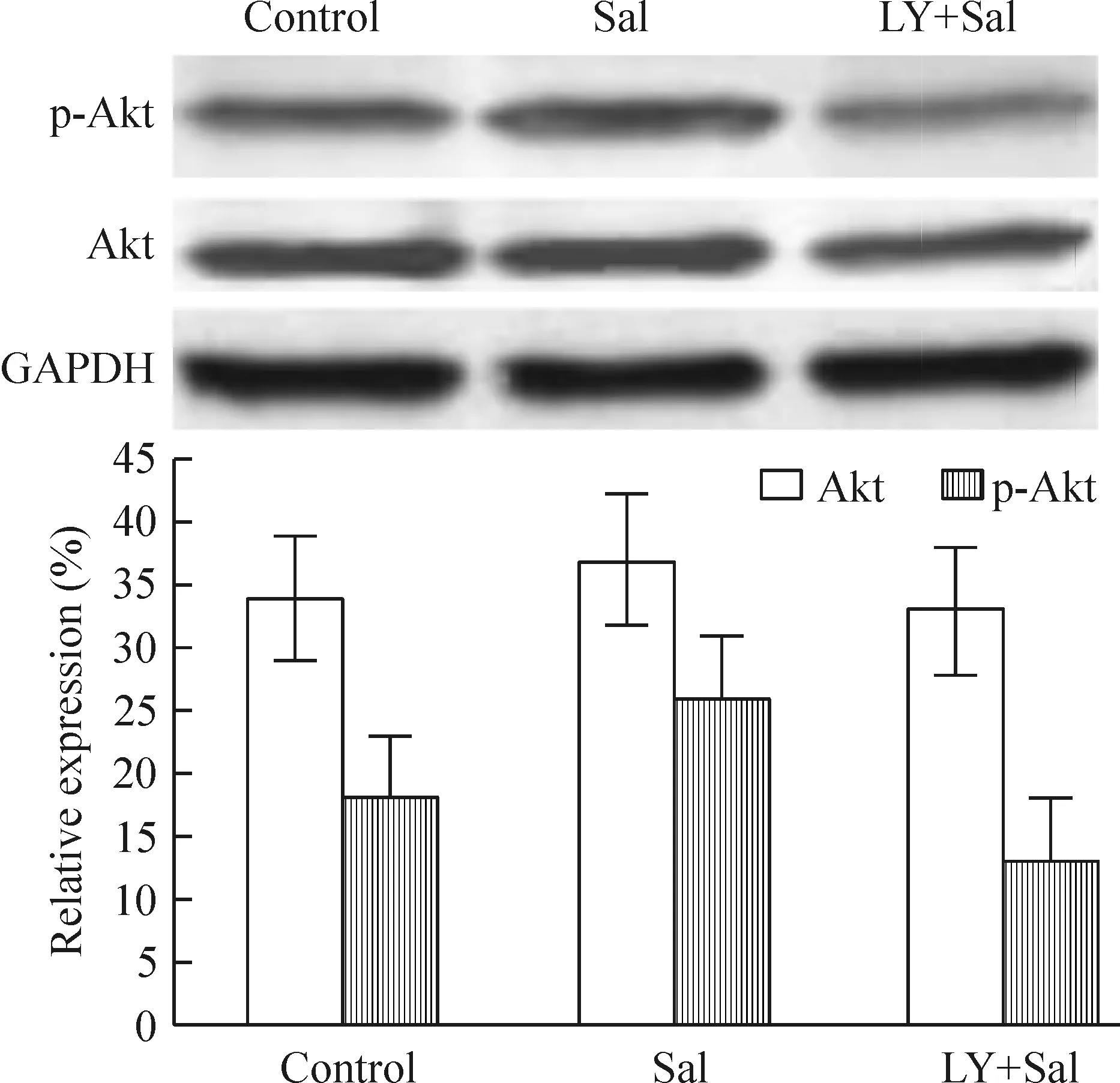
Figure 5. The effects of Sal on the Akt protein expression and phosphorylation in EPCs.Mean±SD.n=3.*P<0.05 vs control; #P<0.05 vs Sal.
讨 论
EPCs数量已被作为心血管疾病诊断及预后评价的重要指标[3-5]。本研究结果显示,Sal 在2.5~160 μmol/L浓度范围内,不仅显著促进EPCs增殖,而且增强EPCs的功能,促进EPCs黏附、迁移以及NO合成。EPCs数量增加、黏附和迁移能力增强,则可以促进新生血管形成,促进创伤愈合;NO则可以改善心血管舒张功能。所以,在临床上,Sal可应用于创伤或者心血管疾病的防治,促进患者康复。本研究结果也显示,Sal可增加EPCs的PI3K/Akt信号通路活性,该信号通路的抑制剂LY294002(10 μmol/L)则能抑制Sal的作用。PI3K参与调节细胞内许多重要生命活动,控制细胞周期进程、细胞分化、细胞存活、细胞侵袭和转移以及血管生成等信号途径[6-9]。PI3K的一些生物学效应是通过其下游靶分子Akt的激活介导的。Akt被激活则可诱导细胞核反应、促进基因表达,导致细胞增殖与分化[6-7]。另外,内皮型一氧化氮合酶磷酸化活化也受其调节,从而影响NO合成,调节血管活性并促进内皮祖细胞增殖分化[6-7]。总之,Sal通过PI3K/Akt通路调节EPCs的生物学活性与功能。这部分解析了红景天中药制剂在临床心血管疾病中的应用机制。
[参 考 文 献]
[1] 彭丽华. 红景天苷治疗心脑血管疾病相关药理作用的新进展[J]. 内蒙古中医药, 2013, (28):101.
[2] 王 晴. 红景天与心脑血管疾病关系探讨[J]. 实用心脑肺血管病杂志, 2012,20(4):760-761.
[3] Hirata Y, Sugiyama S, Yamamoto E, et al. Endothelial function and cardiovascular events in chronic kidney disease[J]. Int J Cardiol, 2014, 173(3):481-486.
[4] Matsue Y, Suzuki M, Nagahori W, et al. Endothelial dysfunction measured by peripheral arterial tonometry predicts prognosis in patients with heart failure with preserved ejection fraction[J]. Int J Cardiol, 2013, 168(1):36-40.
[5] Akiyama E, Sugiyama S, Matsuzawa Y, et al. Incremental prognostic significance of peripheral endothelial dysfunction in patients with heart failure with normal left ventricular ejection fraction[J]. J Am Coll Cardiol, 2012, 60(18):1778-1786.
[6] Cantrell DA. Phosphoinositide 3-kinase signalling pathways[J]. J Cell Sci, 2001, 114(Pt 8):1439-1445.
[7] Neri LM, Borgatti P, Capitani S, et al. The nuclear phosphoinositide 3-kinase/AKT pathway: a new second messenger system[J]. Biochim Biophys Acta, 2002, 1584(2-3):73-80.
[8] Ruan GX, Kazlauskas A. Lactate engages receptor tyrosine kinases Axl, Tie2, and vascular endothelial growth factor receptor 2 to activate phosphoinositide 3-kinase/Akt and promote angiogenesis[J]. J Biol Chem, 2013, 288(29):21161-21172.
[9] Brader S, Eccles SA. Phosphoinositide 3-kinase signalling pathways in tumor progression, invasion and angiogenesis[J]. Tumori, 2004, 90(1):2-8.
——题《圣山系-金巅》

