靶向caspase-8小发夹RNA减轻去血清/缺氧诱导的人骨髓间充质干细胞凋亡*
袁伟伟, 林秋雄, 朱杰宁, 李晓红, 符永恒, 刘晓颖, 谭虹虹, 邓春玉, 单志新
(广东省人民医院,广东省医学科学院, 广东省心血管病研究所,广东 广州 510080)
急性心肌梗死仍是世界公共卫生一大难题,现有治疗方法的疗效有限。心肌细胞治疗是一种再生、修复损伤心肌的治疗策略。已有很多不同组织来源的干细胞、祖细胞被用于实验性或临床治疗研究,如胚胎干细胞、间充质干细胞(mesenchymal stem cells,MSCs)、造血干细胞、新生儿或胎儿心脏干细胞、骨骼肌成肌细胞和诱导多能干细胞(induced pluripotent stem cells, iPS cells)等[1-4]。MSCs是一种具有多向分化潜能的成体干细胞,可以在不同的诱导条件下分化为成骨细胞、脂肪细胞、软骨细胞、肌肉细胞、神经细胞、心肌细胞等,可能是组织工程、再生医学领域中重要的种子细胞[5]。MSCs已在临床前研究中得到了广泛的测试,并且已有几个临床试验评估其在心肌梗死治疗中的临床疗效[6-9]。然而,由于梗死心肌中缺血、炎症等恶劣的微环境使得MSCs的移植率和存活率低下,大大限制了MSCs的治疗效果。近年来,人们尝试通过基因修饰MSCs来提高其移植后的存活率,并取得了一定的效果;已报道用于修饰MSCs的基因包括Bcl-2、间隙连接蛋白43 (connexin-43)、血红素氧合酶 (heme oxygenase-1,HO-1)、热休克蛋白20 (heat-shock protein 20, HSP-20)、磷脂酰肌醇3-激酶C2α(phosphatidylinositol 3-kinases C2α, PI3K-C2α)、蛋白激酶B(protein kinase B,PKB/Akt)和血管生成素1(angiopoietin-1,Ang1)等[10]。
鉴于过表达抗凋亡蛋白可增强MSCs的心肌再生作用[11-13],我们认为通过沉默促凋亡基因表达也可以提高MSCs的存活率。本研究制备了表达人caspase-8小发夹RNA(small hairpin RNA,shRNA)的重组腺病毒,检测了腺病毒介导的caspase-8 shRNA对人MSCs中caspase-8表达的抑制作用及对去血清/缺氧诱导的MSCs凋亡的保护作用。
材 料 和 方 法
1 细胞和载体
hMSCs按我们已报道的方法分离、培养和保存[14];HEK293T购自ATCC;质粒pAdTrack-CMV(携带GFP报告基因)、pAdEasy-I和大肠杆菌菌株BJ5183购自Stratagen;大肠杆菌菌株DH-5α由本研究室保存。
2 主要试剂
质粒提取试剂盒和DNA 回收试剂盒(Qiagen);Trizol试剂、逆转录酶和定量PCR Master Mix购自Invitrogen;DNA聚合酶和限制性内切酶(TaKaRa);胎牛血清和α-DMEM(HyClone);L-谷氨酰胺、丙酮酸钠、磷酸盐缓冲液(PBS)、Lipofectamine 2000转染试剂、293 FectinTM转染试剂和0.05% 胰蛋白酶、annexin V/PI(Invitrogen);caspase-8活性检测试剂(Promega);caspase-8抗体和GAPDH抗体(Abcam);所用PCR引物由英潍捷基(上海)公司合成。
3 主要方法
3.1PCR扩增法制备caspase-8 shRNA编码DNA 参考我们已报道方法[15],简述如下。分别针对人caspase-8基因的2个靶序列:aagggtcatgctctatcagat和cagtgccagacacagtctgta,并根据腺病毒穿梭质粒pAdTrack-CMV 多克隆位点序列,设计合成用于制备基于微小RNA-155骨架序列(back bone)的caspase-8 shRNA模板DNA的PCR引物。靶向aagggtcatgctctatcagat的caspase-8 shRNA模板DNA的PCR上游引物ATGCGGTACCTGAAGGCTTGCTGTAGGCTGTATG-CTGATCTGATAGAGCATGACCCTTGTTTTGGCCACT-GACTGAC (KpnI),下游引物GCATAAGCTTCAGCAATTTGTTCCATGTGAATGCTAGTAACAGGCATCA-TACACTGATCTGATAGAGTGACCCTTGTCAGTCAGT-GGCCAAAAC (HindIII)。靶向cagtgccagacacagtctgta的caspase-8 shRNA模板DNA的PCR上游引物ATGCGGTACCTGAAGGCTTGCTGTAGGCTGTATGCTGT-ACAGACTGTGTCTGGCACTGGTTTTGGCCACTGACT-GAC (KpnI),下游引物GCATAAGCTTCAGCAATTTGTTCCATGTGAATGCTAGTAACAGGCATCATACACTG TACAGACTGTGTGGCACTGGTCAGTCAGTGGCCAA-AAC (HindIII)。分别利用2对PCR引物自身为模板进行PCR反应,条件为94 ℃ 2 min,后连续31个循环, 每个循环内94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 15 s, 完成最后1个循环后72 ℃延伸3 min。之后进行2%琼脂糖凝胶电泳, 用凝胶提取试剂盒纯化PCR 产物。
3.2人caspase-8 shRNA腺病毒穿梭质粒的构建 用KpnI+HindIII分别酶切人caspase-8 shRNA模板DNA和pAdTrack-CMV质粒。纯化酶切产物, 利用T4DNA连接酶于16 ℃反应4~6 h。将连接产物转化感受态大肠杆菌DH5α, 铺50 mg /L Kana+/LB平板,37 ℃倒置培养过夜。对获得的阳性克隆重组质粒行KpnⅠ+HindIII酶切和DNA测序鉴定。
3.3细菌内同源重组获得caspase-8 shRNA重组腺病毒质粒 用PmeⅠ酶切重组穿梭质粒pAdTrack-caspase-8 shRNA,然后将线性化质粒与腺病毒骨架质粒pAdeasy-I共转化BJ5183感受态菌,铺50 mg/L Kana+/LB平板,37 ℃倒置培养过夜。用碱裂解法提取扩增后的最小阳性克隆的质粒DNA, 分别行PCR和PacⅠ酶切鉴定。将鉴定正确的重组腺病毒质粒转入感受态DH5α菌, 挑取克隆扩增, 提取质粒保存。
3.4Caspase-8 shRNA重组腺病毒在HEK293细胞中的包装及扩增 用含10% FBS的DMEM培养液培养人胚肾293细胞。在转染前24 h, 将106HEK293细胞铺于25 cm2培养瓶内。当细胞丰度达到60%~70%时, 用293fectinTM试剂将PacI线性化的caspase-8 shRNA重组腺病毒质粒导入HEK293细胞。培养24~48 h后,在荧光显微镜下观察重组腺病毒上共表达的绿色荧光蛋白(GFP)的表达。继续培养7~10 d后,用吸管小心吹打收集293细胞及上清培养基。在-70 ℃/37 ℃反复冻融裂解细胞3次后,用适量的细胞冻融裂解上清液再次感染HEK293细胞。2~3 d后,按照上述方法收集病毒上清,经过2~3次重复扩增后,获得较高滴度的重组病毒。按上述方法,制备只表达标志蛋白GFP的对照重组腺病毒rAd-GFP。用无血清DMEM培养液稀释高滴度的重组病毒,以不同感染复数(MOI值)感染hMSCs,以感染后24 h GFP表达确定合适的病毒感染MOI。
3.5去血清/缺氧处理hMSCs 将hMSCs铺板24 h后至稳定生长。更换为无血清培养基(N2饱和0.5 h)在0.1% O2、37 ℃培养6 h,更换完全培养基,在常氧,5% CO2、37 ℃继续培养18 h。
3.6荧光定量PCR检测基因表达 用Trizol 试剂提取hMSCs总RNA,用2 μg总RNA逆转录合成cDNA第1链,进行目的基因表达水平的定量检测。Real-time PCR 条件如下:95 ℃ 1 min,94 ℃ 25 s,60 ℃ 30 s,72 ℃ 20 s,40 个循环,72 ℃ 3 min。扩增的DNA产物以荧光染料SYBR Green I 标记,在每个循环结束时测定每孔SYBR GreenⅠ吸光度值。反应结束后对PCR 产物做55 ℃ 到95 ℃的融解曲线分析,12 ℃终止反应。以人GAPDH为内参照,引物序列如表1所示。实验组与对照组间目的基因mRNA的相对表达水平用2-ΔΔCt方法[16]计算。

表1 实时定量RT-PCR实验所用的引物
3.7Western blotting检测caspase-8表达 用细胞蛋白裂解液处理hMSCs,收集细胞上清,行12% SDS-PAGE电泳。将细胞蛋白电转至硝酸纤维素膜上,封闭电转膜,再分别以兔抗caspase-8单抗为Ⅰ抗,羊抗兔IgG-HRP为Ⅱ抗孵育电转膜。内参照蛋白选用GAPDH。用ECL+Plus试剂为底物,曝光X光片,显色、定影。根据检测caspase-8蛋白条带和GAPDH蛋白条带的灰度比值,进行细胞样品中caspase-8蛋白表达的半定量分析。
3.8Annexin V/PI染色分析 用冰冷的PBS清洗hMSCs,离心,弃上清用annexin结合液重悬。调整细胞密度1×109cells/L,加5 μL Alexa Fluor 488 annexin V和1 μL PI工作液(100 mg/L)到每100 μL的细胞悬液中。室温避光孵育15 min。流式细胞术检测,发射波长为488 nm,FITC-annexin V荧光检测波长为(530±15) nm, PI荧光检测波长为600 nm。
3.9caspase-8活性检测 参照caspase-8活性检测试剂盒操作说明,制备hMSCs细胞裂解液,利用Glomax2020发光检测仪检测hMSCs细胞的caspase-8活性。
4 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 13.0软件分析,满足方差齐性时,组间比较用单因素方差分析;不满足方差齐性时,组间比较用秩和检验。以P<0.05为差异有统计学意义。
结 果
1 重组caspase-8 shRNA腺病毒的制备
经KpnI+HindIII酶切和DNA测序鉴定表明,分别针对人caspase-8基因靶序列aagggtcatgctctatcagat和cagtgccagacacagtctgta的caspase-8 shRNA腺病毒穿梭质粒pAd-Cap8 shRNA1和pAd-Cap8 shRNA2构建成功(本文未显示)。荧光定量PCR结果显示,转染pAd-Cap8 shRNA1介导表达的Cap8 shRNA能有效抑制HEK293细胞中caspase-8 的mRNA表达,见图1A。利用pAd-Cap8 shRNA1质粒和腺病毒骨架质粒pAdEasy-I继续构建重组腺病毒质粒rAdTrack-Cap8 shRNA1。PacI酶切鉴定显示,pAdTrack-CMV被切成6.0 kb和3.0 kb的片段,pAdEasy-I被切成33 kb的片段,而通过BJ5183菌重组的腺病毒质粒rAdTrack- Cap8 shRNA1被切成21.5 kb和4.5 kb的片段,说明pAd-Cap8 shRNA1和腺病毒骨架质粒发生了重组,见图1B。重组Cap8 shRNA腺病毒质粒转染HEK239细胞48 h后,有少量细胞表达绿色荧光蛋白,7~10 d后,全部HEK293细胞中表达GFP,细胞形成大量病毒斑、细胞发生融合及部分细胞漂浮,见图1C,表明重组Cap8 shRNA腺病毒在HEK293细胞中成功包装合成。经过2次扩增后,用反复冻融法收集包装好的病毒上清。
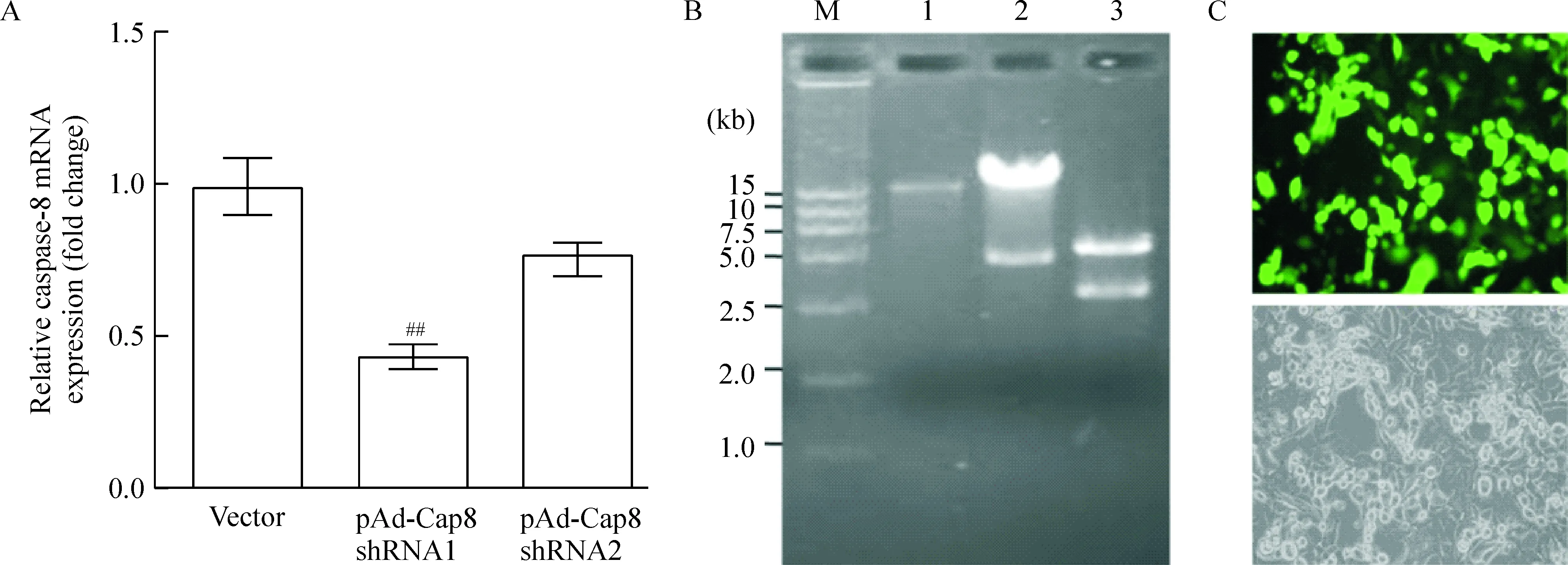
Figure 1. Preparation of recombinant adenovirus carrying caspase-8 shRNA.A: the mRNA expression of caspase-8 in caspase-8 (Cap8) shRNA-modified HEK293 cells detected by real-time PCR.Mean±SD.n=3. ##P<0.01 vs Vector. B: restriction endonuclease digestion of rAdTrack-Cap8 shRNA1 detected by electrophoresis through an 8 g/L agarose gel and ethidium bromide staining. M: DL15000 DNA ladder marker; 1: pAdEasy-I digested by Pac I; 2: rAdTrack-Cap8 shRNA1 digested by PacⅠ; 3: pAdTrack-CMV digested by PacⅠ. C: packaging of rAd-Cap8 shRNA in HEK293 cells.
2 腺病毒介导caspase-8 shRNA调控hMSCs中caspase-8的表达
当MOI为5时,重组caspase-8 shRNA腺病毒可有效感染hMSCs,hMSCs中有大量的GFP表达,见图2A。Real-time PCR结果显示,与hMSCs和阴性对照腺病毒感染的hMSCs相比,caspase-8 shRNA腺病毒感染的hMSCs中caspase-8 mRNA显著降低(P<0.01),见图2B;Western blotting结果显示,caspase-8 shRNA腺病毒感染的hMSCs中,caspase-8蛋白水平显著降低(P<0.01),见图2C。
3 Caspase-8 shRNA抑制去血清/缺氧诱导的hMSCs凋亡
流式细胞术分析显示,去血清和缺氧培养可显著提高hMSCs凋亡率,而腺病毒介导的过表达caspase-8 shRNA可有效降低hMSCs的凋亡率(P<0.01),见图3A。Caspase-8活性分析结果显示,去血清和缺氧培养的hMSCs中caspase-8活性显著升高,而caspase-8 shRNA可显著降低hMSCs中caspase-8活性(P<0.01),见图3B。
4 Caspase-8 shRNA增强hMSCs中HGF、IGF-1和Bcl-2的表达
利用real-time PCR检测了hMSCs中与增殖、凋亡相关基因的表达。结果显示,过表达caspase-8 shRNA的hMSCs中,HGF、IGF-1和Bcl-2 mRNA表达显著增强(P<0.05,P<0.01),而VEGF和Bcl-xL的表达变化不明显,见图4。

Figure 2. Adenovirus-mediated caspase-8 shRNA inhibited caspase-8 expression in hMSCs. A: green fluorescent protein expression in MSCs infected with rAd-GFP or rAd-Cap8 shRNA, respectively; B: caspase-8 mRNA expression in caspase-8 shRNA-overexpressing MSCs detected by real-time PCR assay; C: caspase-8 protein expression in caspase-8 shRNA-overexpressing MSCs detected by Western blotting.Mean±SD.n=3~5.##P<0.01 vs MSC; **P<0.01 vs MSC-vector.

Figure 3. Adenovirus-mediated caspase-8 shRNA inhibited apoptosis of MSCs under the condition of serum deprivation (SD) and hypoxia. A: Annexin V/PI staining; B: quantification of apoptotic cells; C: changes of caspase-8 activity. Mean±SD.n=3~5. **P<0.01 vs MSC; ##P<0.01 vs MSC-vector.

Figure 4. Adenovirus-mediated caspase-8 shRNA enhanced HGF, IGF-1 and Bcl-2 expression in hMSCs. Mean±SD.n=3~5.*P<0.05, **P<0.01 vs MSC; #P<0.05, ##P<0.01 vs MSC-vector.
讨 论
MSCs能够自我更新并可分化为成骨细胞、软骨细胞、星形胶质细胞、神经元、骨骼肌细胞和心肌细胞等[5]。由于MSCs便于分离和体外扩增培养,并具有多分化潜能,使得MSCs成为用于心脏再生的一种有希望的干细胞来源。然而移植到损伤心肌内MSCs不能有效存活的情况极大地限制了MSCs的临床应用。研究显示[17-18],超过99%的MSCs在注入到CB17 SCID成年小鼠左心室肌的4 d内死亡。鉴于心肌梗死区内的缺血微环境可能不利于MSCs存活和抵抗凋亡,如何提高MSCs在缺血条件下的生存能力对于MSCs成功应用于细胞治疗将是至关重要的。
近年来,人们研究通过对MSCs进行预处理和基因修饰等不同的策略来提高MSCs移植后的存活率和治疗效果。目前,已有大量的研究表明通过基因修饰手段可以提高MSCs移植后的存活率[10]。鉴于上述大多数措施增加MSCs生存能力是通过下调凋亡相关途径实现的,因而,本文采取了直接抑制MSCs凋亡相关基因caspase-8表达的策略,研究过表达caspase-8 shRNA对MSCs抗凋亡的作用。研究发现,虽然低氧预适应能增强MSCs的生存[19-21],但MSCs在长期的缺氧和缺乏营养条件下将发生显著凋亡[22]。以往的研究显示,线粒体途径介导了缺氧和去血清诱导的MSCs凋亡,尽管缺氧和去血清可诱导Fas和FasL表达,升高caspase-8活性,但用caspase-8抑制剂zIEDT-fmk 并不能降低caspase-3活性,抑制MSCs凋亡[23]。而本文研究显示,缺氧和去血清处理MSCs 6 h,继续常氧和完全培养基培养18 h,可诱导明显的MSCs凋亡,伴有caspase-8活性的显著升高;腺病毒介导过表达caspase-8 shRNA可降低caspase-8表达,抑制caspase-8活性,并有效降低缺氧和去血清诱导的MSCs凋亡。因此,利用caspase-8 shRNA特异降低MSCs的caspase-8表达和活性,可有效抑制缺氧和去血清诱导的MSCs凋亡。既往研究显示,沉默MSCs中caspase-3表达可以促进细胞增殖,减少细胞凋亡[24]。鉴于caspase-3处于凋亡有序级联反应的下游,结合本文研究结果,提示caspase-8活化参与的死亡受体凋亡途径在缺氧和去血清处理MSCs凋亡中发挥重要作用。同时,本文定量PCR结果显示,caspase-8 shRNA过表达的MSCs中抗凋亡相关HGF、IGF-1和Bcl-2表达显著升高,提示上述基因表达增加也促进了MSCs抗缺氧和去血清诱导的凋亡作用。但caspase-8 shRNA过表达的MSCs中HGF、IGF-1和Bcl-2表达升高的调控机制有待于进一步研究。
本研究我们采用了基于miR-155前体骨架(stem-loop序列)的DNA模板表达caspase-8 shRNA,并获得了有效的抑制MSCs中caspase-8表达的作用。既往的研究中,我们证实基于微小RNA骨架(如miR-30和miR-155)的DNA模板转录的目的基因shRNA比普通的发夹RNA能更有效抑制目的基因表达,而其中基于miR-155骨架DNA表达的目的基因shRNA的作用效能更好[15]。
因而,本文利用缺氧和去血清诱导的MSCs凋亡模型和腺病毒介导的基于miR-155前体骨架模板表达的caspase-8 shRNA,证实利用caspase-8 shRNA沉默MSCs中caspase-8表达可有效抑制MSCs凋亡。本文结果提示利用腺病毒介导caspase-8 shRNA修饰MSCs可能是一种提高MSCs移植后成活率的有效方法。
[参 考 文 献]
[1] Segers VF, Lee RT. Stem-cell therapy for cardiac disease[J]. Nature, 2008, 451(7181): 937-942.
[2] Tongers J, Losordo DW, Landmesser U. Stem and progenitor cell-based therapy in ischaemic heart disease: promise, uncertainties, and challenges[J]. Eur Heart J, 2011, 32(10):1197-1206.
[3] Janssens S. Stem cells in the treatment of heart disease[J]. Annu Rev Med, 2010, 61: 287-300.
[4] Arminan A, Gandia C, Garcia-Verdugo JM, et al. Mesenchymal stem cells provide better results than hematopoietic precursors for the treatment of myocardial infarction [J]. J AM Coll Cardiol, 2010,55(20):2244-2253.
[5] Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999, 284(5411):143-147.
[6] Giordano A, Galderisi U, Marino IR. From the laboratory bench to the patient’s bedside: an update on clinical trials with mesenchymal stem cells[J]. J Cell Physiol, 2007, 211(1):27-35.
[7] Hare JM,Traverse JH, Henry TD, et al. Arandomized, double-blind, placebo-controlled, dose-escalation study of intravenous adult human mesenchymal stem cells (prochymal) after acute myocardial infarction [J]. J AM Coll Cardiol, 2009, 54(24):2277-2286.
[8] Trachtenberg B, Velazquez DL, Williams AR, et al. Rationale and design of the transendocardial injection of autologous human cells (bone marrow or mesenchymal) in chronic ischemic left ventricular dysfunction and heart failure secondary to myocardial infarction (TAC-HFT) trial: a randomized, double-blind, placebo-controlled study of safety and efficacy[J]. Am Heart J, 2011,161(3): 487-493.
[9] Williams AR, Trachtenberg B, Velazquez DL, et al. Intramyocardial stem cell injection in patients with ischemic cardiomyopathy: functional recovery and reverse remodeling[J]. Circ Res, 2011, 108(7):792-796.
[10] Samper E, Diez-Juan A, Montero JA, et al. Cardiac cell therapy: boosting mesenchymal stem cells effects[J]. Stem Cell Rev, 2013, 9(3):266-280.
[11] Mangi AA, Noiseux N, Kong D, et al. Mesenchymal stem cells modified with Akt prevent remodeling and restore performance of infarcted hearts[J]. Nat Med, 2003, 9(9):1195-1201.
[12] Li W, Ma N, Ong LL, et al. Bcl-2 engineered MSCs inhibited apoptosis and improved heart function[J]. Stem Cells, 2007, 25(8):2118-2127.
[13] Fan L, Lin C, Zhuo S, et al. Transplantation with survivin-engineered mesenchymal stem cells results in better prognosis in a rat model of myocardial infarction[J]. Eur J Heart Fail, 2009, 11(11):1023-1030.
[14] Li XH, Fu YH, Lin QX, et al. Induced bone marrow mesenchymal stem cells improve cardiac performance of infarcted rat hearts[J]. Mol Biol Rep, 2012, 39(2):1333-1342.
[15] Shan Z, Lin Q, Deng C, et al. An efficient method to enhance gene silencing by using precursor microRNA designed small hairpin RNAs[J]. Mol Biol Rep, 2009, 36(6):1483-1489.
[16] Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Res, 2001, 29(9):e45.
[17] Geng YJ. Molecular mechanisms for cardiovascular stem cell apoptosis and growth in the hearts with atherosclerotic coronary disease and ischemic heart failure[J]. Ann N Y Acad Sci, 2003,1010:687-697.
[18] Toma C, Pittenger MF, Cahill KS, et al. Human mesenchymal stem cells differentiate to a cardiomyocyte phenotype in the adult murine heart[J]. Circulation, 2002, 105(1):93-98.
[19] Hu X, Yu SP, Fraser JL, et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis[J]. J Thorac Cardiovasc Surg, 2008,135(4):799-808.
[20] Li JH, Zhang N, Wang JA. Improved antiapoptotic and anti-remodeling potency of bone marrow mesenchymal stem cells by anoxic preconditioning in diabetic cardiomyopathy[J]. J Endocrinol Invest, 2008, 31(2):103-110.
[21] Wang JA, He A, Hu X, et al. Anoxic preconditioning: a way to enhance the cardioprotection of mesenchymal stem cells[J]. Int J Cardiol, 2009, 133(3):410-412.
[22] Potier E, Ferreira E, Meunier A, et al. Prolonged hypoxia concomitant with serum deprivation induces massive human mesenchymal stem cell death[J]. Tissue Eng, 2007, 13(6):1325-1331.
[23] Zhu W, Chen J, Cong X, et al. Hypoxia and serum deprivation-induced apoptosis in mesenchymal stem cells[J]. Stem Cells, 2006, 24(2):416-425.
[24] 华 平,刘家良,杨淞然, 等.慢病毒介导的caspase-3沉默对大鼠骨髓间充质干细胞增殖和凋亡的影响[J]. 中国病理生理杂志,2013,29(8):1502-1507.

