连续传代培养对hUC-MSCs上NLR家族mRNA表达的影响*
陈智聪, 刘 俊, 廖继东△, 谷景义, 杨晓蕾, 李扬秋
(暨南大学医学院 1田家炳医学实验中心, 2血液病研究所,广东 广州 510632)
间充质干细胞(mesenchymal stem cells, MSCs)来源于中胚层,存在于包括胚胎组织等多种成体组织内,具有多向分化和自我更新能力,可对T淋巴细胞、B淋巴细胞、树突状细胞和自然杀伤细胞等免疫系统细胞的激活、增殖以及功能产生影响;它在创伤修复、组织功能重建、免疫治疗等领域具有广阔的应用前景[1-2]。NOD样受体(NOD-like receptors,NLRs)是天然免疫受体超家族中重要一员,可识别病原相关分子模式(pathogen-associated molecular patterns, PAMP),启动天然免疫应答和诱发调节获得性免疫[3-5]。报道显示某些NLR家族成员与MSCs分化和免疫调节等功能密切相关[6-7]。无论何种来源的MSCs,其初始细胞数量均无法满足实验和临床应用,需要在体外进行传代扩增。然而,细胞在体外进行大量扩增后,其生物活性和功能必然随之发生变化[8]。迄今,未见有关NLR家族全体成员在MSCs上表达及连续传代培养对其影响的报道。本研究采用RT-qPCR对人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, hUC-MSCs)连续培养传代前后(第3和28代)的23个NLR家族成员的mRNA表达进行定量测定,探讨传代培养对hUC-MSCs上所有23个NLR家族成员mRNA表达的影响,为hUC-MSCs在连续培养传代过程中增殖、迁移、分化、参与组织修复以及免疫调节等能力的改变积累实验数据,为改进hUC-MSCs传代培养质量与提高hUC-MSCs在实验和临床应用中的数量及安全性寻找切入途径。
材 料 和 方 法
1 材料和试剂
取暨南大学华侨医院妇产科出生的健康新生儿脐带,长度约8~10 cm,胎龄37~40周,供者无先天性疾病及梅毒、艾滋病、肝炎等传染性疾病,产妇及家属对脐带用于实验研究均知情同意;DMEM/F12培养基和胎牛血清购自Gibco;人脐带间充质干细胞成骨、脂肪诱导分化培养基购自Cyagen;RNAsimple Total RNA Kit购自北京天根生化技术有限公司;2×Taq PCR MasterMix购自广州美津生物技术有限公司;THUNDERBIRD SYBR qPCR Mix购自东洋纺生物技术有限公司。
2 方法
2.1hUC-MSCs的分离与培养 无菌收集剖宫产新生儿脐带,用胶原酶II消化结合贴壁选择分离纯化hUC-MSCs,胰酶消化传代培养至28代。
2.2hUC-MSCs的生物学特性鉴定 倒置显微镜观察细胞形态,流式细胞术检测细胞表面抗原及利用人脐带间充质干细胞成骨、脂肪诱导分化培养基进行成骨、脂肪诱导检测其分化能力。
2.3RT-qPCR引物设计与合成 根据GenBank数据库,由Oligo 7.0设计,并用NCBI Primer-BLAST分析引物特异性,满足要求之后由上海英维捷基贸易有限公司合成,所有引物均经过PCR扩增产物测序,Vector NTI比对分析验证证实合格,引物序列见表1。

表1 NLRs的PCR引物序列
2.4细胞总RNA提取、鉴定和cDNA合成 RNA提取方法按天根RNAsimple Total RNA Kit说明书操作;取2 μL RNA样本用微量核酸定量仪(Thermo)检测RNA纯度以及浓度。cDNA合成按东洋纺ReverTra Ace qPCR RT Kit操作指南进行。提取的RNA样品于65 ℃变性5 min后置于冰上冷却8 min,构建20 μL反应体系,于PCR仪经37 ℃ 15 min、98 ℃ 5 min完成cDNA的合成。产物保存于-20 ℃。
2.5PCR产物鉴定 根据美津生物2×Taq MasterMix配置PCR反应体系,在PCR仪(东胜创新)上以94 ℃ 2 min,94 ℃ 30 s,61 ℃ 30 s,72 ℃ 30 s,72 ℃ 2 min,共35个循环。收集产物,取5 μL进行琼脂糖凝胶电泳(2%),观察条带大小与预期值是否一致,剩余产物送至北京六合华大基因科技股份有限公司进行测序,测序结果用Vector NTI进行比对分析。选取扩增片段序列与目的基因靶序列一致的引物作为样本分析用引物。
2.6RT-qPCR 根据东洋纺THUNDERBIRD SYBR qPCR Mix配置PCR反应体系,在荧光定量PCR仪(Bio-Rad PTC-200)上反应(95 ℃ 1 min,95 ℃ 15 s,61 ℃ 15 s,72 ℃ 30 s,共45个循环)。观察扩增动力学曲线和溶解曲线,用公式2-ΔCt方法进行相对定量,计算得出目的基因相对于管家基因GAPDH的量。
3 统计学处理
用SPSS 13.0统计软件分析。数据用均数±标准差(mean±SD)表示,采用Levene’s方差齐性检验和独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1 hUC-MSCs的形态及生长特性
经胶原酶消化分离的人脐带间充质干细胞接种24 h后贴壁。原代培养细胞除梭形MSCs以外还含有形状不规则的杂质细胞,见图1A;传代培养细胞至第3代时,细胞纯度较高,呈梭形聚集状生长,一般3~5 d便可达80%~90%融合,见图1B;传代培养至23代,细胞增殖能力有所下降,但仍保持了良好的细胞形态,见图1C;第28代后,细胞生长速度减缓、部分细胞呈平铺状、胞体变大、胞浆内出现空泡等现象,见图1D。
2 hUC-MSCs的细胞表型
流式细胞术检测显示体外培养第3代和第28代hUC-MSCs的细胞表型均为:CD29+/CD44+/CD105+/CD31-/CD34-/ CD40-/CD45-/CD106-/HLA-DR-,见图2。
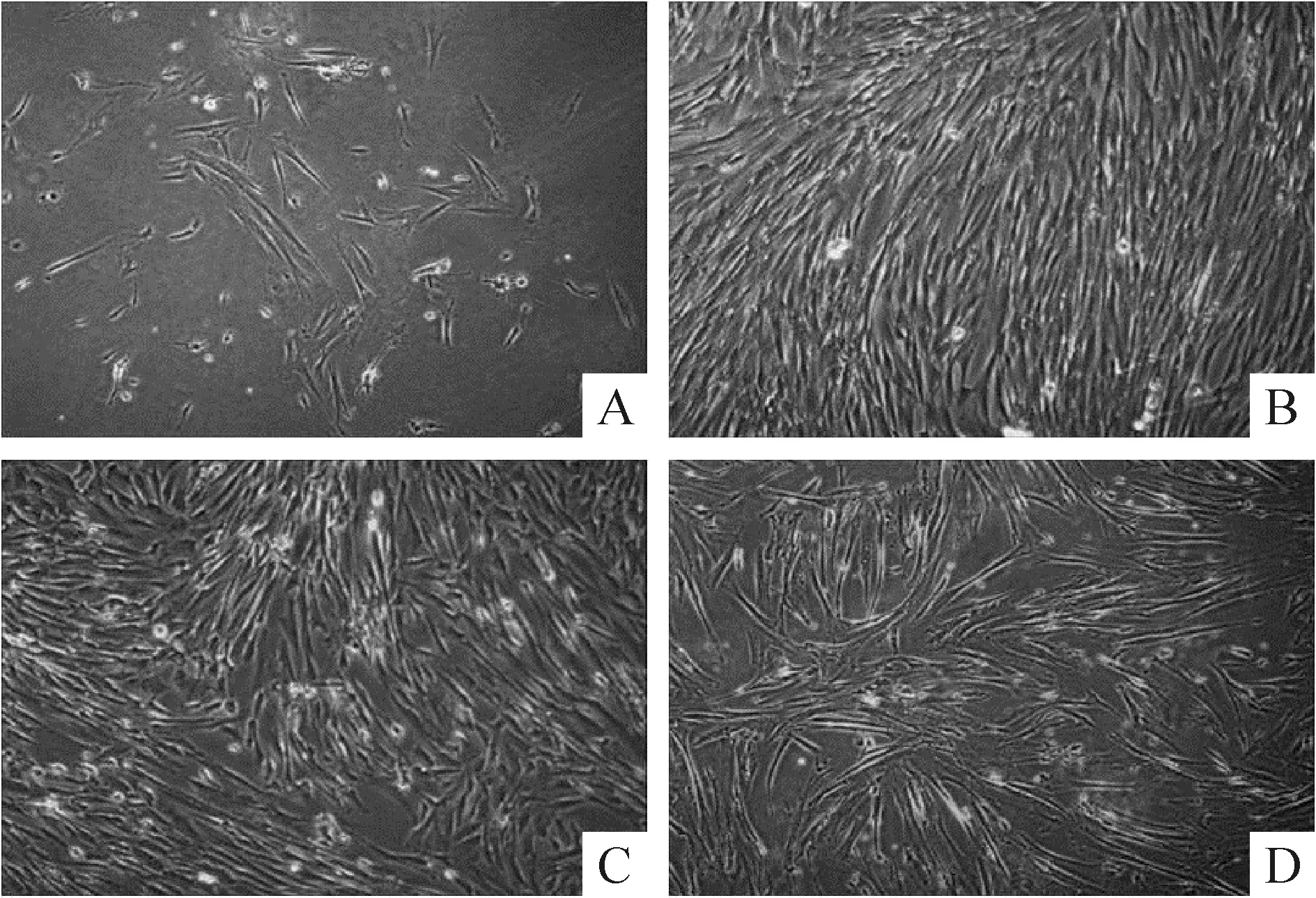
Figure 1. Morphology of human umbilical cord mesenchymal stem cells at different passages (×100). A: primary cells; B: passage 3; C: passage 23; D: passage 28.
3 hUC-MSCs的分化能力
第3和28代hUC-MSCs被成骨诱导分化后,经茜素红染色,可以见到大量红色钙化基质(图3A、B);两代细胞被脂肪诱导分化后,经油红O染色,可以见到细胞内有红色脂滴(图3C、D),表明第3和28代hUC-MSCs均具有向成骨和脂肪分化的潜能,但第28代的分化能力较第3代弱,在脂肪诱导分化过程中表现尤为明显。
4 RT-PCR产物的电泳分析结果
如图4所示,NOD1、NOD2、NLRC3、NLRC4、NLRC5、NLRP1、NLRP2、NLRP3、NLRP4、NLRP5、NLRP6、NLRP7、NLRP8、NLRP9、NLRP10、NLRP11、NLRP12、NLRP13、NLRP14、CIITA、NAIP、NLRX1和APAF1目的条带单一、清晰且与预期值相符。
5 第3和28代 hUC-MSCs的NLRs mRNA表达量比较
如图5所示,23个NLR家族成员在连续培养传代前后的hUC-MSCs中均有表达,其中NOD1、NLRC4、NLRC5、NLRP1、NLRP3、NLRP10、NAIP、NLRX1和APAF1 mRNA高表达,其余成员低表达, NLRP6和CIITA的表达尤为低下。hUC-MSCs经长期培养至第28代,除NLRP10 mRNA表达上升和NLRC5、NLRX1 mRNA表达量基本保持不变外,其余成员的表达均有所下降,其中NLRP1 mRNA表达的差异有统计学意义(P<0.05)。
讨 论
MSCs来自于中胚层,存在于包括胚胎组织等多种成体组织内,具有来源广泛、取材容易、分离纯化程序简单、可在体外连续传代培养扩增和保存等优点,已成为替代治疗和基因治疗领域中极具应用前景的干细胞。因此,研究MSCs的增殖、迁移、分化、组织修复、免疫调节功能具有十分重要的意义。研究显示,天然免疫识别受体NLR家族部分成员与MSCs的功能有密切联系[6-7]。
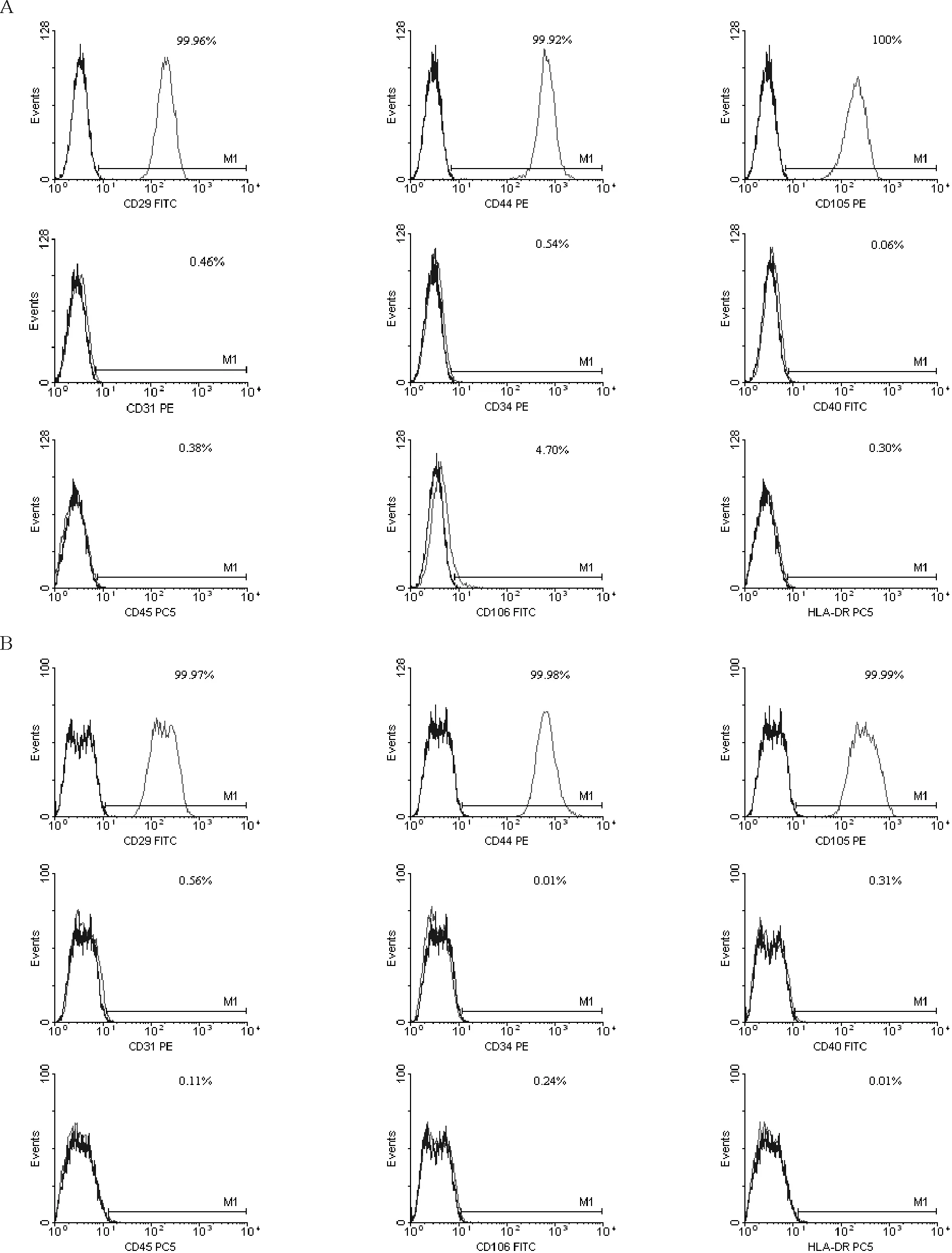
Figure 2. The flow cytometry results of cell surface markers on human umbilical cord mesenchymal stem cells at passage 3 (A) and passage 28 (B).
Kim等[6]证实hUCB-MSCs表达NLRs家族成员的NOD1和NOD2,且二者与MSCs成骨、脂肪分化和细胞外信号调节激酶(extracellular signal-regulated kinases, ERK)介导的磷酸化有关。本实验结果证实,23个NLR家族成员在连续培养传代前后的hUC-MSCs中均有表达,其中NLRP1的 mRNA在连续培养传代前后的表达差异具有统计学意义。长期连续传代培养后hUC-MSCs的成骨和脂肪分化能力降低与NOD1和NOD2的改变是否存在相关性有待进一步实验证实。已知,NLRC5通过阻止NF-κB和IFN-I信号通路中IKKα和IKKβ的磷酸化而起负性调节作用[9];NLRX1位于线粒体基质中,参与针对细菌/病毒入侵的活性氧生成反应[10-11]。NLRP10属于抗炎家族,参与体内炎症反应的精细调控[12-13]。hUC-MSCs经长期培养后,其NLRC5和NLRX1表达基本不变,NLRP10的表达上升,这是否意味着长期培养后,hUC-MSCs对免疫反应的负性调控和识别细菌/病毒入侵的能力保持不变,而抗炎能力加强,应在临床移植治疗中对此更进一步的研究。CIITA主要表达于巨噬细胞,B、T淋巴细胞和树突状细胞[14],是MHC-II表达所需的重要转录因子[15],Tse等[16]证实人MSCs不表达MHC-II,本实验发现hUC-MSCs表达的 CIITA mRNA极低,可能是其不表达MHC-II的诱因之一。NLRP12主要表达于骨髓来源的细胞,对TLR介导的NF-κB活化具有负性调控作用[17]。连续传代培养前后(第3和28代),hUC-MSCs的NLRP12 mRNA表达量降低,是否意味着TLR介导的NF-κB活化程度、细胞对外界病原体的感知能力和炎症反应发生的可能性会随着hUC-MSCs的传代培养逐渐升高,有待进一步实验验证。

Figure 3. Osteogenic (A, B; alizarin red staining, ×100) and adipogenic (C, D; oil red O staining, ×100) differentiation of human umbilical cord mesenchymal stem cells at the 3rd (A, C) and 28th (B, D) passages.

Figure 4. The agarose gel electrophoretogram of PCR products of NLRs. 1~23:NOD1, NOD2, NLRC3, NLRC4, NLRC5, NLRP1, NLRP2, NLRP3, NLRP4, NLRP5, NLRP6, NLRP7, NLRP8, NLRP9, NLRP10, NLRP11, NLRP12, NLRP13, NLRP14, CIITA, NAIP, NLRX1 and APAF1, respectively; M: marker.
综上所述,hUC-MSCs表达NLR家族所有成员的基因,不同成员之间的基因表达量存在较大差异。在培养传代过程中,hUC-MSCs大多数NLR家族成员的基因表达呈下降趋势,部分基因表达水平增加或无变化,提示体外连续传代培养对hUC-MSCs表达NLR家族成员的影响是多向性的。因NLR家族不同成员及其信号通路与细胞的增殖分化、炎症反应、免疫调节功能等作用机制密切相关,可能反映长期培养对hUC-MSCs相关功能的影响,从而为hUC-MSCs的功能干预提供研究的靶标,为改善培养细胞质量,强化细胞功能指示方向。这些都必将有利于hUC-MSCs在组织工程和临床移植治疗中的应用。

Figure 5. The mRNA expression of NLRs in passage 3 and passage 28 human umbilical cord mesenchymal stem cells. 1~23: NOD1, NLRC4, NLRC5, NLRP1, NLRP3, NLRP10, NAIP, NLRX1, APAF1, NOD2, NLRC3, NLRP2, NLRP4, NLRP5, NLRP6, NLRP7, NLRP8, NLRP9, NLRP11, NLRP12, NLRP13, NLRP14 and CIITA, respectively.Mean±SD.n=6.*P<0.05 vs passage 3.
[参 考 文 献]
[1] Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J]. Nature, 2002, 418(6893):41-49.
[2] Patel SA, Sherman L, Munoz J, et al. Immunological properties of mesenchymal stem cells and clinical implications[J]. Arch Immunol Ther Exp, 2008, 56(1):1-8.
[3] Mathews RJ, Sprakes MB, McDermott MF. NOD-like receptors and inflammation[J]. Arthritis Res Ther, 2008, 10:228.
[4] Shaw PJ, Lamkanfi M, Kanneganti TD. NOD-like receptor (NLR) signaling beyond the inflammasome[J]. Eur J Immunol, 2010, 40(3):624-627.
[5] Franchi L, Warner N, Viani K, et al. Function of Nod-like receptors in microbial recognition and host defense[J]. Immunol Rev, 2009, 227(1): 106-128.
[6] Kim HS, Shin TH, Yang SR, et al. Implication of NOD1 and NOD2 for the differentiation of multipotent mesenchymal stem cells derived from human umbilical cord blood[J]. PLoS One, 2010, 5(10): e15369.
[7] Sioud M, Mobergslien A, Boudabous A, et al. Evidence for the involvement of galectin-3 in mesenchymal stem cell suppression of allogeneic T-cell proliferation[J]. Scand J Immunol, 2010, 71(4):267-274.
[8] 许 超, 廖继东, 柳 菁, 等. 长期培养人脐带间充质干细胞的生物活性及其限制性[J]. 中国组织工程研究与临床康复, 2011, 15(10):1750-1754.
[9] Cui J, Zhu L, Xia X, et al. NLRC5 negatively regulates the NF-κB and typeⅠinterferon signaling pathways[J]. Cell, 2010, 141(3):483-496.
[10] Moore CB, Bergstralh DT, Duncan JA, et al. NLRX1 is a regulator of mitochondrial antiviral immunity[J]. Nature, 2008, 451(7178):573-577.
[11] Tattoli I, Carneiro LA, Jehanno M, et al. NLRX1 is a mitochondrial NOD-like receptor that amplifies NF-κB and JNK pathways by inducing reactive oxygen species production[J]. EMBO Rep, 2008, 9(3):293-300.
[12] Kinoshita T, Wang Y, Hasegawa M, et al. PYPAF3, a pyrin-containing APAF-1-like protein, is a feedback regulator of caspase-1-dependent interleukin-1β secretion[J]. J Biol Chem, 2005, 280(23): 21720-21725.
[13] Williams KL, Lich JD, Duncan JA, et al. The CATERPILLER protein Monarch-1 is an antagonist of Toll-like receptor-, tumor necrosis factor α-, andMycobacteriumtuberculosis-induced pro-inflammatory signals[J]. J Biol Chem, 2005, 280(48):39914-39924.
[14] Ting JP, Trowsdale J. Genetic control of MHC class Ⅱ expression[J]. Cell, 2002, 109(Suppl 2):S21-S33.
[15] Steimle V, Siegrist CA, Mottet A, et al. Regulation of MHC class Ⅱ expression by interferon-gamma mediated by the transactivator gene CIITA[J]. Science, 1994, 265(5168):106-109.
[16] Tse WT, Pendleton JD, Beyer WM, et al. Suppression of allogeneic T-cell proliferation by human marrow stromal cells: implications in transplantation [J]. Transplantation, 2003, 75(3):389-397.
[17] Lich JD, Ting JP. CATERPILLER (NLR) family members as positive and negative regulators of inflammatory responses[J]. Proc Am Thorac Soc, 2007, 4(3):263-266.

