生存素和Caspase-3蛋白在食管癌前病变及癌组织中的表达及意义
周正斌,周瑞,黄震,曹鹏,成宏伟
(泰兴市人民医院1.消化内科,2.病理科,江苏泰兴225400)
生存素和Caspase-3蛋白在食管癌前病变及癌组织中的表达及意义
周正斌1,周瑞1,黄震1,曹鹏2,成宏伟1
(泰兴市人民医院1.消化内科,2.病理科,江苏泰兴225400)
目的:探讨食管癌前病变及癌组织中生存素和Caspase-3蛋白的表达及其意义。方法:用免疫组织化学法检测63例食管癌(食管癌组)、86例食管鳞状上皮不典型增生(包含轻度、中度、重度)患者(不典型增生组)和40例正常食管黏膜(正常黏膜组)组织中生存素和Caspase-3蛋白的表达,并计算阳性表达率。分析这两类蛋白表达与食管癌临床分期的关系。结果:在正常黏膜组、不典型增生组和食管癌组中生存素的阳性表达率逐渐升高(rs=0.732,P<0.01),而Caspase-3蛋白的阳性表达率则逐渐减弱(rs=-0.687,P<0.05)。在食管癌组,生存素表达与淋巴结是否转移及临床分期(Ⅰ+Ⅱ期/Ⅲ+Ⅳ期)相关(P<0.01);Caspase-3表达与食管癌分化程度相关(P<0.01);生存素的阳性表达率与Caspase-3蛋白的阳性表达率呈负相关(r=-0.897,P<0.01)。结论:生存素和Caspase-3蛋白的异常表达可能与食管癌的发生、发展密切相关,可作为食管癌早期诊断及判断预后的肿瘤标志物。
食管癌;癌前病变;生存素;Caspase-3;不典型增生
食管癌是严重危害人类健康的恶性肿瘤之一,在我国其发病率和病死率居世界首位。由于发病和进展机制尚未完全阐明,故众多学者仍致力于寻找食管肿瘤发生、发展的原因,以求找到治疗的靶标。分子生物学的发展显示,食管癌的发生、发展过程涉及多个基因的改变,是多个基因协同作用的结果。细胞凋亡存在于肿瘤的发生、发展过程中,而且与肿瘤的血管生成、转移等有密切关系,影响肿瘤预后。生存素是凋亡抑制蛋白家族成员,是迄今发现的最强凋亡抑制因子。Caspase-3是引发细胞凋亡蛋白酶级联反应中的核心蛋白酶。为此,我们采用免疫组织化学法检测食管癌前病变及癌组织中生存素、Caspase-3蛋白的表达,并探讨其临床意义。
1 资料和方法
1.1 一般资料
收集我院2011年4月至2013年4月,86例胃镜病理诊断为食管黏膜不典型增生的患者相应组织标本(不典型增生组),其中,男58例,女28例,年龄32~79岁,平均(39.7±2.3)岁;轻度不典型增生29例,中度31例,重度26例。63例食管癌病例(食管癌组)中,男41例,女22例,年龄35~77岁,平均(40.3±3.1)岁;结合超声、CT、全身骨放射性核素扫描、PET-CT及术后病理等,按肿瘤分化程度分类:低分化36例,中+高分化27例;按TNM分期标准:T1+T215例,T3+T448例;临床分期:Ⅰ+Ⅱ期38例,Ⅲ+Ⅳ期25例;淋巴转移39例,无淋巴转移24例。取同期正常食管黏膜组织40例(正常黏膜组),其中,男27例,女13例,年龄33~76岁,平均(36.9±2.9)岁。3组性别及年龄间的差异无统计学意义。所有标本取材前患者均未经放疗或化疗,均经10%中性甲醛溶液固定,石蜡包埋,4 mm厚连续切片。
1.2 试剂
生存素和Caspase-3 IgG多抗为Newmarker公司产品,免疫组化SP检测试剂盒及DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.3 生存素和Caspase-3的检测
免疫组织化学染色采用链菌素亲生物素-过氧化物酶(SP)法。将组织切片置60℃恒温箱烘烤30 min后37℃过夜,分别进行免疫组织化学及苏木素-伊红(HE)染色。HE染色按常规进行,光镜下观察结果,进行病理分级、分期诊断,并与免疫组织化学结果对照观察。SP法按试剂盒说明书进行。将已知的阳性片作为阳性对照,用PBS液代替一抗作阴性对照。
1.4 免疫组化结果判定标准
免疫组织化学结果采用二级记分法。随机选择5个高倍(400×)视野,根据染色阳性细胞比例和染色强度分别评分。阳性细胞比例≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。染色强度分为4级:无染色为0分,淡黄色(弱阳性)为1分,棕黄色(中等阳性)为2分,棕褐色(强阳性)为3分。根据两者积分乘积判断:0分为无表达(-),l~3分为可疑表达(±),4~6分为表达(+),7~12分为强表达(++)。最终统计时将0~3分合并定为近乎无表达。结果判定由2位病理科医师独立完成,取2人的平均值作为最终结果。
1.5 统计学处理
所有数据使用Stata 7.0统计软件进行分析。采用χ2检验、秩和检验,两变量之间采用Spearman相关系数检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同食管组织中生存素和Caspase-3的表达
生存素和Caspase-3的免疫组织化学阳性产物呈黄色细颗粒状,定位于细胞质内。生存素在正常食管黏膜内无表达;在不典型增生组中25例表达阳性(29.07%);食管癌组织中45例表达阳性(71.43%)。Caspase-3在正常食管黏膜中33例表达阳性(82.50%);在不典型增生组中55例表达阳性(63.95%);食管癌组织中21例表达阳性(33.33%)。从食管正常黏膜上皮→不典型增生(轻、中、重度)→食管癌组织,生存素表达逐渐升高(rs=0.732,P<0.01),Caspase-3表达逐渐减弱(rs=-0.687,P<0.05)。见图1和表1。
2.2 生存素和Caspase-3表达与食管癌临床病理指标的关系
食管癌低分化组与中高分化组中生存素的阳性表达率间无明显差异(P>0.05);生存素在食管癌T分期间的表达亦无明显差异(P>0.05)。无淋巴结转移组生存素阳性表达率低于淋巴结转移组(χ2=13.405,P<0.01);临床分期Ⅰ+Ⅱ期阳性表达率低于Ⅲ+Ⅳ期(χ2=18.115,P<0.01)。Caspase-3在食管癌低分化组阳性表达率低于中高分化组(χ2=11.433,P<0.01);T1+T2组与T3+T4组(χ2=0.127,P>0.05)、无淋巴结转移组与淋巴结转移组(χ2=0.269,P>0.05)、临床分期Ⅰ+Ⅱ期与Ⅲ+Ⅳ期(χ2=0.119,P>0.05)之间比较,Caspase-3阳性表达率的差异无统计学意义。见表2。

图1 生存素和Caspase-3在各组标本中的表达(SP法×400)

表1 不同食管组织中生存素和Caspae-3的阳性表达率
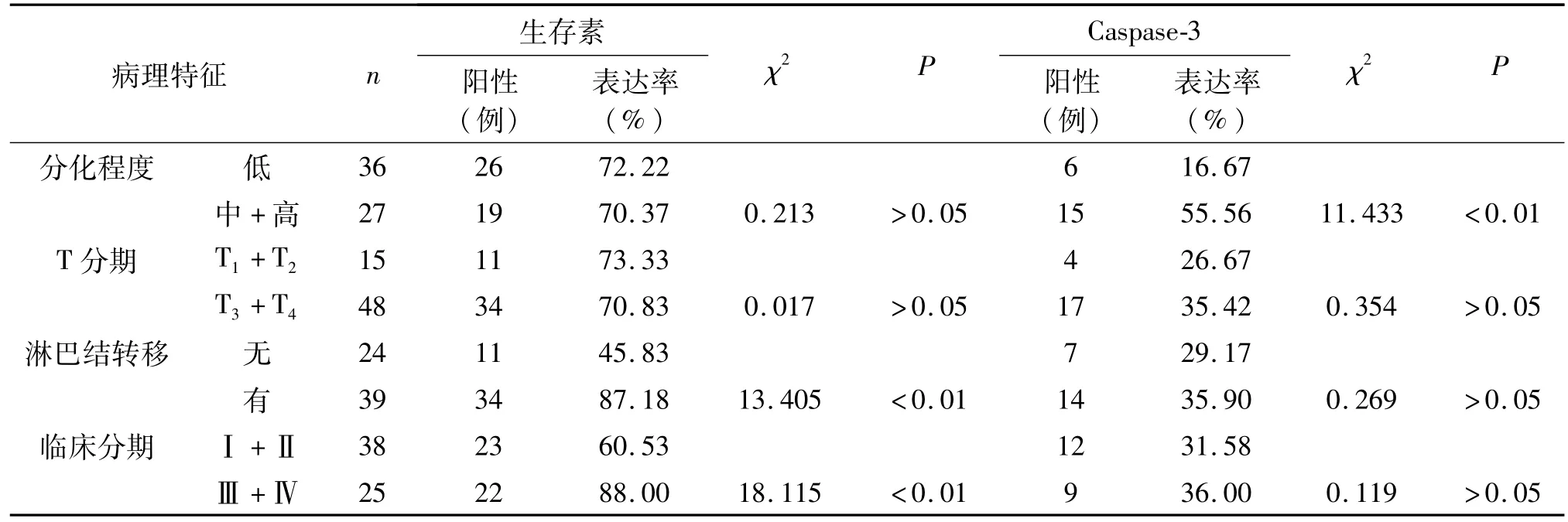
表2 生存素、Caspase-3表达与食管癌临床病理指标的关系
2.3 食管癌组织中生存素、Caspase-3表达的相关性
63例食管癌组织中,13例生存素表达“+”,其中7例Caspase-3表达“-”、5例“+”、1例“++”;32例生存素表达“++”,其中30例Caspase-3表达“-”、1例“+”、1例“++”。生存素与Caspase-3两者表达呈负相关(r=-0.897,P<0.01)。
3 讨论
肿瘤的发生是一个多因素、多基因、多阶段的过程。上皮细胞异常增生是食管癌易患人群最早期的变化,表现为基底细胞过度增生、间变和原位癌,是食管的癌前病变。在分子水平上,癌变涉及众多原癌基因、抑癌基因以及蛋白质的改变。直接或间接抑制细胞增殖、癌变的基因,称为抑癌基因。各种致癌因素的共同作用导致原癌基因的启动和抑癌基因的失活,从而导致癌症的发生。
生存素是凋亡抑制蛋白(inhibitor of apoptosis,IAP)家族中相对分子质量最小的一个,具有抑制细胞凋亡与调节细胞周期两种功能。正常情况下生存素仅表达于胚胎及分化不成熟的组织,而在成年人终末分化组织中并无表达,病理情况下会表达于大多数恶性肿瘤[1-2],提示生存素在肿瘤的发生中可能具有重要作用。本研究中,从食管正常黏膜上皮→不典型增生(轻、中、重度)→食管癌组织,生存素表达逐渐升高(rs=0.732,P<0.01)。结果表明,食管在癌变过程中生存素表达上调,可能使肿瘤细胞逃避细胞周期检测点,逃避凋亡,细胞增殖失控,导致肿瘤的形成。生存素基因的过度表达可能是食管癌发生中较早期出现的分子异常事件,可作为判断食管癌生物学行为的一个指标。本研究中,生存素在淋巴结转移组中的表达率明显高于无淋巴结转移组,临床分期Ⅲ+Ⅳ期组的表达率明显高于Ⅰ+Ⅱ期(P<0.01),提示生存素表达与淋巴结是否转移及临床分期(Ⅰ+Ⅱ期/Ⅲ+Ⅳ期)相关[3]。这说明生存素可使食管癌恶性程度增加,侵袭力增强,使得肿瘤的扩散、转移更易发生[4],因此生存素可作为食管癌预后判断的肿瘤标志物[5]。
Caspase-3被认为是各种凋亡刺激因子启动Caspase家族引起细胞凋亡的关键蛋白酶,是细胞凋亡的主要执行者,也是凋亡蛋白酶级联反应的必经之路。本研究中,Caspase-3的表达有从食管正常黏膜上皮→不典型增生(轻、中、重度)→食管癌组织逐渐减弱的趋势(rs=-0.687,P<0.05),提示Caspase-3表达的丧失促进了食管癌的发生。Caspase-3在食管癌低分化组中的表达明显低于中高分化组(P<0.01)。可见,Caspase-3表达与食管癌分化程度相关。本研究同时发现,Caspase-3表达与肿瘤T分期、淋巴结转移与否及临床分期无关。Caspase-3蛋白在食管癌中的低表达,以及与食管癌分化程度的关系,说明Caspase-3表达的丧失有助于食管癌的形成,并且能够预示其恶性程度,但与食管癌的浸润、转移能力关系不大。
已有研究发现,生存素通过抑制Caspase-3的活性,抑制细胞凋亡。其抑制机制可能为[6]①生存素直接影响Caspase-3的抗凋亡作用。②Fas和细胞增殖信号刺激生存素转入细胞核与周期蛋白激酶CDK4结合,加快细胞由G1向S期转换,同时抑制proCaspase-3激活,从而发挥抗凋亡作用。③Thr34位点磷酸化的生存素与Caspases结合而发挥抗凋亡作用。④生存素可与线粒体释放的第二个线粒体衍生的半胱天冬酶激活蛋白(SMAC)结合,保护凋亡抑制蛋白(IAPs)中的X连锁凋亡抑制蛋白(XIAP)等,而发挥间接抑制作用。本研究结果提示,生存素可能通过抑制Caspase-3的活性,减低Caspase-3介导的细胞凋亡作用,从而导致食管癌的发生。
综上,生存素、Caspase-3可能协同参与了食管癌的发生、发展,进一步研究两者表达与食管癌的关系,有助于了解食管癌的生物学行为,探索有效早期诊断的方法,判断食管癌的预后[7],并提供靶向治疗的新途径[8]。
[1]Yang X,Xiong G,Chen X,et al.Survivin expression in esophageal cancer:correlation with p53 mutations and promoter polymorphism[J].Dis Esophagus,2009,22(3):223-230.
[2]Deng H,Zhen H,Fu Z,et al.The antagonistic effect between STAT1 and survivin and its clinical significance in gastric cancer[J].Oncol Lett,2012,3(1):193-199.
[3]Zhu H,Wang Q,Hu C,et al.High expression of survivin predicts poor prognosis in esophageal squamous cell carcinoma following radiotherapy[J].Tumour Biol,2011,32(6):1147-1153.
[4]Chiu CW,Nozawa H,Hanahan D.Survival benefit with proapoptoticm olecular and pathologic responses from dual targeting ofmammalian targetof rapamycin and epidermal growth factor receptor in a preclinical model of pancreatic neuroendocrine carcinogenesis[J].JClin Oncol,2010,28(29):4425-4433.
[5]Feng YB,Lin DC,Shi ZZ,et al.Overexpression of PLKI is associated with poor survival by inhibiting apoptosis via enhancement of survivin level in esophageal squamons cell carcinoma[J].Int JCancer,2009,2(3):578-588.
[6]周正斌,杨大明,沈琴,等.熊去氧胆酸诱导肝癌细胞株HepG2凋亡及对Survivin、Caspase-3表达的影响[J].胃肠病学和肝病学杂志,2006,15(5):492-496.
[7]Takeno S,Yamashita S,Takahashi Y,et al.Survivin expression in esophageal squamous cell carcinoma:its prognostic impact and splice variant expression[J].Eur JCardiothorac Surg,2010,37(2):440-445.
[8]Schuchert MJ,Luketich JD,Landreneau RJ.Management of esophageal cancer[J].Curr Probl Surg,2010,47(11):845-946.
Expression and significance of survivin and Caspase-3 protein in esophageal precancerosis and cancer tissue
ZHOU Zheng-bin1,ZHOU Rui1,HUANG Zhen1,CAO Peng2,CHENG Hong-wei1
(1.Department of Gastroenterology,2.Department of Pathology,Taixing People′s Hospital,Taixing Jiangsu 225400,China)
Objective:To investigate the relationship between the expression of survivin and Caspase-3 protein and the biological behaviors of esophageal precancerosis and cancer tissue.M ethods:The expressions of survivin and Caspase-3 proteins in 63 esophageal cancer specimens,86 atypical hyperplasia specimens(include light,moderate and high grade hyperplasia),and 40 normal esophagealmucous specimens,were investigated with S-P immunohistochemical technique,and their correlation with pathologic characteristic,and clinical stages of esophageal cancerwere analyzed.Results:The positive expression rate of survivin protein showed higher trend(rs=0.732,P<0.01),while,that of Caspase-3 protein showed lower trend(rs=-0.687,P<0.05),from normal esophagealmucous,to light,moderate and high grade hyperplasia,and to esophageal cancer.In esophageal cancer tissue,the expression of survivin proteinswas positively correlated with the lymph nodemetastasis and clinical stages(P<0.01),and that of Caspase-3 protein was positively correlated with the degree of differentiation(P<0.01).Moreover,therewas a negative association between the survivin and Caspase-3 protein expression(r=-0.897,P<0.01).Conclusion:The expression of survivin and Caspase-3 may be significantly related to the occurrence and progression of esophageal carcinoma,and helpful in predicting the biological behavior and prognosis of esophageal cancer.
esophageal cancer;precancerosis;survivin;Caspase-3;atypical hyperplasia
R730.43
A
1671-7783(2014)04-0342-04
10.13312/j.issn.1671-7783.y140132
周正斌(1970—),男,江苏泰兴人,副主任医师,主要从事消化道肿瘤的临床诊治。
2014-05-19 [编辑]陈海林

