地乌三萜皂苷W1对破骨细胞分化和骨吸收功能的影响
杨悦 孔祥英 万红叶 苏晓慧 林娜
地乌三萜皂苷W1对破骨细胞分化和骨吸收功能的影响
杨悦 孔祥英 万红叶 苏晓慧 林娜
目的探讨地乌三萜皂苷类成分W1对体外破骨细胞分化及骨吸收功能的影响。方法3个不同浓度(0.0625,0.125,0.25 μg/ml)的W1与核因子-κB受体活化因子配体(receptor activator of nuclear factor kB ligand,RANKL)诱导的小鼠单核/巨噬细胞RAW 264.7共孵育7天,抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色观察TRAP阳性多核细胞的形成,甲苯胺蓝染色及扫描电镜观察骨吸收陷窝的形成,图像分析计算骨吸收陷窝面积百分比;同3个浓度的W1与RANKL诱导的RAW264.7细胞共孵育24小时后收集细胞上清液,放射免疫法检测肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的含量;甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)法检测W1对RAW264.7细胞毒性影响。结果RANKL组诱导RAW 264.7细胞形成多量TRAP阳性多核细胞,形成明显的骨吸收陷窝,并诱导TNF-α在RAW264.7细胞上清中异常高表达;与RANKL组相比,3个浓度的W1均能显著减少TRAP阳性细胞数(P<0.01),显著减少骨吸收陷窝面积(P<0.01,P<0.001,P<0.001),明显降低TNF-α的表达量(P<0.05,P<0.01,P<0.01),且未观察到对RAW264.7的细胞毒性。结论W1对由RANKL诱导的体外破骨细胞分化和骨吸收功能有一定的负调节作用。
地乌三萜皂苷W1; 小鼠单核/巨噬细胞RAW264.7; 肿瘤坏死因子α; 骨吸收
地乌总皂苷是民间治疗风湿疼痛的单验方地乌的主要活性成分群[1],研究表明其具有抗炎免疫作用,且无明显毒副反应[2-3]。笔者在前期的地乌总皂苷活性成分筛选研究中发现,地乌三萜皂苷W1(以下简称W1)在地乌总皂苷中的含量接近最高,且具有较强的镇痛抗炎活性及较好的骨免疫调节作用。为了有利于地乌治疗类风湿性关节炎(rheumatoid arthritis,RA)机制的阐明及地乌总皂苷的进一步研发,本研究拟通过核因子κB受体活化因子配体(receptor activator of nuclear factor kB ligand,RANKL)诱导小鼠单核/巨噬细胞RAW 264.7细胞建立体外破骨细胞分化模型,观察W1对破骨细胞分化、骨吸收功能及炎性因子肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)表达的影响,相关结果报道如下。
1 材料
1.1 细胞
小鼠单核/巨噬细胞系RAW 264.7(由中国医学科学院基础医学研究所细胞库提供),加入含10%的胎牛血清、1%双抗和谷氨酰胺的高糖(dulbecco’s modified eagle’s medium,DMEM)培养基,置于5% CO2,37℃培养箱中常规培养。细胞生长至80%~90%融合后进行传代,2~3天传代1次。
1.2 试剂
胎牛血清,高糖DMEM培养基(美国GIBCO公司);小鼠重组可溶性核因子κB受体活化因子配体(soluble receptor activator of nuclear factor kB ligand,sRANKL)(英国Peprotech公司);3-(4,5-二甲基噻唑-2)-2,5二苯基四氮唑溴盐(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl tetrazolium bromide,MTT)、甲苯胺蓝、多聚赖氨酸、抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒(美国Sigma公司);W1(广州康和药业有限公司提供);牛骨片(北京荣志海达生物科技有限公司);小鼠肿瘤坏死因子α(tumor necrosis factor,TNF-α)放射免疫试剂盒(北京普尔伟业生物科技有限公司)。
1.3 仪器
CO2培养箱(上海力申科学仪器有限公司,HF151UV);生物安全柜(上海力申科学仪器有限公司,HFsafe-TE1200);全自动酶标仪(Thermo公司,MK3型)。
2 方法
2.1 药物制备
地乌三萜皂苷W1由广州康和药业有限公司提供。化学名称为:3-O-α-L-吡喃鼠李糖(1→2)-β-D-吡喃葡萄糖-齐墩果酸-28-O-α-L-吡喃鼠李糖(1→4)-β-D-吡喃葡萄糖-(1→6)-β-D-吡喃葡萄糖苷。纯度为99.40%。
2.2 玻片与骨片的预处理
将直径为8 mm的48孔板专用细胞爬片,充分清洗,高压灭菌,超净台内多聚赖氨酸包被。将由牛股骨皮质部分制成的直径6 mm的骨片,保存于4℃下70%乙醇中,实验前先将骨片或包被过的细胞爬片置于培养板中,加入培养基冲洗3遍,孵育过夜,然后弃去旧液,接种细胞。
2.3 W1对破骨细胞生成的影响
将对数生长期RAW264.7细胞消化,制备单细胞悬液,以5×103个/孔的密度接种于预置有细胞爬片的48孔板中,每孔0.5 ml培养基,除空白对照组外,其它组均加入50 ng/ml RANKL诱导,给药组同时加入W1使其浓度分别为0.0625、0.125、0.25 μg/ml,每组3个复孔。置于37℃、5%CO2培养箱中孵育培养,每2天换液1次,换液同时更换培养液中的诱导因子及药物。诱导培养7天,用PBS冲洗细胞爬片3次,然后用4%多聚甲醛固定15分钟,去离子水冲洗2遍,加入按照说明书配制的TRAP染液,37℃水浴孵育30分钟,光镜下观察到含3个胞核以上且呈TRAP染色阳性的多核巨噬细胞为破骨细胞,计算阳性细胞平均值。
2.4 W1对骨吸收陷窝形成的影响
将对数生长期RAW264.7细胞消化,制备单细胞悬液,以2×103个/孔的密度接种于置有牛骨片的96孔板中,除正常对照组外,其它组均加入50 ng/ml RANKL诱导,给药组同时加入W1使其浓度分别为0.0625、0.125、0.25 μg/ml,每组3复孔。隔天换1次液,各组细胞置37℃、5%CO2培养箱中孵育培养7天。第7天取出骨片,用0.25 mol/L NH4OH溶液超声洗涤10分钟×3次,蒸馏水冲洗,梯度酒精(80%,90%,95%,100%I,100%II)脱水,每个梯度3分钟。室温1%甲苯胺蓝染色8分钟左右。蒸馏水冲洗,光镜下观察,用Image Pro Plus软件分析整张骨片上骨陷窝的数量及面积百分比。将牛骨片超声清洗干净后,烘干、装台(粘胶)、表面真空离子喷金,扫描电子显微镜下观察并摄像。
2.5 放射免疫法检测W1对TNF-α表达的影响
将对数生长期RAW264.7细胞消化制备单细胞悬液,以1×104个/孔接种于96孔培养板,待细胞长满80%,加入含0.1%胎牛血清(fetal calf serum,FBS)的培养基,静息24小时后,除正常对照组外,其它组均加入50 ng/ml RANKL诱导,给药组同时加入W1使其浓度分别为0.0625、0.125、0.25 μg/ml,培养24小时,收集细胞上清液,按碘[I125]-肿瘤坏死因子放射免疫试剂盒说明步骤进行TNF-α含量测定,γ放免计数仪直接给出检测数值。
2.6MTT法检测W1对RAW264.7细胞毒性的影响
将对数生长期RAW264.7细胞消化,制备单细胞悬液,以1×104个/孔接种于96孔板,每孔200 μl,培养过夜。除正常对照组外,其它组均加入50 ng/ml RANKL诱导,给药组同时加入W1使其浓度分别为0.0625、0.125、0.25 μg/ml。培养24小时后,每孔加入MTT(5 mg/ml) 10 μl,反应4小时后,小心吸去培养液,每孔加入150 μl 二甲基亚砜(dimethyl sulfoxide,DMSO),震荡10分钟充分溶解,酶标仪在492 nm波长检测吸光度值。
2.7 统计学处理
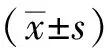
3 结果
3.1 W1对破骨细胞生成的影响
诱导培养7天后进行TRAP染色,与空白对照组相比,RANKL组出现多个体积较大、胞浆呈玫红色的多核细胞(核≥3个)(P<0.001);与RANKL组相比,在不同浓度的W1作用下,破骨细胞数量均明显降低(P<0.01),说明W1具有明显的抑制RANKL诱导的RAW264.7细胞形成破骨细胞的能力,见图1及表1。


图1 TRAP染色图片(×400)

表1 W1对RAW264.7细胞诱导分化的TRAP阳性细胞数目的影响
注:与空白对照组比较,aP<0.001;与RANKL组比较,bP<0.01
3.2 W1对骨吸收陷窝形成的影响
药物作用7天后,骨片经甲苯胺蓝染色,光镜下可见蓝紫色圆形、椭圆形或不规则形,大小不一,边界清晰的吸收陷窝;扫描电镜下观察,骨吸收陷窝的变化趋势与光镜结果一致,同一标本可清楚识别形态相似的骨吸收陷窝。RANKL组可见较大面积的骨吸收陷窝形成;与RANKL组相比,0.0625、0.125、0.25 μg/ml的W1均可显著抑制骨吸收陷窝形成,减少骨吸收陷窝面积(P<0.01,P<0.001,P<0.001), 说明W1具有明显的抑制RANKL诱导的RAW264.7细胞形成破骨细胞的能力,见图2、图3及表2。

图2 骨吸收陷窝甲苯胺蓝染色图片(×200)

图3 骨吸收陷窝扫描电镜图片(×200)

表2 W1对骨吸收陷窝形成面积的影响
注:与RANKL组比较,aP<0.01,bP<0.001
3.3W1对RANKL诱导RAW264.7细胞TNF-α表达的影响
RANKL组TNF-α水平较空白对照组显著升高(P<0.01),说明RANKL诱导可显著提高TNF-α在RAW264.7细胞中的分泌水平;0.0625、0.125、0.25 μg/ml的W1均可显著降低由RANKL诱导的TNF-α在RAW264.7培养上清中的异常高表达(P<0.05,P<0.01和P<0.01),说明W1可显著抑制RAW264.7细胞分泌TNF-α,见表3。

表3 W1对RANKL诱导RAW264.7细胞TNF-α表达的影响
注:与空白对照组比较,aP<0.01;与RANKL组比较,bP<0.05,cP<0.01
3.4 W1对RAW264.7细胞毒性的影响
MTT比色法所测各组吸光度值间接反映活细胞数量。结果显示,在有/无RANKL诱导的情况下,W1在所观察的浓度范围内,对RAW264.7均不具有明显的增殖抑制作用,无细胞毒作用,见表4、表5。

表4 W1对RANKL诱导情况下细胞毒性的影响

表5 W1对无RANKL诱导情况下细胞毒性的影响
4 讨论
破骨细胞在骨破坏中所起的关键作用已被研究所证实[4]。作为体内唯一具有骨破坏能力的细胞,破骨细胞来源于单核/巨噬细胞系的造血前体细胞,并由这些前体细胞经分化、融合而成终末多核巨细胞[5]。RAW264.7细胞是小鼠源性破骨前体细胞,目前,通过RANKL诱导RAW264.7细胞获得成熟破骨细胞是公认的体外研究破骨细胞分化的经典体系[6-7]。该细胞体系不仅表达巨噬细胞集落刺激因子(macrophage-colony stimulating factor,M-CSF), 还表达原癌基因c-fms(the proto-oncogene fms,c-fms)癌基因受体(c-fms receptor)和核因子κB受体活化因子(receptor activator of nuclear factor κB ligand,RANK),这也解释了RAW264.7只需要RANKL诱导就能生成破骨细胞的原因[8-9]。本研究利用RANKL诱导RAW264.7细胞向成熟破骨细胞分化方法,观察到在RANKL诱导下,RAW264.7细胞由类圆形单核细胞逐渐转变为胞体较大、边缘不整齐、周围有刷状缘(褶皱)和伪足的多核细胞,且在诱导的第7天左右多核细胞数量达到高峰,经TRAP染色可见多量胞浆成玫红色的多核(核≥3个)TRAP阳性细胞,提示了本实验条件下,破骨细胞在体外的诱导分化成功。当给予不同浓度的W1干预后,TRAP阳性细胞数目均显著减少,提示了W1可抑制破骨细胞的分化。
破骨细胞形态和功能成熟是两个相对独立的阶段,功能成熟的破骨细胞可黏附于骨的表面并迁移造成不规则、波状的哈氏陷窝,形成骨侵蚀[10],因此通过骨片上的陷窝面积反映破骨细胞的骨吸收活性,是目前定量评定体外培养破骨细胞活性的可靠方法之一[11]。本实验发现RANKL诱导培养7天后,牛骨片经甲苯胺蓝染色,光镜下可见圆形、椭圆形、串珠形、腊肠形或不规则形等呈蓝紫色异染的陷窝,散在分布,边界清晰,大小不一;扫描电镜下观察,骨吸收陷窝的变化趋势与光镜结果一致,同一标本可清楚识别形态相似的骨吸收陷窝,边界轮廓清晰,陷窝底部粗糙,纤维纹路清晰可见,表明了本实验条件下所诱导形成的破骨细胞具有骨吸收功能。当给予不同浓度的W1干预后,骨吸收陷窝面积和数量显著减少,提示了W1可抑制破骨细胞的骨吸收功能。
TNF-α不仅能直接诱导破骨细胞分化并刺激其活性,还能通过影响OPG/RANKL/RANK信号系统,以旁分泌形式调节破骨细胞分化,刺激骨吸收[12]。本实验发现,TNF-α经RANKL诱导在RAW264.7细胞中异常高表达,而一定浓度的W1能显著抑制TNF-α的表达水平,且呈现一定的量效关系,提示W1能有效降低关键炎症因子的表达。地乌总皂苷对RA的抑制作用已被前期的实验研究所证实,目前已知的相关作用机制是通过上调CIA小鼠外周血免疫负相调控受体细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)以及细胞因子白介素10(interleukin 10,IL-10)、白介素4(interleukin 4,IL-4)、干扰素-γ(interferon-gamma,IFN-γ)的表达水平,抑制滑膜细胞增殖,减少血管翳形成,减少关节软骨破坏,改善RA病情[13-15]。本研究通过体外实验证明了地乌总皂苷最重要的活性成分之一W1能显著抑制细胞因子TNF-α在体外培养的RAW264.7细胞中的分泌,同时有效负调节RANKL诱导的破骨细胞分化和骨吸收,这可能是W1发挥免疫抗炎作用的药效分子机制之一。相关研究结果将为地乌总皂苷治疗RA机制的阐明提供初步的科学依据。
[1]邴飞虹,韩林涛,张国斌,等.蜈蚣三七的化学成分及免疫抑制活性[J].中国药科大学学报,2008,39(6):496-499.
[2]邴飞虹,江俊.蒋冠斌地乌总甙抗炎免疫作用研究[J].湖北中医杂志,1995,17(118):82.
[3]邴飞虹,江俊,蒋冠斌.地乌总甙对动物免疫功能的影响[J].实用中医药杂志,1996,12(2):40.
[4]Lipsky PE. Osteoimmunology:a new area of rheumatology research[J].Nat Clin Pract Rheumatol,2008,4(3):111-116.
[5]董伟,戚孟春,刘强,等.阿伦膦酸盐在不同分化阶段对破骨细胞生成及骨吸收功能的影响[J].口腔医学研究,2011,27(3):195-198.
[6]Jones DH,Nakashima T,Sanchez OH,et al. Regulation of cancer cell migration and bonemetastasis by RANKL[J].Nature,2006,440:692-696.
[7]徐嘉莹,刘薇,黄宇光.Calpain及抑制剂对小鼠破骨细胞分化的作用[J].中华骨质疏松和骨矿盐疾病杂志,2011,4(2):101-107.
[8]Hsu H,Lacey D,Dunstan C,et al. Tumor necrosis factor receptor family member RANK mediates osteoclast differentiation and activation induced by osteoprotegerin ligand [J]. Proc Natl Acad Sci USA,1999,96(7):3540-3545.
[9]Shadduck RK,Waheed A,Mangan KF,et al. Preparation of a monoclonal antibody directed against the receptor for murine colony -stimulating factor-1[J]. Exp Hematol,1993,21(4):515-520.
[10]甘可,冯小可,郭婕,等.补肾方骨青颗粒对破骨细胞分化及骨吸收功能的影响[J].江苏医药,2013,39(12):1377-1380.
[11]林静吟.中医药治疗骨质疏松症[J].广东药学,2004,14(3):47-49.
[12]Liu L,Yang P,He H.Leptin increases in Vogt-Koyanagi-Harada( VKH) disease and promotes cell proliferation and inflammatory cytokine secretion[J].Br J Ophthalmol,2008,92(4):557.
[13]张国斌. 蜈蚣三七提取物抗类风湿性关节炎免疫机理的研究[D].武汉:湖北中医学院,2006.
[14]董梦久,姜爱莉. 银莲花胶囊治疗类风湿性关节炎40例[J].湖北中医杂志,1996,18(2):8-9.
[15]江俊. 地乌总苷对佐剂性关节炎大鼠特异性免疫功能影响的实验研究[J].中药材,2002,25(3):194-195.
(本文编辑:董历华)
EffectoftriterpenesaponinW1fromrhizomeofAnemoneFlaccidonosteoclastsdifferentiationandboneresoroption
YANGYue,KONGXiang-ying,WANHong-ye,etal.
InstituteofChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,Beijing100700,China
LINNa,E-mail:linna888@163.com
ObjectiveTo observe the effect of W1from rhizome of Anemone Flaccid on osteoclasts formation and bone resoroption in vitro.MethodsRAW264.7 cells induced by RANKL were cultured with three variable concentration(0.0625,0.125,0.25 μg·ml-1)of W1in vitro for 7 days. The influence of W1on osteoclasts differentiation was assessed by osteoclast-like number and tartrate resistant acid phosphatase (TRAP) activity; resorption lacunae were stained by toluidine blue and were visualized by Philips XL30 scanning electron microscope. The number of TRAP+ cells and the percentage of resorption pits were counted. RAW264.7 cells induced by RANKL were incubated with three variable concentration of W1 in vitro for 24 hours, the level of TNF-α in cell culture supernatant was examined by Iodine[125I] Tunmor Necrosis Factor Radioimmunoassay kit; RAW264.7 cell viability was assayed by MTT.ResultsRANKL could induce RAW264.7 cells to form TRAP positive multinucleated cells and form bone resorption pits on bone. RANKL could induce abnormally high expression of TNF-α in RAW264.7 cells. W1(0.0625,0.125,0.25 μg· ml-1)could decrease the number of TRAP+ cells (P<0.01) as well as the area of bone resorption pits(P<0.01,P<0.001,P<0.001),and showed no cytotoxicity to RAW264.7; W1(0.0625-0.25 μg· ml-1)could suppresse the expression of TNF-a(P<0.05,P<0.01,P<0.01).ConclusionRANKL induced osteoclastogenesis in these monocytic cells,and W1inhibited RANKL-induced tumor necrosis factor-α production and osteoclast differentiation and bone resorption pit formation.
Triterpene saponin W1 from rhizome of Anemone Flaccid ; RAW264.7; Tumor necrosis factor-α; Bone resoroption
国家科技重大专项(2011ZX09101-006-03);北京市自然科学基金(7112096);中国中医科学院基本科研业务费自主选题(ZZ070836)
100700 北京,中国中医科学院中药研究所中药理论与本草文献研究中心
杨悦(1989- ),女, 2011级硕士研究生。研究方向:中药药理研究。E-mail: yangyue8675658@163.com
林娜(1963- ),女,博士,研究员,博士生导师。研究方向:中药药性理论与中药药理。E-mail:linna888@163.com
R285.5
A
10.3969/j.issn.1674-1749.2014.03.007
2013-12-03)

