Pd/Ti电极上2,4,6-三氯酚还原脱氯:条件优化及降解途径
魏学锋,孙治荣(1.北京工业大学环境与能源工程学院,北京 100124;2.河南科技大学,河南 洛阳 471023)
Pd/Ti电极上2,4,6-三氯酚还原脱氯:条件优化及降解途径
魏学锋1,2,孙治荣1*(1.北京工业大学环境与能源工程学院,北京 100124;2.河南科技大学,河南 洛阳 471023)
利用电沉积法制备了 Pd/Ti电极,用于 2,4,6-三氯酚(2,4,6-TCP)的电还原脱氯.采用单因素实验和响应面分析法, 探讨了 2,4,6-TCP脱氯试验条件; 根据实验结果, 拟合出了脱氯中各步骤的反应速率常数. 结果表明,2,4,6-TCP初始浓度为80mg/L时,优化的脱氯参数为电流为5mA,支持电解质Na2SO4浓度为0.05mol/L,阴极电解液初始pH值为2.40.在优化条件下, 2,4,6-TCP在80min内完全脱氯; 2,4,6-TCP的还原脱氯符合准一级反应动力学,主要脱氯途径为2,4,6-TCP→2,6-DCP→2-CP→苯酚.
Pd/Ti电极;2,4,6-三氯酚;电催化;还原脱氯;动力学
氯酚类化合物(CPs)作为杀虫剂、造纸、医药、化工、防腐剂等行业的中间体,在工业中广泛应用.由于毒性大、难降解、化学稳定性和热稳定性高,给自然环境造成一定危害,中国环境监测总站和美国国家环保署都将 CPs列为优先控制污染物[1-2].随着氯原子数增大,CPs亲脂性越大,被生物体摄取的可能性增大,毒性越大.2,4,6-三氯酚(2,4,6-TCP)由于其难降解特性,一旦进入水体会对水生生物产生持久性毒性效应,是6种三氯酚异构体中需优先控制的污染物[3].
CPs中氯原子强烈吸引电子云使苯环上电子云密度降低,难以从苯环上获取电子而发生氧化反应,相反电子云密度较低的苯环易受到还原剂的攻击,发生亲核取代,比较适合于还原脱氯.化学还原法用于氯代有机物的脱氯,已经备受关注.研究较多的有零价金属体系(如零价铁)[4-7]和二元金属催化体系(如Pd-Fe和Pd-Mg等)[8-11].但化学还原脱氯法存在反应速率低、金属溶解等缺点.
电催化加氢脱氯法(ECH)以电子为强还原剂,电解水或者质子产生活性氢,通过加氢脱氯能将氯代有机物转化为无毒或低毒产物,具有应用条件温和、设计简易方便、经济高效等优点[12-15],是最有前景的CPs脱氯途径之一.钯(Pd)与氢(H)的结合能相对较低,具有优异的吸附和储存H的能力[16-18],已成为ECH过程优选的电极材料.
本研究以化学性质稳定的钛(Ti)网为基质,采用电沉积法制备出 Ti网负载 Pd(Pd/Ti)阴极,用于2,4,6-TCP的ECH脱氯.并进一步探讨TCP在脱氯转化过程中,可能生成的二氯酚(DCP)和一氯酚(CP)等中间产物的脱氯反应途径及其动力学,初步研究2,4,6-TCP的脱氯规律,为电催化还原脱氯法处理CPs提供参考.
1 材料与方法
1.1 试剂与仪器
PdCl2粉(分析纯),购自西北有色金属研究总院; Ti网购自河北安平县线材筛网厂,使用前先放在热碳酸钠溶液中去除油脂,在煮沸的草酸溶液中去除氧化物,用去离子水洗至中性,贮存在乙醇中备用;2,4,6-TCP(分析纯)购自美国 Sigma Aldrich公司;所用其他试剂均为分析纯,购自北京化工厂;所有溶液均用Millipore-Q水配制.
电化学工作站(上海辰华,CHI660C);扫描电子显微镜(SEM,日立 SU8020);X射线衍射仪器(XRD,岛津 XRD-7000);高效液相色谱仪(HPLC, Waters 2489);电感耦合等离子体原子发射光谱仪(ICP-AES,美国热电公司IRIS Advantage型);精密恒流恒压源(BJ1790B,北京无仪美达科技有限公司);WTW3420型pH计(德国).
1.2 实验步骤
采用电沉积法制备 Pd/Ti催化阴极.以预处理过的Ti网(有效尺寸2cm×2cm)为基质,沉积液为50mL浓度为7mmol/L的PdCl2溶液,用浓盐酸调节初始pH值为0.2,加入0.09mmol/L十六烷基三甲基溴化铵(CTAB)为稳定剂;用恒定电流50mA沉积70min.新制备的电极在 60℃下干燥过夜.分别用SEM和XRD表征表面形貌和晶体结构;用循环伏安法(CV)测试电极的电催化还原脱氯潜能,CV实验在三电极体系中进行,采用 Pt片为对电极, Hg/Hg2SO4为参比电极.
脱氯反应在自制的双室电解池中进行,阴阳两室底部连通,用阳离子交换膜(Nafion-324,杜邦公司)隔开,阴极液为 2,4,6-TCP的水溶液,Na2SO4溶液为支持电解质,通过加入 H2SO4调节初始pH值;阳极液为浓度相同的Na2SO4溶液,以制备的Pd/Ti电极为工作电极,Pt片为对电极,采用恒电流法还原脱氯,用 HPLC检测2,4,6-TCP及其脱氯产物的浓度.
2 结果与讨论
2.1 电极表征结果
用CV测试电极的ECH潜能.一般地,CV曲线上,氢吸收峰电流值越大,表明电极的加氢脱氯潜能越强[19].由图 1可见, Pd/Ti电极在-650mV时的氢吸附峰电流大小为-140.5mA,说明电极具有强的氢吸附性能,在脱氯过程中具有较好的催化能力.
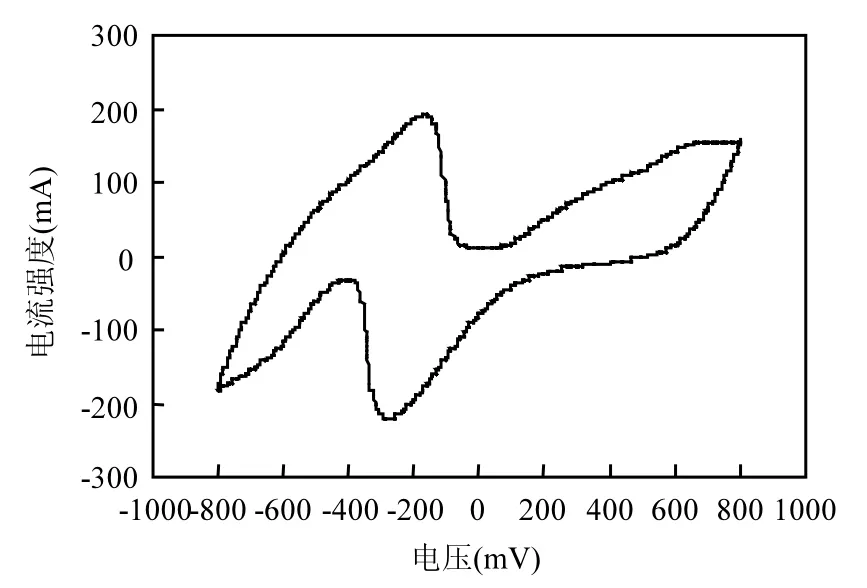
图1 Pd/Ti电极在0.5mol/LH2SO4中的CV曲线(扫描速率为50mV/s)Fig.1 CV curve of Pd /Ti electrode in 0.5mol/L H2SO4solution with scan rate of 50mV/s
如图2所示,从5000倍SEM照片可以看出, Pd晶粒呈树枝状生长;从 100000倍放大照片看出Pd的片状晶体.此结构具有较大的有效活性面积,暴露较多的催化活性位点,为高效脱氯提供了物质基础.
图3为电极的XRD测试结果,图中40.116, 46.611,68.251,82.174,86.739位置的衍射峰,分别属于Pd的(111), (200), (220), (311)和(222)晶面,表明Pd颗粒的晶格属于面心立方(FCC)型.根据谢乐公式,计算得Pd晶粒的平均尺寸为15.5nm.
ICP-AES检测电极上 Pd的负载量,得到电极上Pd的负载量为2.78mg/cm2.

图2 不同放大倍数的电极表面SEM照片Fig.2 SEM images of electrode under different zoom scales
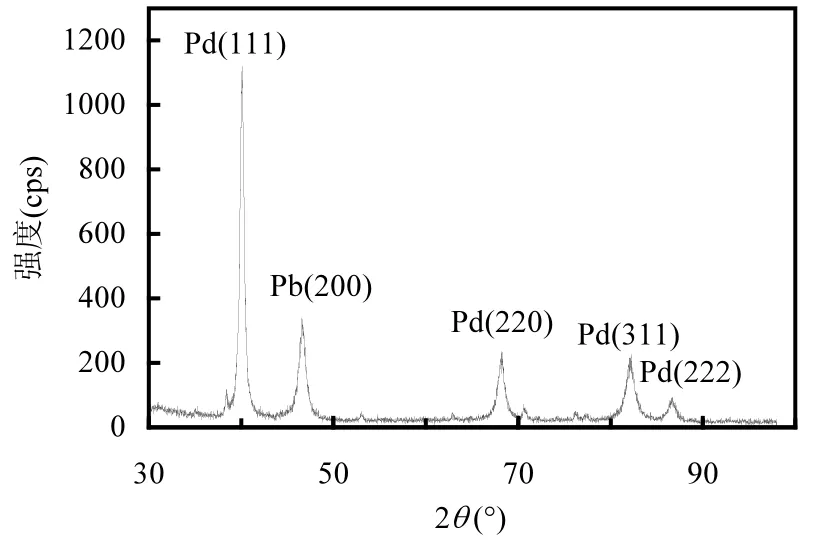
图3 Pd /Ti电极的XRD图谱Fig.3 XRD pattern for Pd/Ti electrode
2.2 Pd/Ti电极上ECH机理
Pd/Ti电极上氯代有机物(R-Cl)的ECH的反应机制可以用式(1a)~式(1d)表示[20-22].水或质子在阴极的 Pd催化剂表面还原生成活性氢([H]),如式(1a); [H]进攻吸附到电极表面的 R-Cl(1b),发生加氢脱氯反应(1c),脱氯产物从电极表面脱附(1d).本研究中,R-Cl为 2,4,6-TCP,其分子结构中含有 3个氯原子(-Cl),脱去 1个-Cl生成DCP;DCP可以继续发生脱氯反应(1c)生成CP,同样地,CP进一步脱氯生成苯酚(Ph),彻底脱氯.

当脱氯反应(1c)进行较慢时,作为ECH反应的副反应,H2析出反应(2a和 2b)可能变成主要反应.

2.3 脱氯条件的优化
2.3.1 脱氯电流对脱氯的影响 固定 2,4,6-TCP的初始浓度为80mg/L,支持电解质Na2SO4浓度为0.05mol/L,初始 pH值为 2.40,不同电流(2,5,8和11mA)条件下, 2,4,6-TCP脱氯效果如图4所示.
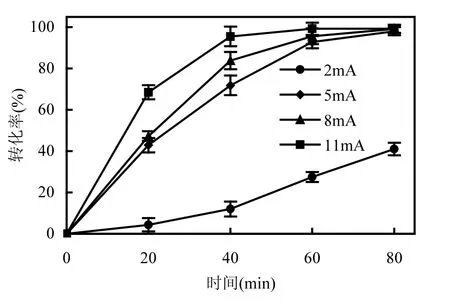
图4 不同电流下2,4,6-TCP的还原脱氯结果Fig.4 Dechlorination results of 2,4,6-TCP under different currents
从图 4可以看出,脱氯电流为 2mA时, 2,4,6-TCP转化率较低.随着电流的增大,相同时刻转化率也随之增大,5mA和 8mA的条件下, 80min时的转化率均接近100%;电流增至11mA时,反应在初期进行得较快,60min后 2,4,6-TCP转化率不再增加.根据ECH机制,在反应起始阶段, pH值较低有利于[H]产生,而且氯酚的浓度也较大,脱氯反应(3a)进行较快.随着反应进行,氯酚浓度下降,[H]不能被有效利用.析氢副反应(2)进行的程度逐渐加大,另外,电极表面的产生的 H2层会影响氯酚的传质,从而阻碍脱氯反应(3a)的发生,导致氯酚转化率下降.大电流时,反应起始较快,但消耗H+也快,在反应后期,副反应程度也大.
2.3.2 支持电解质浓度对脱氯的影响 在初始pH值为2.40,脱氯电流为5mA的条件下,80mg/L的2,4,6-TCP脱氯效果随Na2SO4浓度(0.02,0.05, 0.08mol/L)的变化,如图5所示.

图5 不同Na2SO4浓度下2,4,6-TCP的还原脱氯结果Fig.5 Dechlorination results of 2,4,6-TCP under different concentrations of Na2SO4in catholyte
由图5可见,随着Na2SO4浓度的增加, 2,4,6-TCP的转化速率有所加快. 反应 80min,转化率都接近 100%.考虑到盐浓度过高对后续处理不利,选择Na2SO4浓度为0.05mol/L.
2.3.3 pH值对脱氯的影响 图6为2,4,6-TCP初始浓度为 80mg/L,支持电解质 Na2SO4浓度为0.05mol/L,脱氯电流为5mA时,不同初始pH值(2.15, 2.40和3.00)条件下的2,4,6-TCP脱氯实验结果.
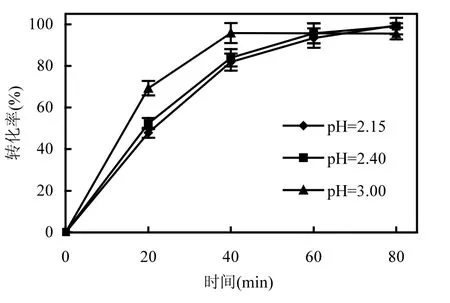
图6 不同初始pH值下2,4,6-TCP的还原脱氯效果Fig.6 Dechlorination results of 2,4,6-TCP under different initial pH value of catholyte
从图6可看出,当pH值为3.00时,反应40min, 2,4,6-TCP转化率超过 95%,继续反应,转化率没有明显增加;当 pH值为 2.40,脱氯 80min时, 2,4,6-TCP转化率达到100%,溶液pH值为6.98.
根据反应ECH机制,酸性条件下,H+充足,容易产生[H],有利于脱氯反应的进行;初始酸度不足可能导致反应后期溶液 pH值落在碱性,碱性条件下,[H]产生较困难,脱氯反应难以进行.但过低的pH值会造成酸剩余,不利于后续处理.因此,试验条件下选择初始pH值为2.40.
2.3.4 响应面优化 为考虑因素的交互影响,进一步利用响应面分析法,对 2,4,6-TCP电催化脱氯条件进行优化.选用试验次数 N=17,应用Design Expert软件,根据Box-Benhnken的中心组合试验设计原理,采用三因素三水平的响应面分析方法设计试验,2,4,6-TCP降解过程的主要因素为电流密度、Na2SO4浓度和初始pH值,每个变量分别确定-1、0、1三个水平,响应面的分析因素与设计如表1所示.

表1 中心组合设计各因素水平Table 1 Range of different factors investigated with central composite design
根据表1的试验方案,以2,4,6-TCP的转化率为响应值.将反应60min时的转化率数据输入至Design Expert中进行分析,得到相应的等高线图,如图7所示.
由 7(a)为可见,电流为 6mA时,pH值与Na2SO4浓度交互作用显著.2,4,6-TCP的转化率随着初始pH值减小而升高,当Na2SO4浓度由下水平至中心点,2,4,6-TCP的转化率随之升高.当Na2SO4浓度继续增大至上水平时,2,4,6-TCP的转化率反而有所下降.在初始 pH值与电解质浓度都在中心点时,2,4,6-TCP转化率接近100%.
图7(b)显示了初始pH值为中心点(pH=2.40)时,Na2SO4浓度与电流的变化对2,4,6-TCP转化率的影响.电流值在下水平至中心值范围内,2,4,6-TCP的转化率Na2SO4浓度逐渐升高,中心值时最高,继续增大 Na2SO4浓度时,转化率下降.电流值在中心点至上水平范围,2,4,6-TCP的转化率会随Na2SO4浓度的增加而降低.

图7 交互作用下脱氯效果等高线Fig.7 Contour maps of dechlorination results under interaction effect
图 7(c)显示了 Na2SO4浓度值为中心点(0.05mol/L)时,pH值与电流的变化对 2,4,6-TCP转化率的影响.可以看出,上水平即低 pH值有利于脱氯;在pH值下水平区即高的初始pH值,电流值升高, 2,4,6-TCP转化率下降.
通过响应面分析可以得出, 试验条件下2,4,6-TCP电催化还原脱氯的优化条件为:电流6mA, Na2SO4浓度0.05mol/L,初始pH值2.40. 2.4 脱氯动力学
文献[13]表明,氯代有机物的电催化还原脱氯反应,符合准一级反应动力学.在优化脱氯条件下,2,4,6-TCP浓度随时间的变化进行拟合,如图8所示.浓度的对数值(lnC)与时间(t)呈线性相关,表明 2,4,6-TCP的脱氯符合准一级反应动力学.因此,采用一级反应动力学模型探讨 2,4,6-TCP的电还原脱氯过程.

图8 反应中2,4,6-TCP浓度对数值与时间的线性拟合Fig.8 Fitting curve for lnC and time in the dechlorination of 2,4,6-TCP
2,4 ,6-TCP还原脱氯可能的途径如图9所示.
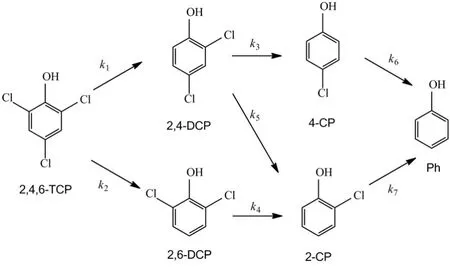
图9 2,4,6-TCP可能的还原脱氯途径Fig.9 The possible reaction pathways of 2,4,6-TCP dechlorination
对应的一级动力学方程如式(3a)~式(3f)所示.
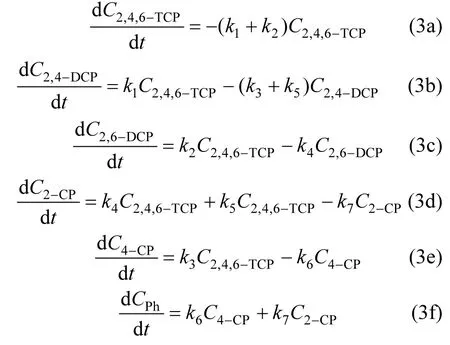
式中:kn表示图9中以2,4,6-TCP为初始反应物的各步骤的反应速率常数;C表示其对应下标的组
解式(3a) ~式(3f),得到式(4a) ~式(4f):分的浓度.
式中:α表示物质的量比; α2,4-DCP表示 C2,4-DCP,t/ C2,4,6-TCP,0; kn表示2,4,6-TCP脱氯过程中各步骤的反应速率常数,意义同式(3a) ~式(3f).
在优化的脱氯条件下,2,4,6-TCP及其脱氯产物浓度随电催化时间的变化见图 10(a).用MatlabR2013b软件对实验数据按照式(4a)~式(4f)进行非线性拟合,得到各速率常数值k1=0.0065min-1, k2=0.0419min-1, k3=0.0087min-1, k4=1.273min-1, k5=0.0494min-1, k6=0.0591min-1, k7=1.882min-1.将它们代入式(4a)~式(4f)并作图,得到各组分浓度随时间变化的拟合曲线,如图 10(b)所示.拟合曲线和实验结果较吻合,说明对2,4,6-TCP脱氯途径和反应速率常数的估算合理.
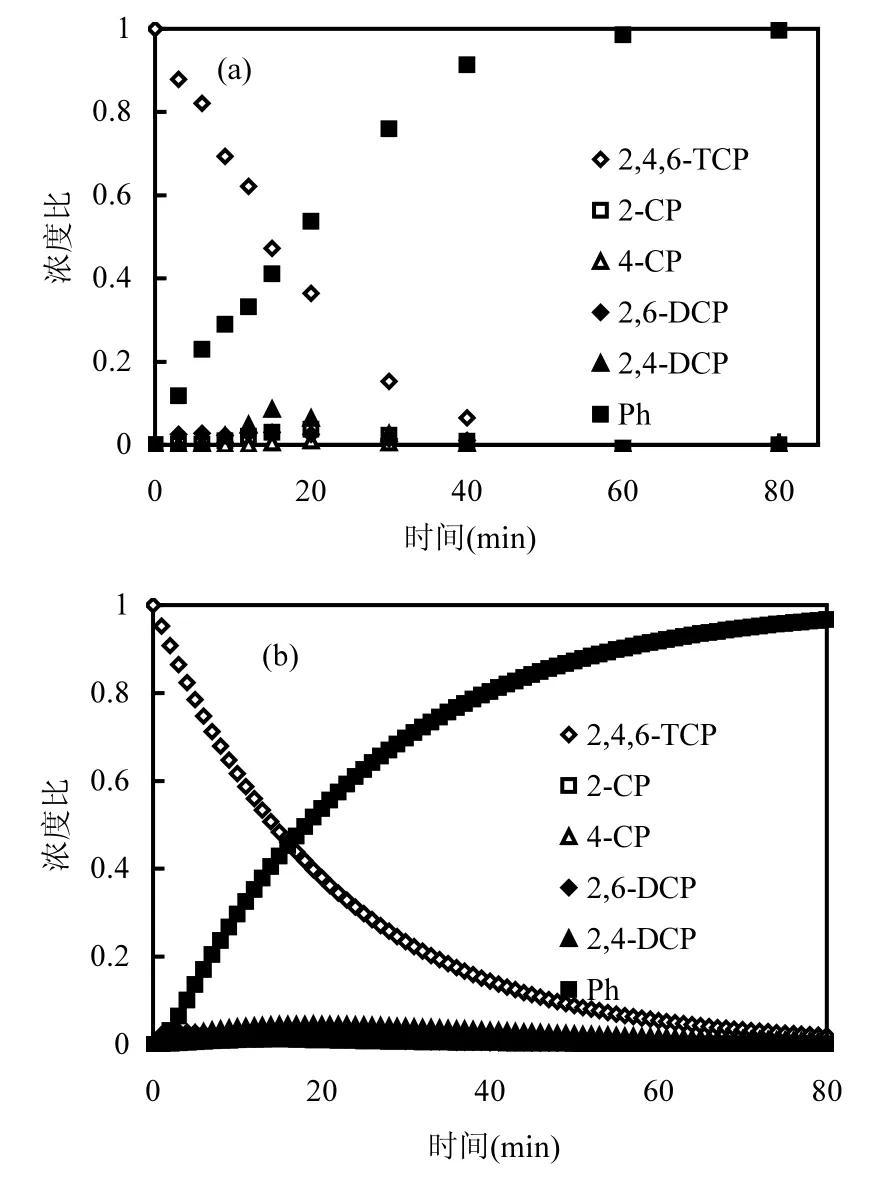
图10 优化条件下2,4,6-TCP的脱氯实验结果以及根据反应速率方程的拟合曲线Fig.10 Experimental results of 2,4,6-TCP dechlorination under the optimum condition and fitted results based on the reaction rate formulas?
根据一级反应半衰期t1/2=0.693/k, k值越大,则该半衰期越短.对照图9, k1< k2,说明2,4,6-TCP脱去一个氯原子的主要脱氯产物是2,6-DCP; k4和k7数值较大,说明2,4,6-TCP的主要降解途径是2,4,6-TCP→2,6-DCP→2-CP→苯酚.
速率常数可以用单位质量的Pd来表示.试验条件下,2,4,6-TCP在Pd/Ti 电极上的当量转化速率常数KPd=(k1+ k2)/CPd=0.0065L/(gPd·min).
3 结论
3.1 以Ti网为基质,电沉积制备出的Pd/Ti电极,具有较高的电催化还原脱氯活性.
3.2 Pd/Ti电极上80mg/L的2,4,6-TCP还原脱氯的优化条件:脱氯电流为 6mA,支持电解质Na2SO4的浓度为 0.05mol/L,氯酚电解液的初始pH为2.40.优化条件下2,4,6-TCP在80min能够完全脱氯.
3.3 2,4,6-TCP电还原脱氯符合一级反应动力学,主要脱氯途径为 2,4,6-TCP→2,6-DCP→2-CP→苯酚.
[1]钱 易,汤鸿霄,文湘华.水体颗粒物和难降解有机物的特性与控制技术原理(F卷) [M]. 北京:中国环境科学出版社, 2000: 56-59.
[2]王建龙.生物固定化技术与水污染控制 [M]. 北京:科学出版社, 2006:261-267.
[3]Huff J. Long-term toxicology and carcinogenicity of 2,4,6-trichlorophenol [J]. Chemosphere, 2012,89(5):521-525.
[4]金盛杨,王玉军,李连祯,等.纳米与微米级零价铁降解 2,4,6-三氯酚动力学比较 [J]. 中国环境科学, 2010,30(1):82-87.
[5]Kim Y H, Carraway E R. Dechlorination of pentachlorophenol by zero valent iron and modified zero valent irons [J]. Environ. Sci. Technol., 2000,34(10):2014-2017.
[6]Wan J, Wan J, Ma Y, et al. Reactivity characteristics of SiO2-coated zero-valent iron nanoparticles for 2,4-dichlorophenol degradation [J]. Chem. Eng. J., 2013,221:300-307.
[7]Xu L J, Wang J L. Degradation of chlorophenols using a novel Fe0/CeO2composite [J]. Appl. Catal. B: Environ., 2013,142-143: 396-405.
[8]Zhang Z, Shen Q H, Cissoko N, et al. Catalytic dechlorination of 2,4-dichlorophenol by Pd/Fe bimetallic nanoparticles in the presence of humic acid [J]. J. Hazard. Mater., 2010,182(1-3): 252-258.
[9]Zhou Y, Kuang Y, Li W, et al. A combination of bentonitesupported bimetallic Fe/Pd nanoparticles and biodegradation for the remediation of p-chlorophenol in wastewater [J]. Chem. Eng. J., 2013,223:68-75.
[10]Zhou T, Li Y, Lim T. Catalytic hydrodechlorination of chlorophenols by Pd/Fe nanoparticles: Comparisons with other bimetallic systems, kinetics and mechanism [J]. Sep. Purif. Technol., 2010,76(2):206-214.
[11]Gautam S K, Suresh S. Dechlorination of DDT, DDD and DDE in soil (slurry) phase using magnesium/palladium system [J]. J. Colloid Interf. Sci., 2006,304(1):144-151.
[12]王 姝,杨 波,张婷婷,等.钯/泡沫镍对水体中4-氯酚的氢解脱氯研究 [J]. 中国环境科学, 2009,29(10):1065-1069.
[13]Cheng I F, Fernando Q, Korte N. Electrochemical dechlorination of 4-Chlorophenol to Phenol [J]. Environ. Sci. Technol., 1997, (31):1074-1078.
[14]Connors T F, Rusling J F. Removal of chloride from 4-chlorobiphenyl and 4,4’-dichlorobiphenyl by electrocatalytic reduction [J]. J. Electrochem. Soc., 1983,130(5):1120-1121.
[15]Dabo P, Cyr A, Laplante F, et al. Electrocatalytic dehydrochlorination of pentachlorophenol to phenol or cyclohexanol [J]. Environ. Sci. Technol., 2000,34(7):1265-1268.
[16]Bechthold P, Jasen P, Gonzalez E, et al. Hydrogen adsorption on PdGa(110): a DFT study [J]. J. Phy. Chem. C, 2012,116(33): 17518-17524.
[17]Chaplin B P, Roundy E, Guy K A, et al. Effects of natural water ions and humic acid on catalytic nitrate reduction kinetics using an alumina supported PdCu catalyst [J]. Environ. Sci.Technol., 2006,40(9):3075-3081.
[18]Shao M H. Palladium-based electrocatalysts for hydrogen oxidation and oxygen reduction reactions [J]. J. Power Sources, 2011,196(5):2433-2444.
[19]Zhang J T, Huang M H, Ma H Y. High catalytic activity of nanostructured Pd thin films electrochemically deposited on polycrystalline Pt and Au substrates towards electro-oxidation of methanol [J]. Electrochem. Commun., 2007,9(6):1298-1304.
[20]Knitt L E, Shapley J R, Strathmann T J. Rapid metal-catalyzed hydrodehalogenation of iodinated X-ray contrast media [J]. Environ. Sci. Technol., 2008,42(2):577-583.
[21]Cui C, Quan X, Yu H, et al. Electrocatalytic hydrodehalogenation of pentachlorophenol at palladized multiwalled carbon nanotubes electrode [J]. Appl. Catal.B: Environ., 2008,80(1/2):122-128.
[22]Cheng H, Scott K, Christensen P A. Electrochemical hydrodehalogenation of chlorinated phenols in aqueous solutions II. Effect of operating parameters [J]. J. Electrochem. Soc., 2003, 150(2):D25-D29.
Reductive dechlorination of 2,4,6-TCP on Pd/Ti electrode: parameters optimization and degradation pathway
WEI Xue-feng1,2, SUN Zhi-rong1*(1.College of Environmental and Energy Engineering, Beijing University of Technology, Beijing 100124, China;2.College of Chemical Engineering and Pharmaceutics, Henan University of Science and Technology, Luoyang 471023, China). China Environmental Science, 2014,34(9):2285~2291
Pd loaded Ti electrode (Pd/Ti electrode) was prepared by electrodeposition method and was applied to 2,4,6-TCP dechlorination. The dechlorination parameters were investigated by means of single factor experiment and response surface analysis methods. Reaction rate constants of the possible steps in 2,4,6-TCP dechlorination were fitted out by using the experimental data. The optimized dechlorination condition of 2,4,6-TCP was obtained. i.e., current was 5mA, supporting electrolyte Na2SO4concentration was 0.05mol/L and initial pH of catholyte was 2.40. Under the above conditions, 2,4,6-TCP with a concentration of 80mg/L could be completely dechlorinated in 80min. Dechlorination of 2,4,6-TCP followed pseudo first order kinetics. The main pathway of 2,4,6-TCP dechlorination was 2,4,6-TCP→2,6-DCP→2-CP→phenol.
Pd/Ti electrode;2,4,6-TCP;electrocatalysis;reductive dechlorination;kinetics
X131.2
A
1000-6923(2014)09-2285-07
魏学锋(1979-),男,河南洛阳人,讲师,北京工业大学博士研究生,主要从事污染控制化学与技术研究.发表论文20篇.
2014-02-28
国家自然科学基金资助项目(51278006);高等学校博士学科点专项科研基金(20111103110007);北京市属高等学校长城学者培养计划(CIT&TCD20130311);北京工业大学博士生创新基金项目(YB201308)
* 责任作者, 教授, zrsun@bjut.edu.cn

