抗羊口疮B2L囊膜蛋白单抗的免疫学初步研究
谭强,赵文博,李朋娅,王梦醒,杨春华,刘馨,黄凤娟,谭慧华,于永忠
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.黑龙江八一农垦大学生命科学技术学院;3.继光实验学校)
羊口疮是由羊传染性脓疱病毒(Orf virus,ORFV)引起羊属动物的一种急性、高度接触性传染病。其病原体不仅感染羊只,还感染海豹、红松鼠、驯鹿等野生动物以及部分密切接触的人员[1-3]。该病多发生于春秋季节,通常呈区域群发性,主要危害3~6月龄的羔羊和成年羊。研究发现,病毒主要通过破损的皮肤、粘膜感染皮肤棘细胞层,多存在于脓疱和痂皮内。感染部位的皮肤粘膜出现增生性病变。常发生于唇部感染导致病羊采食困难,形体消瘦,抵抗力降低,进而诱发坏死性肺炎、败血症等疾病导致患畜死亡,给养羊业造成巨大经济损失。此病由来已久,多发于澳大利亚、新西兰等养羊业发达的国家,受全球化的影响,该病全球流行趋势愈发严重[4]。我国最早于1955年报道羊口疮病。近年来,西藏、新疆、甘肃、内蒙、吉林、陕西、四川和云南等多个省区均有该病发生和流行的报道。黑龙江也有羊口疮病的发生,最近一次报道是在2013年[5]。
单克隆抗体较常规免疫血清具有高度的同质性和特异性等优点,成为检测病原和抗体的最佳生物探针。加之,单抗可以大规模批量生产,且易于标准化,将其运用于酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)诊断,将大大提高诊断的特异性,因此利用单抗建立ELISA 诊断试剂盒具有很好的应用前景。B2L 基因编码大小约42 kDa 的囊膜蛋白,该蛋白是病毒主要的免疫原性蛋白,可刺激机体产生强烈的抗体反应[6]。研究利用一株抗B2L 囊膜蛋白的单抗进行间接免疫荧光试验,结合病毒培养和聚合酶链式反应(Polymerase Chain Reaction,PCR)鉴定技术,旨在验证该单抗是否具有识别病毒的能力,为羊口疮病毒ELISA 检测试剂盒的研制打下基础。
1 材料和方法
试验于2013年4月至2014年2月在黑龙江八一农垦大学生命学院动物病毒学研究室完成。
1.1 材料
1.1.1 病毒、细胞和单抗
ORFV(OV/HLJ/04 株)由黑龙江八一农垦大学生命学院动物病毒学研究室于2012年6月分离鉴定并保;原代牛睾丸细胞由黑龙江八一农垦大学生命学院4061 病毒实验室保存;单克隆抗体2E4 保存于-70 ℃。
1.1.2 主要试剂
TIANamp Virus DNA/RNA Kit(离心柱型)购自天根公司;Dream TaqTM Green PCR Master Mix 购自Fermenters;引物由金唯智公司合成;FITC 标记山羊抗小鼠IgG(H+L)购自碧云天公司。
1.1.3 主要仪器
LEICA DM2500 多功能显微镜购自莱卡公司;Veriti96-Well Thermal Cycler 购自AB 公司。
1.2 方法
1.2.1 病毒的培养
具体操作步骤:(1)选用生长状态良好无细胞病变(cytopathic effect,CPE)的原代BT 细胞,当细胞面积达到视野面积约1/2 时,弃去培养上清,用PBS 冲洗两次;(2)然后加入毒力滴度为2.75 的病毒液10 μL和990 μL 含2%FBS 的DMEM/HIGH GLUCOSE 维持液,置于37 ℃CO2培养箱中吸附2 h,摇匀病毒液,使病毒液充分接触培养皿板底细胞,共4 次,每次间隔30 min,对照组则用维持液替代;(3)然后添加9 mL 的维持液,放入37 ℃CO2恒温培养箱中继续培养;(4)每天固定时间观察记录细胞状态,确定最佳免疫荧光时间;(5)最后弃上清液,回收病变细胞。
1.2.2 间接免疫荧光试验
具体操作步骤:(1)用无菌盖玻片覆盖于培养皿内进行BT 细胞的培养,待细胞面积达到视野面积约1/2 时,选2 个培养皿为实验组,2 个培养皿为对照组。实验组,按照1.2.1 方法接毒,对照组则用维持液替代;(2)选择2 d 作为免疫荧光时间,待接毒后2 d后,弃去维持液,用4 ℃预冷的PBS 缓冲液摇洗3次,每次5 min;(3)每平皿加入1 mL 80%的冷丙酮,于4 ℃固定5 min 后,弃去固定液,敞开细胞培养板使其自然干燥;(4)每平皿加入1∶100 稀释的2E4 单克隆抗体5mL,37 ℃孵育1 h,洗涤同上;(5)然后每平皿加入1∶1 000 稀释的FITC-山羊抗鼠IgG 抗体5 mL,37 ℃避光孵育1 h,保持避光洗涤,方法同上;(6)最后取出附有细胞的盖玻片加80%的甘油封片,置荧光显微镜观察[7]。
1.2.3 引物
参考GenBank中的ORFV的标准株NZ2(DQ184476)中的B2L(ORFV011)和F1L(ORFV059)设计两对的引物,B2L(F):5’-CGGGATCCATGTGGCCGTTCTCCTC-3’,B2L(R)5’-CCAAGCTTTTAATTTATTGGCTTGCAGAA CT-3’;F1L(F):5’-CCAAGCTTGCCACCATGTACATA ATCGGGGTTGCC-3’,F1L(R)5’-CCCTCGAGTCACA CGATGGCCGTGACC-3’,引物由金唯智生物公司合成。
1.2.4 病毒DNA 提取
按照TIANamp Virus DNA/RNA 试剂盒操作步骤,对回收的CPE 细胞和病毒原液进行病毒的DNA提取,并将DNA 保存于-20 ℃。
1.2.5 PCR 鉴定
对病毒保守的囊膜基因B2L 和微管蛋白F1L 进行PCR 鉴定,PCR 反应体系如下:ddH2O 4 μL,Green taq 酶5 μL,上、下游引物(10 pmol·L-1)各0.5 μL,模板2 μL,总体积为12 μL。PCR 反应条件为:94 ℃预变性2 min;94 ℃变性45 s,55 ℃退火45 s;72 ℃延伸80 s,30 个循环;72 ℃延伸10 min。取扩增产物10 μL 于含有溴化乙锭的1%(w/v)琼脂糖凝胶上电泳检测[8]。
2 结果
2.1 病毒的培养
BT 细胞在接种毒株后,呈现明显的病理变化。当接种2 d 时,实验组一些散在细胞出现空泡样病变,而对照组细胞并未出现任何CPE。当接种3 d 时,实验组一些细胞逐渐皱缩漂浮,而对照组细胞出现散在漂浮。当接种4 d 时,实验组细胞大面积皱缩,而对照组同3 d 时相比,细胞外观无变化。当接种5 d时,实验组一些皱缩细胞开始陆续漂浮,而对照组无病理变化。当接种6 d 时,实验组皱缩的细胞继续增多,呈拉网状病变,且产生CPE 的细胞面积超过总面积1/2,对照组细胞也产生CPE,但病变程度无实验组显著,同实验组接毒细胞3 d 时的病变程度类似。当接种7 d 时,实验组大量细胞脱离培养皿,已无完整细胞形态,而对照组此时的细胞形态与实验组4 d时的细胞形态相似。见图1(A~B)。

图1(A) 羊口疮感染BT 细胞流程图Fig.1(A) The progress of BT caused by ORFV from infection to lysis

图1(B) 羊口疮感染BT 细胞流程图Fig.1(B) The progress of BT caused by ORFV from infection to lysis
2.2 间接免疫荧光试验
实验结果表明,对实验组予以激发光可见白色箭头所指处的细胞具有荧光反应(图2-B),而对照组则无此反应(图2-D);在白光条件下观察实验组细胞形态,发现结合荧光抗体的细胞皱缩成团(2-A),出现明显的CPE。

图2 间接免疫荧光检测ORFV 在被感染BT 细胞中的分布情况Fig.2 The distribution of ORFV in infected BT cells
2.3 PCR 鉴定结果
PCR 结果表明,反复冻融感染ORFV 的MDBK细胞和BT 细胞获得的裂解物通过PCR 均扩增出了一条约为1 005 bp 的条带,其中BT 细胞扩增条带的亮度明显高于MDBK。不仅如此,BT 细胞的样品还扩增出了另一条约为1 035 bp 的条带,而MDBK 细胞则没有该条带。见图3
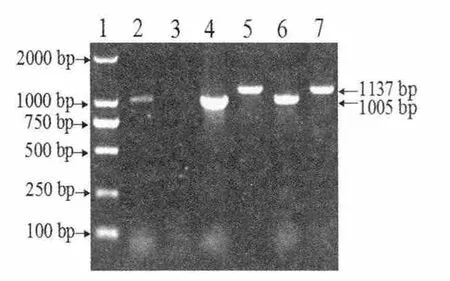
图3 B2L 基因和F1L 基因的PCR 扩增结果Fig.3 PCR amplifications of the B2L gene and F1L gene of parapoxvirus
3 讨论
系统地记录了羊口疮分离毒株OV/HLJ/04 株感染BT 细胞的表观变化过程。通过观察发现,接种毒株的细胞与未接种毒株的细胞之间存在着一个约3 d 间隔期,即接种的BT 细胞要早于未接种的BT 细胞3 d 发生病变,初步拟定进行免疫荧光的时间在1~2 d,本研究选择2 d 作为免疫荧光试验的最佳时间,在已获得的B2L 单抗基础上进行荧光实验。单抗具有特异性识别抗原位点的能力,可用于识别病毒表面的B2L 囊膜蛋白,从而达到识别和定位病毒的目的。免疫荧光试验结果表明,单克隆抗体2E4具有识别ORFV 的功能。
ORFV 的B2L 蛋白既是研究病毒与宿主免疫系统相互作用的靶蛋白,也是病毒重要的结构蛋白。该蛋白诱导的免疫反应能抵抗强毒攻击[9],刺激淋巴细胞释放。目前对B2L 的研究主要集中于进化树分析,张克山[10]于2010年首次在国内利用B2L 基因全序列对病毒进行进化树分析,发现分离的羊口疮湖北株CHINA/Goat/2009 与台湾的Nantou(DQ934351)株和韩国的Hoping(EU935106)株亲缘性较近。B2L基因由于具有保守性不仅用于进化树分析,还用于病毒的鉴定。对保守基因B2L 进行PCR 鉴定是目前鉴别羊口疮病毒的一种有效检测手段。PCR 结果表明,感染的MDBK 细胞和BT 细胞均含有羊口疮病毒,但感染的MDBK 所扩增的条带不清晰,且未能扩增出目的条带B2L 基因,可能与病毒在MDBK 细胞内的毒力低有关[11]。前期利用MDBK 增殖病毒,发现分离毒株无法适应MDBK,导致接种失败,同时也暗示着ORFV 对两种细胞的易感性不同。
ORFV 感染宿主后引起患处上皮细胞病变,研究MDBK 细胞以及人羊膜上皮细胞在ORFV 作用下的病变情况[12],对于研究病毒的致病机制将起到积极的作用。病毒在进化过程中,捕获一系列免疫调节和致病性相关基因,通过各种表达产物限制宿主的免疫清除效应,达到庇护种群增殖和病毒粒子成熟的目的[13]。目前,ORFV 分布范围广,对养殖业危害大。因此临床上建立一种重复性好、可操作性强的诊断方法很有必要。利用B2L 单抗建立快速、便捷的羊口疮ELISA 诊断方法,具有很高的应用价值。
[1]Kuhl J T,Huerter C J,Hashish H.A case of human orf contracted from a deer[J].Cutis,2003,71(4):288-290.
[2]Thomas K,Tompkins D M,Sainsbury A W,et al.A novel poxvirus lethal to red squirrels (Sciurus vulgaris)[J].Journal of General Virology,2003,84(12):3337-3341.
[3]Tikkanen M K,McInnes C J,Mercer A A,et al.Recent isolates of parapoxvirus of Finnish reindeer (Rangifer tarandus tarandus) are closely related to bovine pseudocowpox virus [J].Journal of General Virology,2004,85(6):1413-1418.
[4]Hosamani M,Bhanuprakash V,Scagliarini A,et al.Comparative sequence analysis of major envelope protein gene (B2L)of Indian orf viruses isolated from sheep and goats[J].Veterinary Microbiology,2006,116(4):317-324.
[5]于永忠,谭强,赵文博,等.羊口疮病毒黑龙江省分离株的分离鉴定[J].中国预防兽医学报,2013,35(8):678-680.
[6]Sullivan J T,Mercer A A,Fleming S B,et al.Identification and characterization of an orf virus homologue of the vaccinia virus gene encoding the major envelope antigen p37K[J].Virology,1994,202(2):968-973.
[7]赵魁.羊传染性脓疱病毒重组DNA 疫苗的构建与实验免疫研究[D].长春:吉林大学畜牧兽医学院,2010.
[8]Zhao K,He W,Gao W,et al.Orf virus DNA vaccines expressing ORFV 011 and ORFV 059 chimeric protein enhances immunogenicity[J].Virology Journal,2011,8(1):1-12.
[9]向智龙,卓建华,程振涛,等.贵州地区羊口疮病毒B2L基因克隆及原核表达载体构建[J].中国畜牧兽医,2011,38(7):76-79.
[10]Zhang K,Lu Z,Shang Y,et al.Diagnosis and phylogenetic analysis of Orf virus from goats in China:a case report[J].Virology Journal,2010,7(1):78.
[11]罗云.羊传染性脓疱病毒生物学特性及PCR 检测方法的研究[D].呼和浩特:内蒙古农业大学,2006.
[12]于永忠,王欢,谭强,等.人羊膜上皮细胞对于生长因子和ORFV 的敏感性研究[J].黑龙江八一农垦大学学报,2013,25(4):40-44.
[13]于永忠,吴志军,朱战波,等.羊口疮病毒分子特征与免疫逃逸策略[J].病毒学报,2012,28(3):278-284.

