用HPLC法同时测定锁阳中的多种有效成分
杨瀚春,王 荣,夏鹏霄,贾文超,杨长勇
(1.解放军第五一三医院药剂科,兰州 732750;2.兰州军区兰州总医院全军临床药理基地,兰州 730050; 3.兰州大学药学院,兰州 730000)
锁阳亦称不老药,又名锈铁棒、地毛球、羊锁不拉,为锁阳科植物锁阳CynomoriumsongaricumRupr. 的干燥肉质茎[1],是一种不含叶绿素的全寄生植物,主要分布于我国西北的青海、甘肃、新疆、内蒙古、宁夏等地区的半荒漠或荒漠地带,尤其是甘肃河西走廊出产的锁阳,因疗效好而被历代中医认为是锁阳的道地药材[2,3]。锁阳性味甘温,有补肾阳、益精血、润肠通便之功效,用于肾阳不足、经血亏虚、腰膝痿软、阳痿滑精、肠燥便秘[4]。从锁阳中分离出的成分有:有机酸、黄酮类、三萜类、甾体类、挥发性成分、氨基酸类、糖和糖苷类、鞣质类、无机离子及花色苷、淀粉、蛋白质、维生素、还原糖等[5]。研究表明,锁阳能够促进人体细胞再生和新陈代谢,增强免疫调节能力,具防癌、抗病毒、免疫调节、延缓衰老的作用。其药用机制主要体现在抗应激作用,对免疫功能的影响,清除自由基,抗血小板聚集,类糖皮质激素作用等。锁阳的水提物可显著增加机体的血红蛋白含量,从而增强机体的抗疲劳、抗缺氧能力[2]。锁阳中含有的儿茶素(catechin)具有提高免疫功能、抗氧化等活性[6];没食子酸(gallic acid)具有抗菌、抗病毒、抗肿瘤作用;原儿茶酸(protocatechic acid)具有增加冠脉流量、降低心肌耗氧量及祛痰、平喘、抗菌的作用。目前以HPLC 法同时测定锁阳中儿茶素、没食子酸和原儿茶酸的方法鲜有报道。本研究采用HPLC-DAD(二极管阵列检测器)法建立了同时测定锁阳提取物中儿茶素、没食子酸和原儿茶酸的方法。该方法简便,结果准确、可靠,可为控制该药材和饮片的内在质量提供参考依据,从而为锁阳药材资源的合理开发利用及提高临床用药质量提供科学依据。
1 仪器和试药
1.1 仪器 Waters 600高效液相色谱仪、Waters 996 photodiode Array Detector 二极管阵列检测器、Millennium32 色谱工作站(美国Waters公司);Metter AE240型电子天平(精度:0.01 mg,瑞士Mettler Toledo公司);SK5200H超声波仪(上海科导超声仪器有限公司);Anke TGL-16B离心机(上海安亭科学仪器厂)。
1.2 试药 儿茶素、没食子酸、原儿茶酸对照品(批号依次为110877-200001、110831-200302、110809-200503,纯度均≥98%,中国食品药品检定研究院);锁阳药材及饮片(源自东风场区、甘肃金塔、内蒙古古日乃、内蒙古额济纳旗、乌鲁木齐、兰州),均由兰州大学药学院马志钢教授鉴定为锁阳(CynomoriumsongaricumRupr.)的干燥肉质茎。乙腈 (色谱纯,天津市四友精细化学品有限公司);水为灭菌注射用水;其余试剂均为分析纯。
2 方法和结果
2.1 溶液制备 (1)对照品溶液 精密称取对照品儿茶素5.90 mg、没食子酸 6.30 mg、原儿茶酸7.35 mg置同一个50 ml容量瓶中,加灭菌注射用水适量,超声10 min使溶解,加水至刻度配制成含儿茶素0.118 mg/ml、没食子酸0.126 mg/ml、原儿茶酸0.147 mg/ml的混合对照品储备溶液,4 ℃冰箱保存待用。(2)供试品溶液 取锁阳粉末(过40目筛)约2 g,精密称定,置50 ml容量瓶中,精密加入灭菌注射用水10 ml,称定重量,超声处理30 min,放冷,再称定重量,1.70×104×g离心5 min,上清液用0.45 μm微孔滤膜滤过,置棕色瓶中,即得。
2.2 色谱条件和系统适用性实验 色谱条件:Hypersil ODS C18柱(250 mm×4.6 mm,2.5 μm);流动相:乙腈-水-36%乙酸(8∶92∶0.1);流速:1.0 ml/min;检测波长:258.7 nm;柱温:室温。在此色谱条件下,将上述混合对照品储备溶液和供试品溶液分别进样20 μl,记录色谱图,见图1。由图1可见,没食子酸、原儿茶酸、儿茶素的出峰时间依次约为4.1、7.5、14.8 min,锁阳中其他成分对测定无干扰。
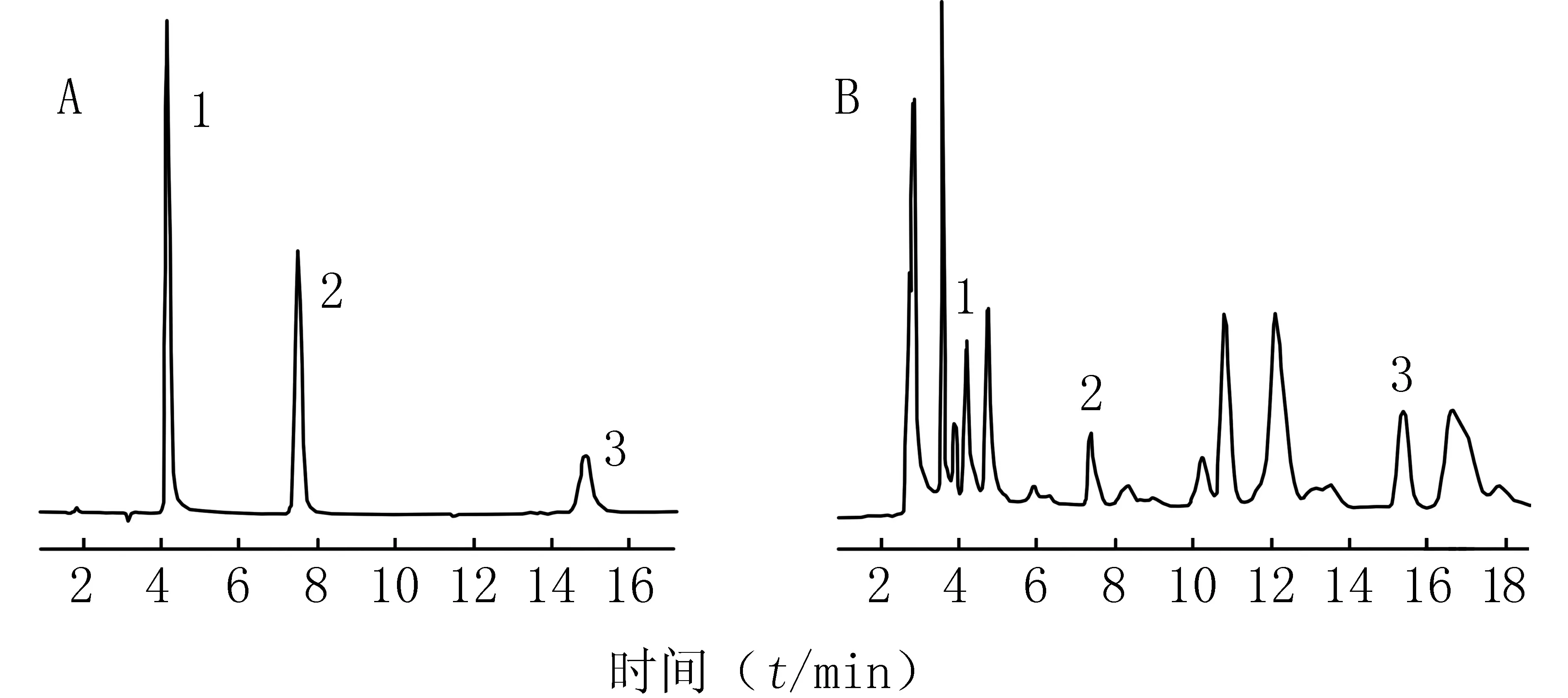
图1 锁阳的HPLC谱图
2.3 线性关系考察 精密吸取混合对照品储备液0.1、0.2、0.4、0.8、1.6、3.2 ml,分别置于5 ml 容量瓶中,加水稀释至刻度,配制成含儿茶素2.36、4.72、9.44、18.88、37.76、75.52 μg/ml,含没食子酸2.52、5.04、10.08、20.16、40.32、80.64 μg/ml,含原儿茶酸2.94、5.88、11.76、23.52、47.04、94.08 μg/ml的混合对照品系列溶液。依次取混合对照品系列溶液及混合对照品储备液20 μl进样,按2.2项色谱条件测定。以对照品进样量(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线并回归处理。结果表明,儿茶素、没食子酸、原儿茶酸分别在0.047~1.510 μg、0.050~1.613 μg和0.059~1.882 μg 范围内线性关系良好。回归方程依次为:Y=82 466.81X+281.83(r=0.999 9)、Y=886 294.46X+1 485.33(r=0.999 6)和Y=2 136 116.67X+5 884.29(r=0.999 8)。
2.4 精密度实验 (1)日内精密度 取同一混合对照品溶液(含儿茶素18.88 μg/ml、没食子酸20.16 μg/ml、原儿茶酸23.52 μg/ml)重复进样 6 次,记录峰面积,计算得到儿茶素、没食子酸和原儿茶酸的日内RSD分别为3.67%,3.47%和2.19%(n=6)。(2)日间精密度 取上述混合对照品溶液进样,每天1 次,连续6 d,记录峰面积,计算得到儿茶素、没食子酸和原儿茶酸的日间RSD分别为4.24%、3.89%和3.08%(n=6)。
2.5 重现性实验 取同一批样品(甘肃金塔)6份,精密称定,分别按2.1(2)供试品溶液制备方法制备成6份样品液,进样,分析。结果儿茶素、没食子酸、原儿茶酸的平均含量分别为4.174、0.672、0.131 mg/g,RSD依次为4.18%、3.99%和4.13%(n=6),表明本法的重现性良好。
2.6 稳定性实验 精密吸取同一样品溶液,在24 h内按拟定的时间间隔重复进样8 次,每次进样20 μl。样品中儿茶素、没食子酸、原儿茶酸平均含量为4.177、0.672、0.131(mg/g),RSD为4.84%、4.11%和4.32%(n=8)。表明样品在24 h内稳定性良好。
2.7 加样回收率实验 精密称取已知含量(含儿茶素4.175 mg/g、没食子酸0.672 mg/g、原儿茶酸0.133 mg/g)的锁阳样品(甘肃金塔)6份,分别加入一定量(儿茶素3.00 mg、没食子酸1.33 mg、原儿茶酸0.249 mg)的对照品,按2.1(2)供试品溶液制备方法操作制备样品液,进样20 μl。测得儿茶素、没食子酸、原儿茶酸的平均回收率为100.59%、101.24%和97.90%(n=6),RSD为3.35%、2.36%和3.14%(n=6)。
2.8 样品含量测定 按照2.1(2)方法制备7批供试品溶液,每批3份。分别取对照品溶液和供试品溶液各20 μl 进样,用峰面积外标法计算。锁阳药材或饮片中儿茶素、没食子酸、原儿茶酸的含量测定结果见表1。
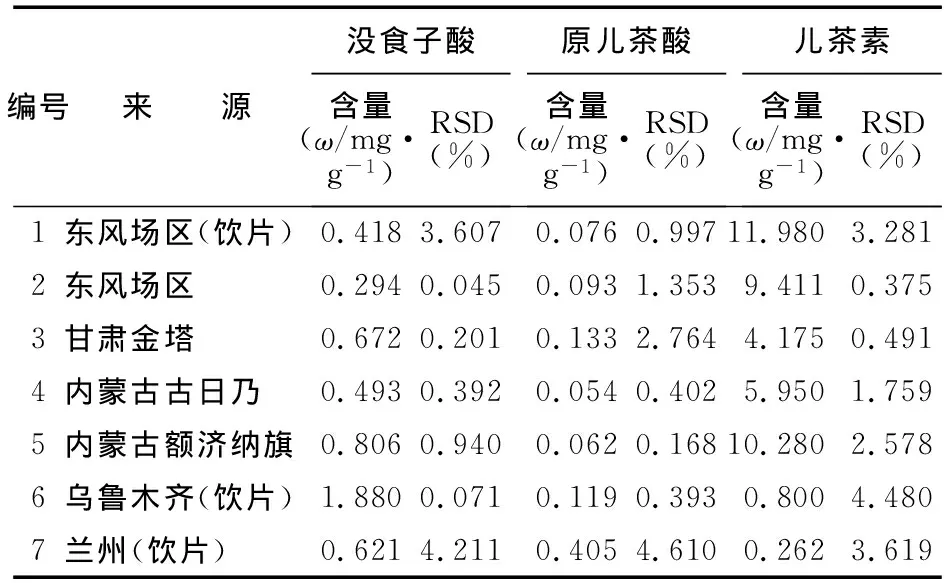
表1 锁阳样品的含量测定结果
3 讨 论
3.1 检测波长的选择 儿茶素、没食子酸、原儿茶酸3种成分中,儿茶素的吸收系数最小,原儿茶酸在锁阳中的含量最低。在本研究的色谱条件下,原儿茶酸在258.7 nm处有最大吸收,为了更好地同时测定3种成分,因此将检测波长选为258.7 nm。
3.2 流动相的优化 本研究选用了乙腈-水系统的不同配比(25∶75、40∶60、10∶90、18∶82、5∶95、3∶97、4∶96、8∶92),甲醇-水系统的不同配比(20∶80、50∶50),乙腈-水-36%乙酸系统的不同配比(5∶95∶0.3、5∶95∶0.1、8∶92∶0.1、7∶93∶0.1、6∶94∶0.2、8∶92∶0.2)进行流动相的优化。结果乙腈-水-36%乙酸系统有较好的分离及峰形,且随着乙腈体积分数的降低,儿茶素、没食子酸、原儿茶酸的保留时间增加,乙酸的加入使峰形更好。当乙腈-水-36%乙酸为8∶92∶0.1时,分离效果好,分离时间短,所以选择此流动相系统作为本研究的流动相。
3.3 7种药材和饮片3种成分的含量 测定结果表明,药材中3种成分的含量差异较大,没食子酸、原儿茶酸、儿茶素的含量差异分别达到6.4、7.6、45.7倍。因此需加强药材质量监控,提高临床用药质量。建议采用多种有效成分同时测定方法控制锁阳质量,对提升临床治疗效果意义重大。
【参考文献】
[1] 南京中医药大学.中药大辞典.下册[M].2版.上海:上海科学技术出版社,2006:3346-3347.
Nanjing University of Traditional Chinese Medicine.Dictionary of traditional Chinese herbal drugs. Volume 2[M].2nd ed.Shanghai:Shanghai Science and Technology Press, 2006:3346-3347. In Chinese.
[2] 陈圆华,谢志兵,董静洲.锁阳综合研究概况[J].经济林研究,2005,23(4):114-117.
Chen YuanHua,Xie ZhiBing,Dong JingZhou. Literature review of researches onCynomoriumsongaricumRupr.[J]. Nonwood Forest Res, 2005,23(4):114-117.In Chinese with English abstract.
[3] 齐艳华,苏格尔.锁阳的研究进展[J].中草药,2000,31(2):146-148.
Qi YanHua,Su GeEr. Advances in research onCynomoriumsongaricum[J]. Chin Tradit Herb Drugs, 2000,31(2):146-148. In Chinese.
[4] 国家药典委员会.中华人民共和国药典. 2010 年版 一部[S].北京:中国医药科技出版社,2010:325.
State Pharmacopoeia Committee.Pharmacopoeia of the People’s Republic of China.2010 ed.Volume 1[S].Beijing:Chinese Medical Science Press,2010:325.In Chinese.
[5] 马建滨,都玉蓉.锁阳的化学成分及药理作用[J].青海师范大学学报(自然科学版),2008,(2):72-75.
Ma JianBin,Du YuRong. Chemical constituents and pharmacological effects ofCynomoriumsongaricumRupr.[J]. J Qinghai Norm Univ (Nat Sci),2008,(2):72-75. In Chinese.
[6] 苏格尔,常艳旭. 锁阳的化学成分及药理作用研究概况[J]. 中国民族医药杂志,2005,(6):46-49.
Su GeEr,Chang YanXu. Research overview in chemical constituents and pharmacological effects ofCynomoriumsongaricumRupr.[J]. Chin J Ethnomed Ethnopharm,2005,(6):46-49. In Chinese.

