有序介孔炭固相萃取-毛细管电泳联用测定水样中抗生素残留*
朱华玲, 陆亚春, 王卫平, 王爱军, 陈建荣
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.浙江师范大学 地理与环境科学学院,浙江 金华 321004)
抗生素的大量滥用不仅引起了食品安全问题,而且相当一部分抗生素随饲料投放、动物粪便、医药废物及降水冲刷等过程进入水环境中,给环境安全和生态健康增加了风险[1-2].抗生素污染及其潜在的危害已成为全球关注的焦点,迫切需要发展高选择性和高灵敏度的抗生素残留分离/富集和分析方法,提供可靠有效的监测数据.
固相萃取(SPE)具有富集因子高、相分离速度快、成本低、有机溶剂消耗少等优点,已成为抗生素残留分析中最常用的预富集技术[3-5].在固相萃取中,吸附剂的性能是影响富集因子和回收率的重要因素[6].因此,开发新型高效、可重复利用的SPE吸附剂,是国内外许多学者孜孜以求的目标.目前,已有很多报道基于新型材料的SPE吸附剂,如多孔共聚物[7]、分子印迹材料(MIPs)[8]、碳纳米管[9]、磁性石墨烯纳米粒子[10]、金属有机骨架材料[11]等.有序介孔炭(OMC)具有比表面积高、孔径均一、热稳定性好及结构、组分和形貌多样性等特点,在电化学、催化、吸附和分离等领域具有广泛的应用[12-14].目前,已有文献报道了有序介孔炭对气体[15]和染料[16]等吸附性能的研究,但关于有序介孔炭对抗生素的吸附性能研究尚未见报道.
本文主要考察了有序介孔炭作为固相萃取吸附剂对水中四环素类抗生素(四环素、土霉素和多西环素)残留的吸附性能,通过对萃取条件和分离条件的优化选择,建立了固相萃取-毛细管电泳联用测定水样中四环素类抗生素残留的新方法.
1 实验部分
1.1 仪器与试剂
K1060高效毛细管电泳仪(北京凯奥科技发展有限公司),熔融石英毛细管(75 μm×42 cm,有效长度31 cm.河北永年锐沣色谱器件有限公司);HGC-8型数控固相萃取仪(广州智真生物科技有限公司),固相萃取小柱管(北京泰乐祺科技有限公司);Mill-Q超纯水器(Millipore,Bedford,USA);PHS-3D型pH计(上海精密科学仪器有限公司).
四环素(TC)、多西环素(DC)和土霉素(OT)标准品购于中国药品生物制品检定所(北京),其分子结构式见图1;甲醇(色谱纯)购自金华医药公司;有序介孔炭购自南京吉仓纳米科技有限公司;其他试剂均为分析纯;水为Mill-Q超纯水.
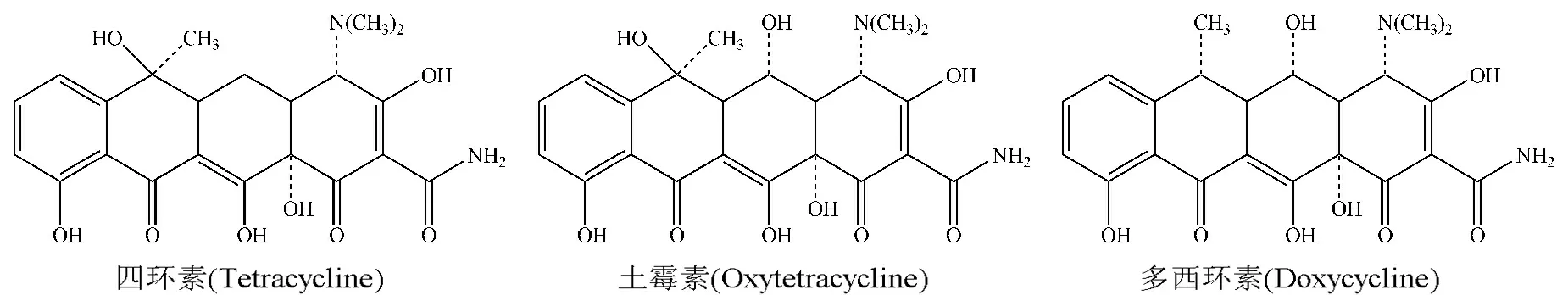
图1 3种四环素类抗生素的结构式
1.2 溶液配制
磷酸盐缓冲溶液:取NaH2PO4溶液(100 mmol/L)15.00 mL,乙二胺四乙酸(EDTA)二钠盐溶液(50 mmol/L)2.00 mL,异丙醇1.25 mL和甲醇4.00 mL,混匀,用5 mol/L NaOH溶液调至pH 12.0.缓冲溶液用0.45 μm微孔滤膜过滤并脱气,待用.
准确称取抗生素标准品各0.010 0 g,用10.00 mL 0.01 mol/L HCl溶液溶解,配制成质量浓度为1.0 mg/mL的标准储备液,于4 ℃下避光保存.实验过程中根据需要将各储备液混合稀释成相应质量浓度的标准工作液.
1.3 萃取步骤
固相萃取前,分别用5.00 mL甲醇和5.00 mL水活化装填有一定量有序介孔炭的SPE小柱.取加标为100 mg/L的二次水的水样2.00 mL过柱,用V(甲醇)∶V(乙腈)=1∶1的混合溶液以一定的流速进行洗脱,然后将洗脱液用氮气吹干,得到的固体物用一定量的 0.01 mol/L HCl溶液溶解.洗脱后的SPE小柱用5.00 mL甲醇和5.00 mL水冲洗再生后可循环利用.
1.4 毛细管和样品的处理
新毛细管分别用1.0 mol/L NaOH溶液、蒸馏水和缓冲溶液冲洗10 min.每次进样分析前,将毛细管用1.0 mol/L NaOH溶液、0.1 mol/L NaOH溶液、水和缓冲溶液依次冲洗3 min.
水样(取自金华婺江)经0.45 μm微孔滤膜过滤,用0.1 mol/L NaOH溶液将pH值调至10.0.取2.00 mL水样按上述萃取步骤进行萃取处理,洗脱液在40 ℃下氮气吹干后,得到的固体物用40 μL 0.01 mol/L HCl溶液溶解.
2 结果与讨论
2.1 分离条件的选择
根据文献[17],选用30 mmol/L磷酸盐(pH 12.0)作为运行缓冲溶液.由于四环素类分子的主要环状结构会和多种金属离子发生配位反应形成稳定的螯合物,影响四环素类的测定.因此,向缓冲溶液中加入2 mmol/L EDTA二钠盐以避免可能存在的金属离子的干扰.另外,加入体积分数为2.5%的异丙醇以改善分离度.在分离电压为14 kV、分离温度为25 ℃、检测波长为270 nm的条件下,考察了该体系对上述3种抗生素分离的影响.结果表明:使用磷酸盐体系时基线平稳、背景吸收小,但3种抗生素仍不能实现基线分离.为了提高各组分间的分离度,本实验在运行缓冲溶液中添加了一定量的甲醇,并考察了其对分离的影响(见图2).图2表明,在甲醇的体积分数为8.0%时,各组分的迁移时间较短、分离度较好.故选择最佳的甲醇含量为8.0%.在最佳的毛细管电泳分离条件下,3种抗生素标准品的色谱图如图3所示.
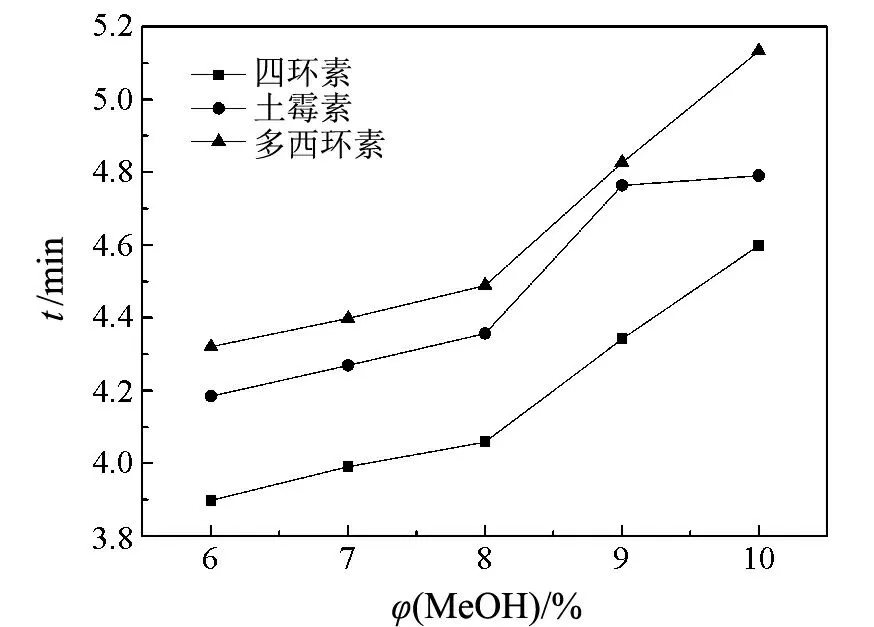
毛细管75 μm×42 cm(有效长度31 cm);进样8 s缓冲溶液:30 mmol/L磷酸盐,2 mmol/L EDTA二钠盐2.5%异丙醇,pH 12.0;电压14 kV;检测波长270 nm图2 甲醇含量对3种抗生素分离的影响
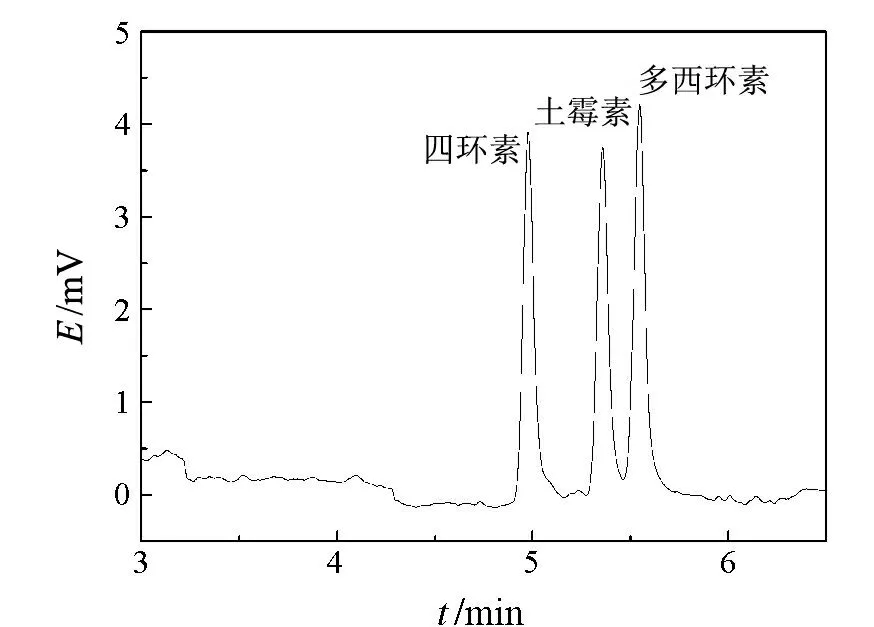
8%甲醇;毛细管75 μm×42 cm(有效长度31 cm);进样8 s缓冲溶液:30 mmol/L磷酸盐,2 mmol/L EDTA二钠盐2.5%异丙醇,pH 12.0;电压14 kV;检测波长270 nm图3 优化条件下100 mg/L标准品毛细管电泳图谱
2.2 萃取条件的优化
2.2.1 有序介孔炭的表征
在吸附测量前,将有序介孔炭在300 ℃真空环境中脱气3 h,然后进行N2吸附实验,得到的吸附等温线和孔径分布图如图4(a)所示.经计算,有序介孔炭的比表面积SBET和总孔体积Vtotal分别为1 188.68 m2/g和1.51 cm3/g,平均孔径为3.64 nm.按国际纯粹与应用化学联合会(IUPAC)分类法,图4(a)表明其N2吸附等温线属于Ⅳ型,证明介孔炭是2-D六边形的有序结构[18].同时,小角散射X射线衍射(XRD)图(见图4(b))显示,在0°~10°出现单峰,表明该材料是高度有序性的介孔材料[18].

(a)N2吸附等温线和孔径分布图 (b)小角度XRD图 图4 有序介孔炭的N2吸附等温线、孔径分布图及小角度X射线衍射图谱
2.2.2 洗脱剂的影响
分别考察了V(甲醇)∶V(乙腈)为1∶1,V(甲醇)∶V(乙酸乙酯)为1∶1,甲醇-盐酸(cHCl=1×10-3mol/L)和甲醇-乙酸(cHAc=1×10-3mol/L)等洗脱液对萃取效率的影响,结果如图5所示.从图5可以看出,使用甲醇/乙腈(ACN)混合溶剂作为洗脱液时,各组分可得到相对较大的峰面积.因此,选择甲醇/乙腈混合溶剂为洗脱剂.
2.2.3 有序介孔炭的质量的影响
有序介孔炭拥有开孔状结构、比表面积大和吸附能力强的特性,能与四环素类抗生素发生非共价的相互作用.本实验考察了有序介孔炭的质量分别为1,5,10,20 mg时各组分的萃取效率(见图6).从图6可以看出,当有序介孔炭的质量增加到5 mg时,四环素和多西环素的峰面积迅速增大;当有序介孔炭的质量大于5 mg时,四环素、土霉素和多西环素的峰面积反而逐渐减小.因此,选择有序介孔炭的质量为5 mg.
2.2.4 洗脱液体积和洗脱速度的影响
本实验分别考察了洗脱液体积为2.00,3.00,4.00,5.00,6.00 mL时各组分的洗脱效率.结果表明:随着洗脱液体积的增大,各组分的峰面积逐渐增加;当洗脱液体积大于4.00 mL时,各组分的峰面积趋于稳定.因此,确定洗脱液用量为4.00 mL.
本实验还考察了洗脱速度在0.2~1.0 mL/min时各组分的峰面积的变化情况.结果表明,当洗脱速度为0.2~0.5 mL/min时,峰面积较大,但洗脱速度慢,消耗时间长.综合考虑峰面积和分析时间,选择洗脱速度0.7 mL/min为最佳洗脱速度.

m(OMC)为5 mg;V(洗脱液)为5 mL流速为0.5 mL/min;pH 4.7图5 洗脱剂对萃取效率的影响

洗脱剂V(甲醇)∶V(乙腈)=1∶1V(洗脱液)为5 mL;流速为0.5 mL/min;pH 4.7图6 有序介孔炭的质量对萃取效率的影响
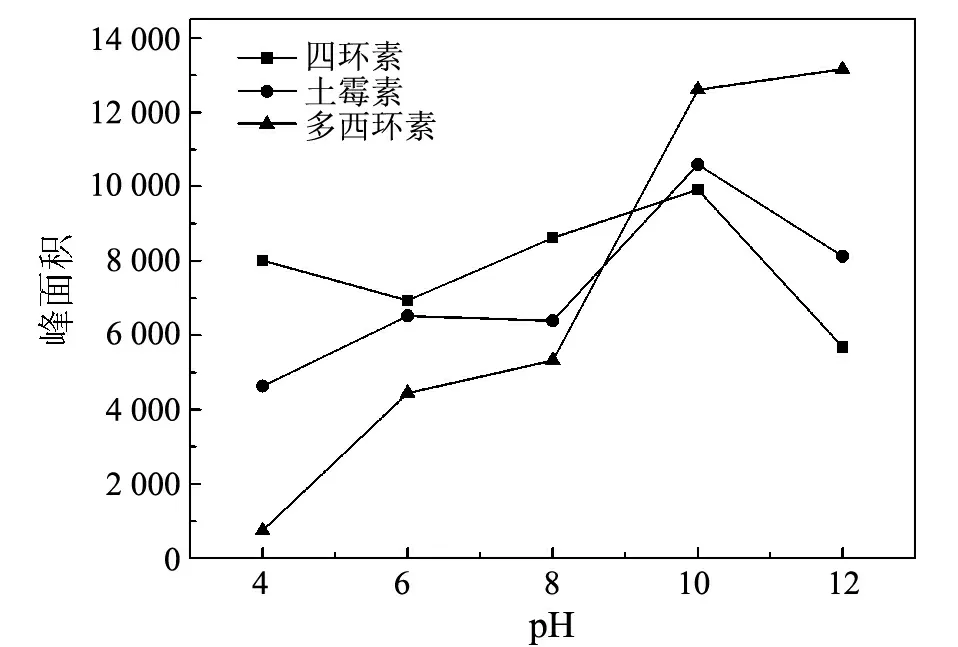
洗脱剂V(甲醇)∶V(乙腈)=1∶1;m(OMC)为5 mgV(洗脱液)为4 mL;流速为0.7 mL/min图7 pH对萃取效率的影响
2.2.5 样品溶液pH的影响
四环素类抗生素分子中含有多个羟基,其在水溶液中的pKa1,pKa2和pKa3值分别为3.3,7.5和9.0左右[19],因此,溶液的酸度会影响四环素类抗生素的离子化程度.本实验考察了样品溶液pH值为4.0~12.0时对各组分萃取效果的影响.从图 7可以看出:在pH 4.0~10.0时,随着pH值的增大,各组分的峰面积呈增加的趋势,说明有序介孔炭对抗生素去质子化形式的亲和力比质子化的强;当pH大于10.0时,各组分的萃取效果呈下降的趋势,可能是由于有序介孔炭吸附的目标分子带有较多的负电荷,使得吸附剂和未被吸附的抗生素之间存在静电排斥作用.因此,选择最佳的样品溶液pH值为10.0.
2.3 方法学考察
2.3.1 工作曲线的绘制
取一系列质量浓度为3 000,5 000,7 000,9 000,11 000 μg/L的标准工作液,在最佳萃取和分离条件下,按上述萃取步骤进行富集和分析测定.以峰面积为纵坐标y、样品质量浓度(μg/L)为横坐标x绘制工作曲线,以信噪比为3∶1计算检出限.3种抗生素测定的相关系数、回归方程及检出限见表1.

表1 3种抗生素的回归结果和检出限
2.3.2 样品分析
水样按前述方法处理后,在最佳萃取和分离条件下进行富集和分析测定.结果表明,水样中未检出抗生素残留.在水样中分别加入4 000和6 000 μg/L的抗生素混合标准溶液,每个水平下平行测定3次,分别计算加标样品的回收率及精密度,结果见表2.图8为水样加标前后的毛细管电泳谱图.
本实验结果与已报道的富集和检测四环素类抗生素的文献比较,结果如表3所示.由表3可以看出,以有序介孔炭为吸附剂,除四环素外,土霉素和多西环素的回收率高于强阴离子交换柱(SAX)和亲水亲脂萃取柱(HLB).

表2 样品的加标回收率和精密度(n=3)
注:nd为未检测到.
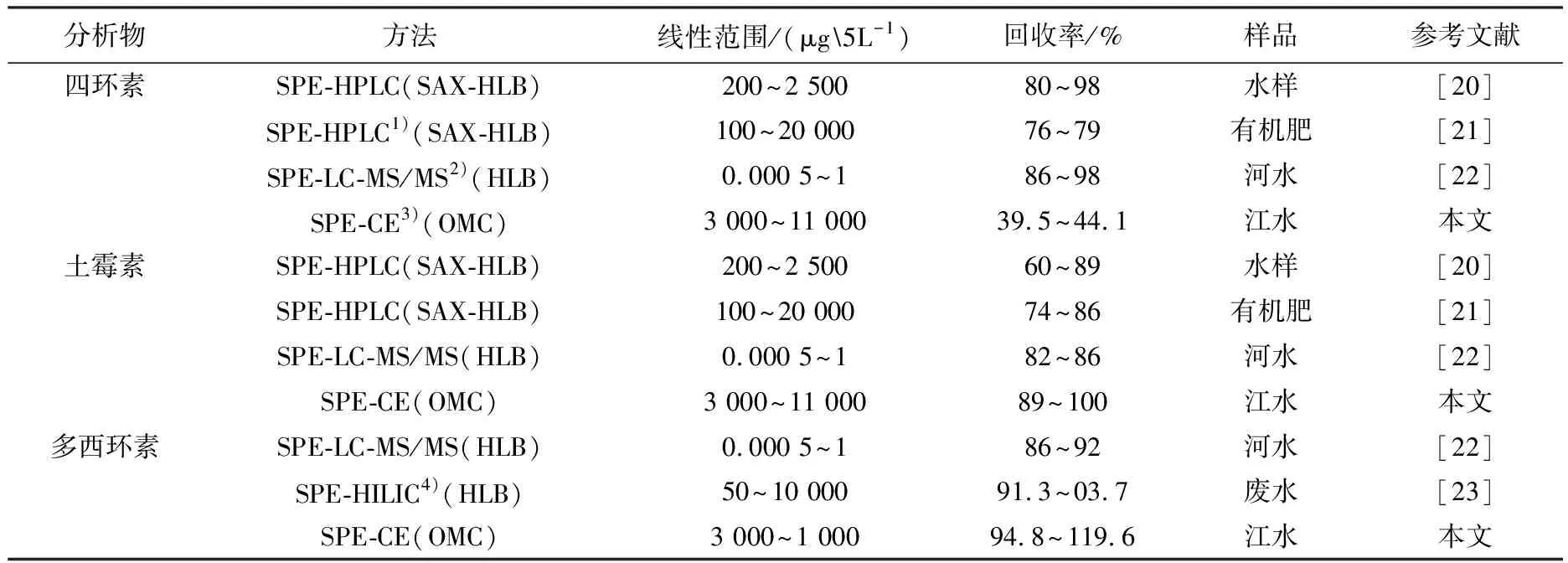
表3 与其他固相萃取方法比较
注:1)SPE-HPLC:固相萃取-高效液相色谱法;2)SPE-LC-MS/MS:固相萃取-超高压液相色谱-串联质谱;3)SPE-CE:固相萃取-毛细管电泳;4)SPE-HILIC:固相萃取-亲水作用色谱法.
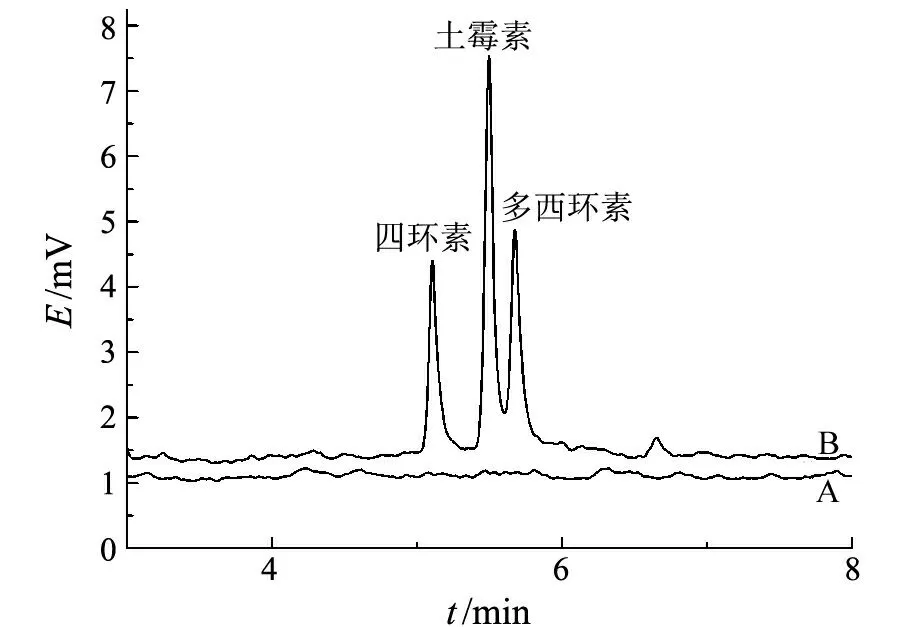
A:加标前;B加标后图8 水样加标前后的电泳图谱
3 结 论
本文采用有序介孔炭作为固相萃取吸附剂预富集地表水中残留的四环素类抗生素,再结合毛细管电泳进行分析检测.有序介孔炭拥有开孔状结构、比表面积大和吸附能力强的特性,并且与四环素类抗生素能发生非共价的相互作用,因此对四环素类抗生素有很好的预富集效果.除四环素外,其余2种抗生素的回收率介于89.0%~119.6%.结果表明,有序介孔炭作为吸附剂的固相萃取小柱的吸附能力较好.因此,有序介孔炭是一种预富集地表水中土霉素和多西环素残留的高效吸附材料.
参考文献:
[1]Martíez J.Environmental pollution by antibiotics and by antibiotic resistance determinants[J].Environ Pollut,2009,157(11):2893-2902.
[2]Baquero F,Martíez J,Canton R.Antibiotics and antibiotic resistance in water environments[J].Curr Opin Biotechnol,2008,19(3):260-265.
[3]Gros M,Rodríguez-Mozaz S,Barceló D.Rapid analysis of multiclass antibiotic residues and some of their metabolites in hospital,urban wastewater and river water by ultra-high-performance liquid chromatography coupled to quadrupole-linear ion trap tandem mass spectrometry[J].J Chromatogr A,2013,1292:173-188.
[4]García-Galán M J,Díaz-Cruz S,Barceló D.Multiresidue trace analysis of sulfonamide antibiotics and their metabolites in soils and sewage sludge by pressurized liquid extraction followed by liquid chromatography-electrospray-quadrupole linear ion trap mass spectrometry[J].J Chromatogr A,2013,1275:32-40.
[5]Beltrán E,Ibáez M,Sancho J V,et al.Determination of six microcystins and nodularin in surface and drinking waters by on-line solid phase extraction-ultra high pressure liquid chromatography tandem mass spectrometry[J].J Chromatogr A,2012,1266:61-68.
[6]Raynie D E.Modern extraction techniques[J].Anal Chem ,2010,82:4911-4916.
[7]Koesukwiwat U,Jayanta S,Leepipatpiboon N.Solid-phase extraction for multiresidue determination of sulfonamides,tetracyclines,and pyrimethamine in Bovine′s milk[J].J Chromatogr A,2007,1149(1):102-111.
[8]Cacho C,Turiel E,Martín-Esteban A,et al.Clean-up of triazines in vegetable extracts by molecularly-imprinted solid-phase extraction using a propazine-imprinted polymer[J].Anal Bioanal Chem,2003,376:491-496.
[9]Herrera-Herrera A V,Ravelo-Pérez L M,Hernández-Borges J,et al.Oxidized multi-walled carbon nanotubes for the dispersive solid-phase extraction of quinolone antibiotics from water samples using capillary electrophoresis and large volume sample stacking with polarity switching[J].J Chromatogr A,2001,1218(31):5352-5361.
[10]Zhao Guangying,Song Shuangju,Wang Chun,et al.Determination of triazine herbicides in environmental water samples by high-performance liquid chromatography using graphene-coated magnetic nanoparticles as adsorbent[J].Anal Chim Acta,2011,708(1/2):155-159.
[11]Gu Zhiyuan,Yang Chengxiong,Chang Na,et al.Metal-organic frameworks for analytical chemistry:from sample collection to chromatographic separation[J].Accounts Chem Res,2012,45(5):734-745.
[12]Ndamanisha J C,Bai Jing,Qi Bin,et al.Application of electrochemical properties of ordered mesoporous carbon to the determination of glutathione and cysteine[J].Anal Biochem,2009,386(1):79-84.
[13]Liu Shouheng,Wu J R.Nitrogen-doped ordered mesoporous carbons as electrocatalysts for methanol-tolerant oxygen reduction in acid solution[J].Int J Hydrogen Energy,2011,36(1):87-93.
[14]Yuan Xun,Xing Wei,Zhuo Shuping,et al.Adsorption of bulky molecules of nonylphenol ethoxylate on ordered mesoporous carbons[J].J Colloid Interf Sci,2008,322(2):558-565.
[15]Saha D,Deng Shuguang.Enhanced hydrogen adsorption in ordered mesoporous carbon through clathrate formation[J].Int J Hydrogen Energy,2009,34(20):8583-8588.
[16]Yuan Xun,Zhuo Shuping,Xing Wei,et al.Aqueous dye adsorption on ordered mesoporous carbons[J].J Colloid Interf Sci,2007,310(1):83-89.
[17]Miranda J M,Rodríguez J A,Galán-Vidal C A.Simultaneous determination of tetracyclines in poultry muscle by capillary zone electrophoresis[J].J Chromatogr A,2009,1216(15):3366-3371.
[18]Nejad N F,Shams E,Amini M K,et al.Synthesis of magnetic mesoporous carbon and its application for adsorption of dibenzothiophene[J].Fuel Process Technol,2013,106:376-384.
[19]Anderson C R,Rupp H S,Wu W H.Complexities in tetracycline analysis-chemistry,matrix extraction,cleanup,and liquid chromatography[J].J Chromatogr A,2005,1075(1/2):23-32.
[20]刘虹,张国平,刘丛强.固相萃取-色谱测定水、沉积物及土壤中氯霉素和3种四环素类抗生素[J].分析化学,2007,35(3):315-319.
[21]唐春玲,张文清,夏玮,等.固相萃取-高效液相色谱法测定有机肥中四环素类抗生素药物残留[J].中国土壤与肥料,2011(2):92-95.
[22]陆克祥,隋铭皓,高乃云.固相萃取-超高压液相色谱-串联质谱测定水中19种抗生素[J].分析测试学报,2010,29(12):1209-1214.
[23]张艺,李瑞萍,张兴华,等.固相萃取-亲水作用色谱法测定废水中四环素类抗生素[J].分析化学,2009,37(6):840-844.

