超声引导下小剂量凝血酶治疗医源性股动脉假性动脉瘤28例临床观察
陈阳,尤威,张平阳,杨松,赵艳芳,叶飞
(1.靖江市人民医院心内科,江苏靖江214500;2.南京市第一医院心内科,江苏南京210006;3.宜兴市人民医院心内科,江苏宜兴214200;4.解放军第八一医院心内科,江苏南京210002)
超声引导下小剂量凝血酶治疗医源性股动脉假性动脉瘤28例临床观察
陈阳1,尤威2,张平阳2,杨松3,赵艳芳4,叶飞2
(1.靖江市人民医院心内科,江苏靖江214500;2.南京市第一医院心内科,江苏南京210006;3.宜兴市人民医院心内科,江苏宜兴214200;4.解放军第八一医院心内科,江苏南京210002)
目的:探讨经超声引导的小剂量凝血酶注射治疗经常规压迫法治疗无效的医源性股动脉假性动脉瘤(iatrogenic femoral artery pseudoaneurysms,IFAP)的有效性和安全性。方法:28例经股动脉介入操作后经超声诊断明确为IFAP,常规压迫法治疗失败后,经超声引导行局部小剂量凝血酶注射治疗;记录治疗前后的瘤体体积、凝血酶用量、治疗效果和并发症,并随访观察住院期间以及1个月后的临床症状。结果:平均凝血酶用量为(112.7± 24.6)U;注射凝血酶前后IFAP瘤体体积、患侧足趾血氧饱和度差异有统计学意义,所有患者均无远端栓塞等并发症发生。结论:超声引导的小剂量凝血酶注射法治疗IFAP有效、安全,是常规压迫法治疗失败后的有效补充手段。
超声;凝血酶;医源性股动脉假性动脉瘤
近年来,随着经桡动脉介入治疗冠脉病变的大量开展,股动脉途径的使用比例越来越低,但医源性股动脉假性动脉瘤(iatrogenic femoral artery pseudoaneurysms,IFAP)仍然是不可忽视的严重并发症之一,处理不当可导致局部皮肤软组织大面积坏死、感染,甚至需要外科干预。我们自2006年以来,对IFPA经常规压迫法治疗失败者采用超声引导的经皮瘤腔内注射凝血酶法处理,疗效极佳,现报道如下。
1 对象与方法
1.1 病例
28例患者选自2006年8月至2012年10月入住南京市第一医院、靖江市人民医院、宜兴市人民医院和解放军第八一医院心内科的患者,其中男19例,女9例,平均年龄65.1±9.4(49~83)岁,平均体质量指数(BMI)26.4±2.1;均经股动脉行介入诊治后出现假性动脉瘤,其中23例发生在术后24 h刚下地活动时,5例发生在术后48~72 h下地活动时;均表现有股动脉穿刺部位的突发性疼痛,伴有搏动性包块,站立位或行走时症状较重,平卧位休息时略缓解;体检发现其中25例患者穿刺部位明显肿胀伴有局部的皮下瘀斑,可触及张力较高的、质地较硬的搏动性包块,局部压痛明显,听诊局部可闻及收缩期血管杂音;另3例患者穿刺部位无明显肿胀和瘀血情况,局部压痛明显,听诊情况同前;如压迫近心端的股动脉,局部血管杂音可明显减轻或消失。
所有患者均经超声检查证实,经局部压迫治疗,仍然无法治愈或患者不能耐受压迫甚至出现迷走反射等并发症者入组本研究。排除标准:IFAP瘤体体积较大,压迫导致肢体远端缺血发生;骨筋膜综合征;穿刺部位皮肤或软组织大面积坏死;瘤体过小(体积小于4 cm3针尖定位困难);瘤体内已经形成大量血栓仅残余少许腔隙的IFAP,瘤颈过大(>5 mm)者;不能接受操作并发症者。
1.2 影像学检查和介入治疗方法
使用超声心动图机(APLIO ARTIDA SSH-880CV,日本TOSHIBA公司)进行影像学诊断。诊断标准:超声发现穿刺侧股动脉旁(一般在上方)存在瘤腔,内有彩色多普勒血液湍流信号,并有通道与股动脉相通而又与股动脉分离,多普勒检查可显示瘤颈部有典型的往返式血流信号。应用7.5 MHz超声探头(PLT-704SBT)指引凝血酶注射液的瘤体内注射技术,先将超声探头置于IFAP的垂直上方精确定位瘤体,测量瘤体的长、宽和高,计算瘤体体积,测量瘤体的上端距离皮肤的垂直距离(以此可以推断进针的距离即可触及IFAP);再避开超声定位的穿刺点,从侧面再次检测IFAP,目的是为了观察穿刺针进入IFAP的整个过程;助手将凝血酶冻干粉(南京新百药业有限公司,国药准字:H32025081)用0.9%的生理盐水稀释成100 U/mL(远低于国外500 U/mL的同类研究[1])抽吸至5 mL注射器内连接至三通阀的侧端备用,另取1 mL皮试专用注射器(可以少许生理盐水充填或仅为空注射器)连接至该三通阀的末端,并于头端连接皮试注射器的针头(图1)。沿超声引导的穿刺点进针至相应的距离,回抽皮试注射器,见到回血后反推注,超声图像可见血液的射流影,并可见针头影以及其所在瘤体的位置,如针头位于IFAP的底部或中部,针头方向并未直接正对着瘤颈部,则将皮试注射器内的血液排空后,将三通阀转向凝血酶溶液侧,抽取1 mL后再次转动三通阀至针头侧,持续、缓慢推注凝血酶溶液(0.1 mL/s)至瘤体内,同时密切注视超声显示的IFAP瘤体的变化,如见血栓逐渐形成超过瘤体体积的80%左右并伴有瘤颈部往返式血流信号的减少,则停止注射,观察3~5 min,血栓会逐渐填充整个瘤体并阻断进入IFAP的血流。
1.3 操作注意事项
术前标注患侧足背动脉搏动点,以便操作后对照;术前患侧足部监测的血氧饱和度,与操作后的同一部位的血氧饱和度对照。操作成功后仅以消毒棉签轻按穿刺点约30 s,待止血后以消毒敷贴覆盖即可,无须加压包扎,继续卧床12 h即可下床活动。
1.4 有效性定义
介入操作后超声检查显示IFAP瘤腔内充满血栓,多普勒显示瘤颈部无异常血流信号,听诊局部无血管杂音或杂音显著减弱,无并发症发生,住院期间无症状反复。
1.5 介入并发症定义
介入操作后出现局部股动脉血栓形成,患侧下肢栓塞,足背动脉血氧饱和度异常,局部感染等。
1.6 统计学处理
计量资料以均数±标准差表示,应用SPSS17.0软件进行统计学分析,治疗前后指标比较采用配对t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 临床参数
本组病例中,高血压22例(78.6%),高脂血症8例(28.6%),糖尿病9例(32.1%),股动脉穿刺术后使用低分子肝素22例(78.6%),BMI>25的患者23例(82.1%)。所有患者正使用双重抗血小板药物(肠溶阿司匹林0.1 g,每日1次;氯吡格雷75 mg,每日1次);27例(96.4%)患者使用他汀类药物治疗;21例(75%)患者存在穿刺部位皮下瘀斑;局部血肿直径<5 mm 7例(25%),5~10 mm 13例(46.4%),>5 mm 8例(28.6%);12例(42.9%)患者局部有不同程度的皮肤破溃或坏死;26例患者使用了7F的血管鞘,2例使用了8F的血管鞘;20例IFAP为简单型(仅有一个瘤体),8例为复杂型(有两个相互连接的瘤体)。
图1 皮试专用注射器
2.2 疗效分析
所有患者瘤颈直径(1.7±0.4)mm,凝血酶注射剂量(112.7±24.6)U,起效时间(2.4±3.3)s。术后均未有远端血管栓塞并发症发生。超声结果见图1,注射凝血酶前可见大量多普勒血流影由股动脉进入IFAP瘤体内,瘤体内无血栓影;注射凝血酶后可见IFAP瘤体内形成大量血栓影,股动脉内的多普勒血流影无法进入瘤体内。注射凝血酶前后患趾血氧饱和度及瘤体体积变化情况见表1。
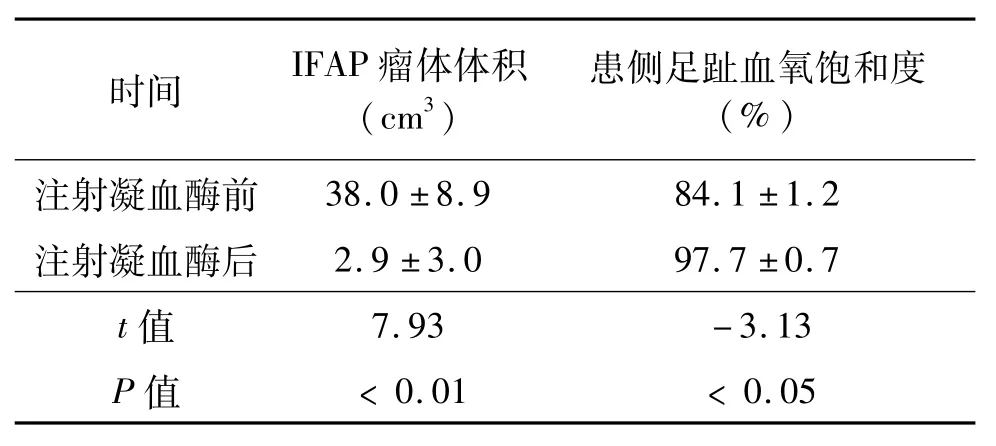
表1 注射凝血酶治疗股动脉假性动脉瘤的效果分析
3 讨论
IFAP是经股动脉介入诊治后不常见但处理困难的穿刺部位严重并发症之一,发生率约0.05%~4%,常与局部没有充分的压迫止血、同时穿刺同侧的股动静脉、高血压状态、肥胖、血液透析、股动脉重度钙化、过低的穿刺点和透壁穿刺、使用大尺寸的鞘管和过度抗栓抗凝治疗有关[2-3]。外科曾一度被认为是治疗IFAP的“金标准”,但较高的手术并发症[尤其是对于正在接受双重抗血小板和(或)抗凝治疗的患者出血发生率更高]、创伤较大和患者的接受程度使该方法的实施受到一定限制。IFAP局部持续压迫方法简便易行,但复发率高,虽然超声引导的局部压迫法效果更佳,但长时间的制动、局部的疼痛以及压迫部位缺乏长久的固定性和压迫导致的肢体远端缺血,使得效果仍不满意[3-4]。有报道认为超声引导的IFAP瘤体内凝血酶注射法疗效满意,成功率可高达90%以上,并发症发生率仅为2%[5]。
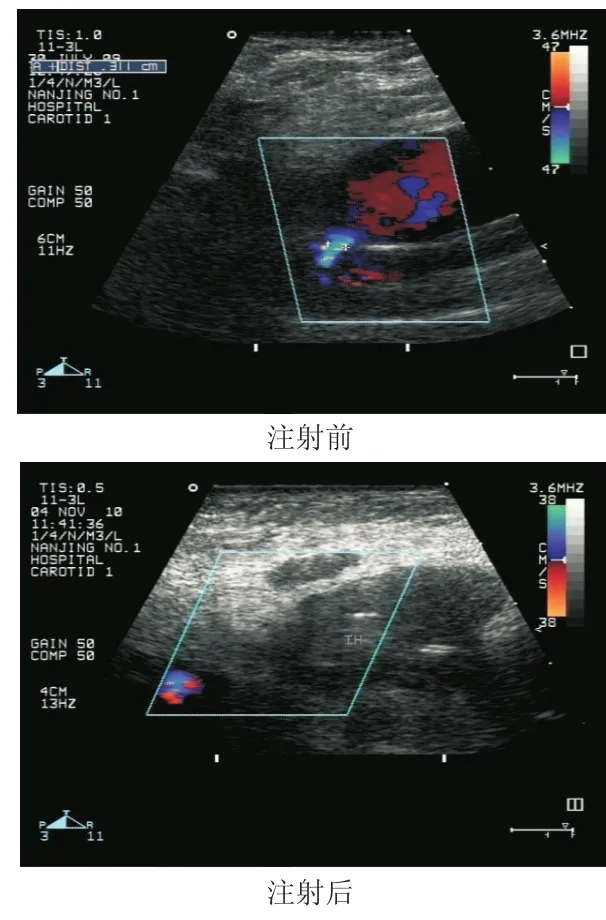
图2 IFAP注射凝血酶前后的超声影像
本研究的入选病例中,肥胖(BMI>25)发生的比例较高,同时术后低分子肝素的使用、介入医生勤于桡动脉途径而疏于股动脉径路等有可能是导致IFAP发生的原因;常规压迫治疗IFAP易导致局部皮肤的破溃甚至坏死;同时部分患者对压迫法的耐受不佳和潜在的迷走反射,更凸显了常规压迫法的弊端[6]。本研究表明使用小剂量的凝血酶可显著缩小瘤体,可能与我们采用了持续注射法(0.1 mL/s)有关。持续注射既保证瘤体内的血栓有足够的时间充分形成血栓,又避免了国外采用的bolus注射法的缺点,bolus法一旦停止了注射,针头内很快会形成血栓,导致注射无法延续,甚至必须更换针头重新穿刺,增加了并发症的可能[7]。
超声引导是关键步骤之一,注射前对瘤体的整体评估、注射中观察针头的位置和瘤体内血栓形成的过程、多普勒血流由股动脉流进瘤体量的减少,有利于避免肢体远端严重并发症的发生,这与超声医生的配合密不可分。我们认为超声引导的经皮小剂量凝血酶注射治疗IFAP安全有效,是常规压迫法的有效补充手段之一。但本研究也存在局限性:① 本研究为一小样本的回顾性观察研究;②本研究中对于治疗的IFAP的形态学要求严格,要求瘤颈小(一般<2 mm);③由于IFAP是小概率事件,而且该技术需要结合临床介入医生的操作水平、超声专科医生的检查技能以及IFAP形态学的适合,故在数个心脏中心行前瞻性的大样本随机对照研究相对困难,如需得到更多的循证医学证据,则需要更多中心共同参与的随机化对照研究。
[1] Gürel K,Gür S,Özkan U,et al.US-guided percutaneous thrombin injection of postcatheterization pseudoaneurysms[J].Diang Interv Radiol,2012,18(3):319-325.
[2] Krueger K,Zaehringer M,Strohe D,et al.Postcatheterization pseudoaneurysm:results of US-guided percutaneous thrombin injection in 240 patients[J].Radiology,2005,236(3):1104-1110.
[3] Middleton WD,Dasyam A,Teefey SA.Diagnosis and treatment of iatrogenic femoral artery pseudoaneurysms[J].Ultrasound Q,2005,21(1):3-7.
[4] Olsen DM,Rodriguez JA,Vranic M,et al.A prospective study of ultrasound scan-guided thrombin injection of femoral pseudoaneurysm:a trend toward minimal medication[J].JVasc Surg,2002,36(4):779-782.
[5] Paulson EK,Nelson RC,Mayes CE,etal.Sonographically guided thrombin injection of iatrogenic femoral pseudoaneurysms:further experience of a single institution[J].AJR Am JRoentgenol,2001,177(2):309-316.
[6] Bellmunt S,Dilme J,Barros A,et al.Compression assisted by removable coils as a new treatment for iatrogenic femoral pseudoaneurysms[J].JVasc Sur,2011,53(1):236-238.
[7] Lewandowski P,Maciejewski P,Wasek W,et al.Efficacy and safety of closing postcatheteriation pseudoaneurysms with ultrasound-guided thrombin injections using two approaches:bolus versus slow injection.A prospective randomized trial[J].Kardiol Pol,2011,69(9):898-905.
R733.21
B
1671-7783(2014)02-0163-03
10.13312/j.issn.1671-7783.y130280
2013-12-25 [编辑] 何承志

