大豆异黄酮对动脉粥样硬化大鼠炎症分子相关基因表达的影响
罗洁,秦旭,韦余,钱民章
(1.遵义医学院生物化学教研室,贵州遵义563003;2.遵义医学院附属医院药剂科,贵州遵义563003)
大豆异黄酮对动脉粥样硬化大鼠炎症分子相关基因表达的影响
罗洁1,秦旭1,韦余2,钱民章1
(1.遵义医学院生物化学教研室,贵州遵义563003;2.遵义医学院附属医院药剂科,贵州遵义563003)
目的:研究大豆异黄酮(soybean isoflavone,SIF)对动脉粥样硬化(atherosclerosis,As)大鼠血管中促As炎症相关基因表达的影响。方法:建立As大鼠模型,随机分成正常组、模型组、模型给药组和正常给药组;HE染色观察各组大鼠胸主动脉病理改变;实时PCR和免疫组化检测血管中促As炎症的相关基因表达量。结果:模型组胸主动脉严重萎缩、钙化,出现硬化斑块;模型给药组As病变较模型组明显减轻;正常组和正常给药组胸主动脉无病理改变。模型组胸主动脉中单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、CC类趋化因子受体2(C-C chemokine receptor,CCR2)、单核细胞趋化蛋白-1诱导蛋白(MCPIP)和C反应蛋白(CRP)mRNA表达量较正常组明显升高(P<0.01或P<0.05);模型给药组上述4种基因mRNA表达量均较模型组明显降低(P<0.01或P<0.05);正常组与正常给药组4种基因mRNA表达量间的差异无统计学意义。免疫组化结果显示,与正常组比较,模型组MCPIP、MCP-1、核因子κB(NF-κB)阳性染色和范围均增多(P<0.01),模型给药组3种蛋白的阳性染色和范围都较模型组明显减少(P<0.05);正常组和正常给药组3种蛋白表达间的差异无统计学意义。结论:大豆异黄酮能显著降低促As炎症的相关基因表达,明显抑制大鼠As病变。
动脉粥样硬化;大豆异黄酮;单核细胞趋化蛋白-1/CC类趋化因子受体2;单核细胞趋化蛋白-1诱导蛋白;C反应蛋白;核因子κB
大豆异黄酮(soybean isoflavone,SIF)是食品大豆中的一类具有雌激素样作用的生物活性物质,主要成分有染料木黄酮(genistein,Gn)、大豆素(daidzein)和大豆苷元(isoflavones aglycone)。研究发现,每天摄入一定量的大豆异黄酮可使血液中胆固醇下降7%~10%,冠心病的危险性减少15%~20%[1]。进一步的研究表明大豆异黄酮可通过降血脂、抗氧化、抑制血栓形成等作用抗动脉粥样硬化(atherosclerosis,As)[2]。目前SIF已作为保健品投放市场,并受到中老年人特别是绝经后妇女的关注。
As是一个多因素参与的复杂疾病[3],发病机制至今尚未完全明了。Ross[4]在损伤反应学说的基础上明确提出:As是一种炎症性疾病而不是单纯的由于脂质的沉积所致。国内外的研究均发现,炎性相关分子单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)及其特异性受体CCR2(C-C chemokine receptor)、单核细胞趋化蛋白-1诱导蛋白(monocyte chemotactic protein-1 induced protein,MCPIP)、C反应蛋白(CRP)在其病变形成和发展中发挥重要作用[5]。我们前期的工作发现,SIF中的主要成分染料木黄酮能通过抑制核因子κB(NF-κB)的激活抑制氧化性低密度脂蛋白(ox-LDL)诱导的血管平滑肌细胞中MCP-1的表达[6],还能抑制肝细胞中CRP表达[7],提示SIF抗As的作用与减少炎症相关分子表达有关。本研究通过建立大鼠As模型,在整体水平观察SIF对As病变形成及炎症相关基因表达的影响,旨在进一步阐明SIF抗As的机制。
1 材料与方法
1.1 实验动物
雄性SD大鼠41只,体质量220~300 g,由第三军医大学大坪医院动物中心提供,合格证号SCXK(渝)2007 0005。
1.2 药物及试剂
1.2.1 药物 大豆异黄酮胶囊(原产地:美国康麦斯保健品公司;经销处:上海康麦斯保健品有限公司;批号:POMONA CA91766 USA;规格:500 mg/粒,每粒含大豆异黄酮50 mg;用法用量:每日1次,每次1粒)。维生素D3(生产厂家:北京索莱宝生物科技有限公司;规格:1 g,4 000万IU/g;生产批号:V8070)。水合氯醛(生产厂家:国药集团化学试剂有限公司;生产批号:20071226;规格:250 g)。
1.2.2 试剂 甲醛溶液(重庆川江化工有限公司,生产批号:20120210,规格:500 mL);兔抗MCP-1、MCPIP、NF-κB多克隆抗体(北京博奥森公司产品);免疫组化检测试剂盒(基因科技上海有限公司,批号:GK500705);反转录试剂盒(宝生物工程大连有限公司);Trizol(宝生物工程大连有限公司),DEPC(焦碳酸二乙酯),SYBR Permix Ex TaqTMⅡ(宝生物工程大连有限公司);引物均由宝生物工程大连有限公司合成。
1.3 仪器
实时荧光定量PCR仪(美国Bio-Rad公司),Eppendorf Master-cycler Gradient PCR仪(德国Eppendorf公司),Centrifuge 5415D离心机(德国Eppendorf公司),NanoDrop2000微量紫外分光光度计(美国Thermo公司),Leica光学显微镜及照相系统(德国)。
1.4 方法
1.4.1 大鼠As模型的建立、分组及给药方法 大鼠用普通饲料适应性喂养1周后,随机分为正常对照组、模型组、模型给药组、正常给药组。正常对照组、正常给药组饲以普通饲料,正常给药组每天用SIF灌胃,正常对照组每天用等量蒸馏水灌胃。模型组、模型给药组饲以高脂饲料(82.5%普通饲料、10%猪油、2%胆固醇、5%蔗糖、0.5%胆盐、0.2%丙硫氧嘧啶),并加用维生素D3溶液(以食用植物油为溶剂溶解维生素D3,按60万IU/kg给药)灌胃建立大鼠As模型,间隔30 d后重复给维生素D3溶液30万IU/kg;从制模第2天起,模型给药组每天用SIF灌胃,模型组以等量蒸馏水灌胃。每天的SIF剂量计算方法:成人每天用SIF剂量(50 mg)÷60÷ 0.162×5(mg/kg),得出大鼠每天给SIF剂量为26 mg/kg。将市售大豆异黄酮去胶囊取粉末,用双蒸水配制成0.26 g/100 mL的混悬液,按大鼠体质量1 mL/100 g给药。
1.4.2 取材 实验7周后,禁食12 h,称重,用7%水合氯醛腹腔注射麻醉(0.5 mL/100 g),取下大鼠胸主动脉,剪下一段置于10%中性甲醛溶液中,用于制作切片,另再剪下一段置于Trizol中,-80℃存放,用于组织RNA提取。
1.4.3 胸主动脉病理形态学观察 组织在10%中性甲醛溶液中固定24 h后,常规脱水、透明、浸蜡和石蜡包埋,连续切片(厚度4μm),HE染色,光镜下观察其病理改变,用图像分析系统采集图像并在显微镜下拍照。
1.4.4 实时PCR检测血管中MCPIP、MCP-1、CCR2、CRPmRNA的表达量 按一般RNA提取步骤提取RNA,用NanoDrop2000微量紫外分光光度计检测RNA的浓度及纯度,光密度值在1.8~2.1为理想值。采用Eppendorf Master-cycler Gradient PCR仪反转录后,用实时荧光定量PCR仪进行扩增。
MCP-1引物序列:上游5′-CTATGCAGGTCTCTGTCACGCTTC-3′,下游5′-GACTCATCGTACTCCTGCTTGCTG-3′,扩增产物片段长度146 bp;MCPIP引物序列:上游5′-TCGGCCAGATGTGCCTATCA-3′,下游5′-CTTGGAGGTCCCGGTATGTGTC-3′,扩增产物片段长度191 bp;CCR2引物序列:上游5′-TGTGAGGCTCATCTTTGCCATC-3′,下游5′-CAACCTGCATGGCCTGGTCTA-3′,扩增产物片段长度145 bp;CRP引物序列:上游5′-TTGACGCGAATCAGTCTTTG-3′,下游5′-CATTGGGGCTGAATACCCTA-3′,扩增产物片段长度114 bp;β-肌动蛋白引物序列:上游5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游5′-GACTCATCGTACTCCTGCTTGTCTTT-3′,扩增产物片段长度150 bp。
反应条件:95℃预变性10 min;95℃变性10 s,60℃退火45 s;熔解曲线生成反应体系95℃1 min,55℃1 min;55℃10 s(80个循环)。计算出每份样品中目的基因进行PCR扩增时达到阈值时的Ct,并通过内参基因β-肌动蛋白校正,计算公式:ΔCt=Ct-同基因所有样本中间值,基因的表达量=2-ΔΔCt,相对定量=目的基因表达量/内参基因的表达量,组内基因表达量采用均数±标准误(¯x±SE)表示。
1.4.5 免疫组化法检测血管中MCPIP、MCP-1、NF-κB的表达 血管组织经10%甲醛固定24 h,石蜡包埋切片(厚度4μm),切片在37℃烘箱中放置24 h后采用SABC法进行免疫组化染色。用PBS稀释一抗,稀释比为1∶100;另用PBS取代一抗作为阴性对照。光学显微镜观察免疫组化结果,拍照记录。用IPP 6.0软件分析组织中表达蛋白的积分光密度值(integral optical density,IOD),统计结果用均数±标准差(±s)表示。
1.5 统计学分析
采用SPSS 16.0软件进行统计学分析,组间差异比较采用单因素方差分析,进一步两两比较采用Dunnett-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠胸主动脉组织的大体形态
正常对照组大鼠胸主动脉血管壁光滑,无增厚、硬化和斑块,无病变迹象;模型组血管出现萎缩、硬化,血管壁增厚,有多处钙化斑块;模型给药组血管壁增厚、硬化,能见少量钙化斑块;正常给药组血管无病变迹象。见图1。
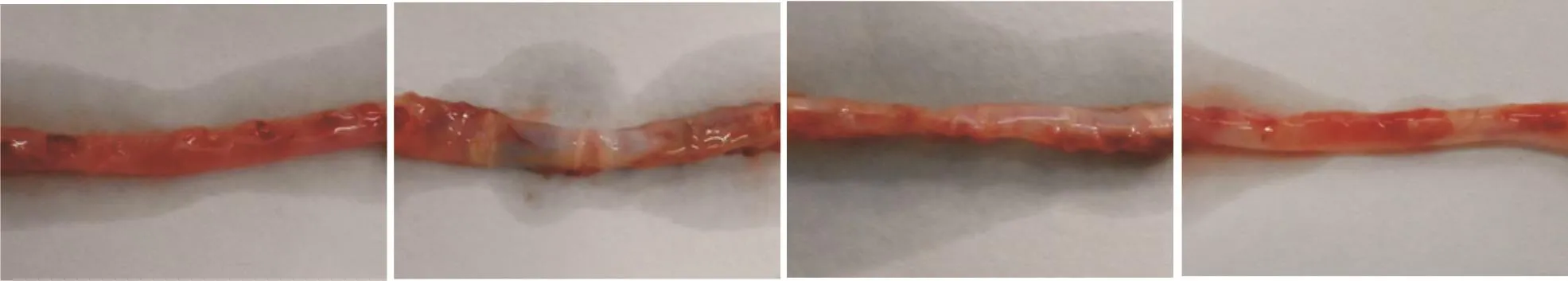
图1 动脉粥样硬化大鼠胸主动脉组织大体观察
2.2 大鼠胸主动脉病理学检查结果
见图2。正常对照组动脉壁薄厚均匀,内膜光滑,无增厚,中膜平滑肌细胞排列整齐,外膜结缔组织无明显变化;模型组动脉内皮细胞脱落,大部分血管严重萎缩、钙化,出现大量硬化斑块,血管壁结构层次不清晰;模型给药组部分血管肌层萎缩、钙化,有硬化斑块,血管壁结构层次不清晰;正常给药组动脉壁薄厚均匀,内膜光滑,无增厚。
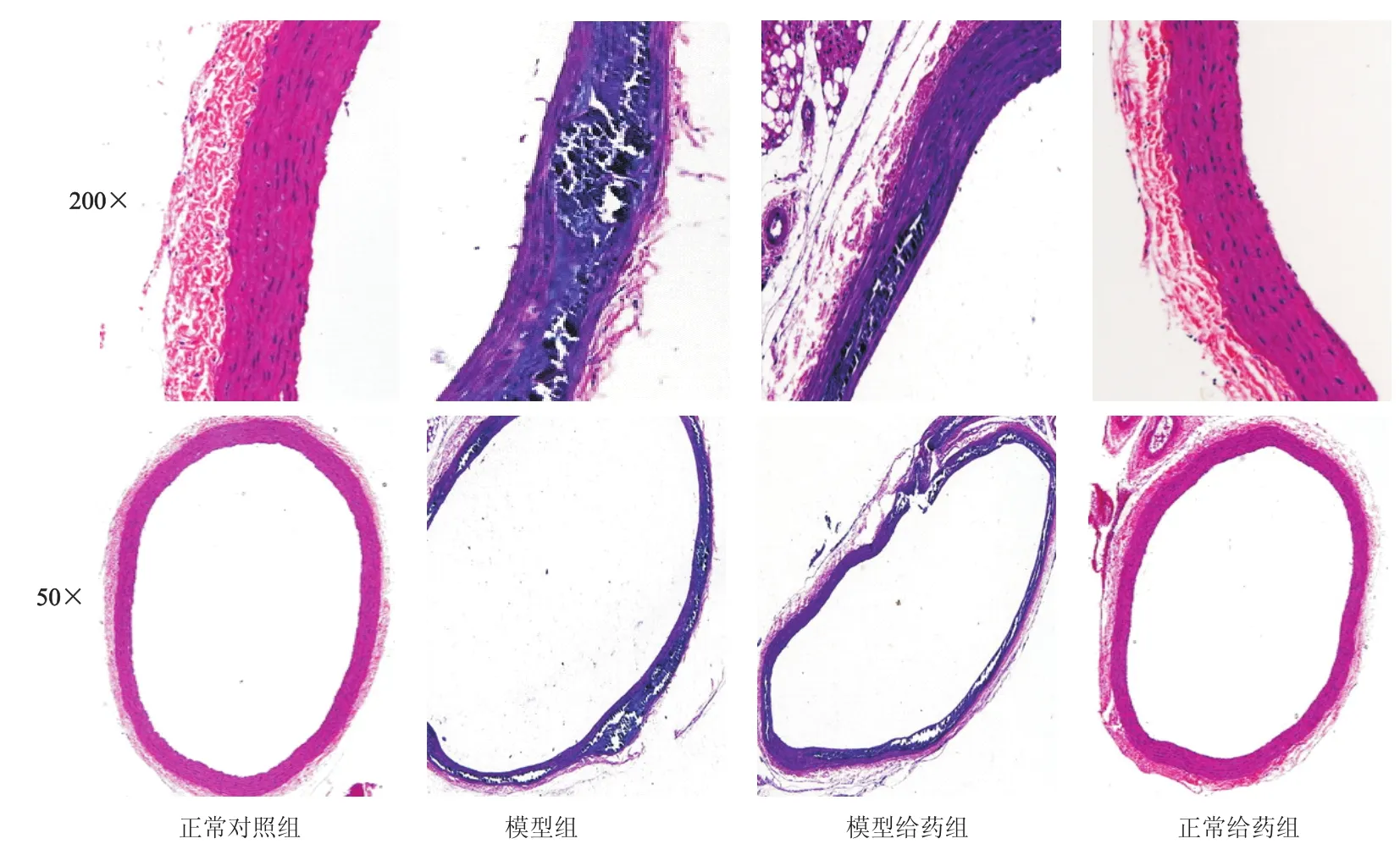
图2 动脉粥样硬化大鼠胸主动脉HE染色结果
2.3 SIF对As大鼠胸主动脉MCP-1、CCR2、MCPIP和CRPmRNA表达量的影响
实时定量PCR检测结果显示,与正常对照组比较,模型组MCP-1,CCR2,MCPIP和CRP mRNA表达显著升高(P<0.01或P<0.05);与模型组比较,模型给药组的各基因表达均有明显降低(P<0.01或P<0.05)。正常给药组的各基因表达与正常对照组比较无明显差异。见表1。
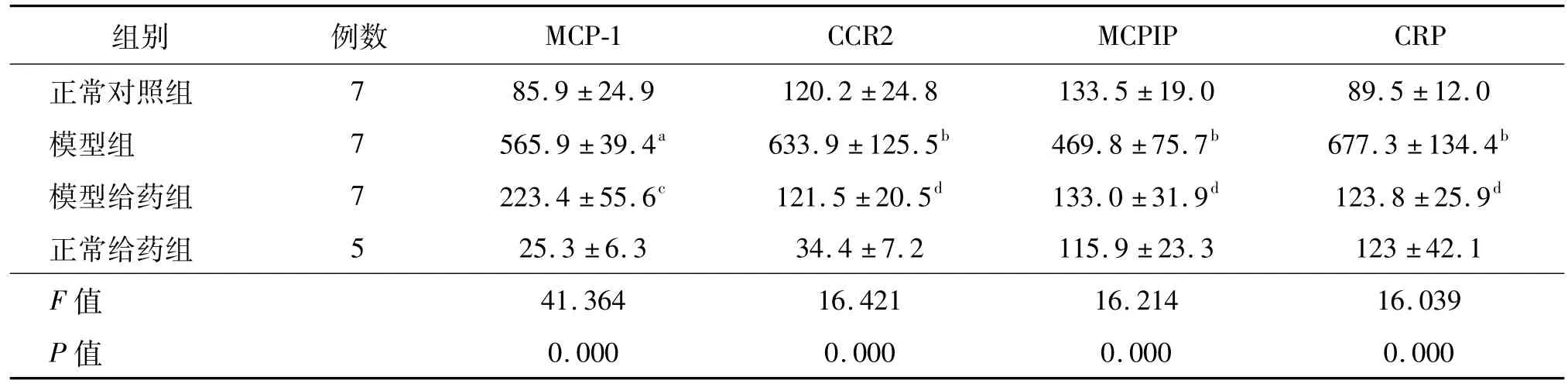
表1 动脉粥样硬化大鼠胸主动脉MCP-1、CCR2、MCPIP和CRPm RNA表达量 ¯x±SE
2.4 免疫组化法检测As大鼠胸主动脉中MCP-1、MCPIP、NF-κB蛋白的表达
400倍镜下免疫组化结果显示(图3,表2),模型组胸主动脉中的MCP-1、MCPIP和NF-κB 3种蛋白表达量均比正常对照组明显增多(P<0.01);而模型给药组3种蛋白表达量比模型组明显减少,差异有统计学意义(P<0.05);正常对照组与正常给药组的各蛋白表达差异无统计学意义;
3 讨论
MCP-1属于趋化因子CC亚家族,MCP-1与CCR2结合后,能激活并诱导单核细胞在动脉血管壁上聚集,形成泡沫细胞。MCP-1还可诱导血管内皮细胞凋亡及平滑肌细胞增殖[8-9],是导致As的一个重要因素。MCP-1的表达随动脉粥样硬化程度增加而增加,抑制MCP-1表达或封闭MCP-1/CCR2通路能减少血管损伤或粥样硬化导致的小鼠内膜增生[9],因此,针对MCP-1的干预措施有可能降低心血管疾病的危险性。
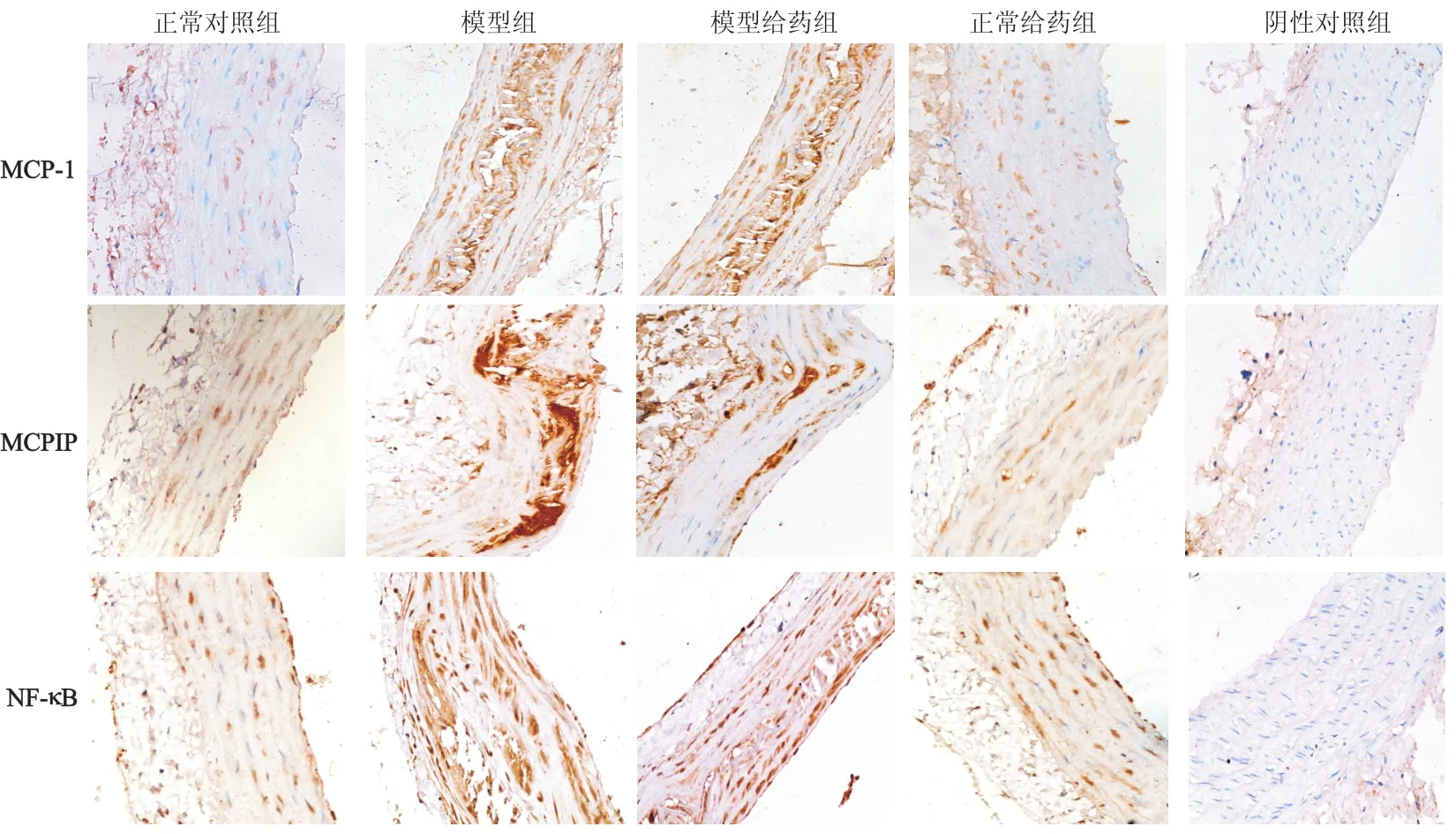
图3 免疫组化检测大鼠胸主动脉中MCP-1、MCPIP和NF-κB蛋白的表达(SABC法×400)
表2 SIF对大鼠胸主动脉MCP-1、MCPIP、NF-κB蛋白表达量的影响±s,n=5,IOD×10-3
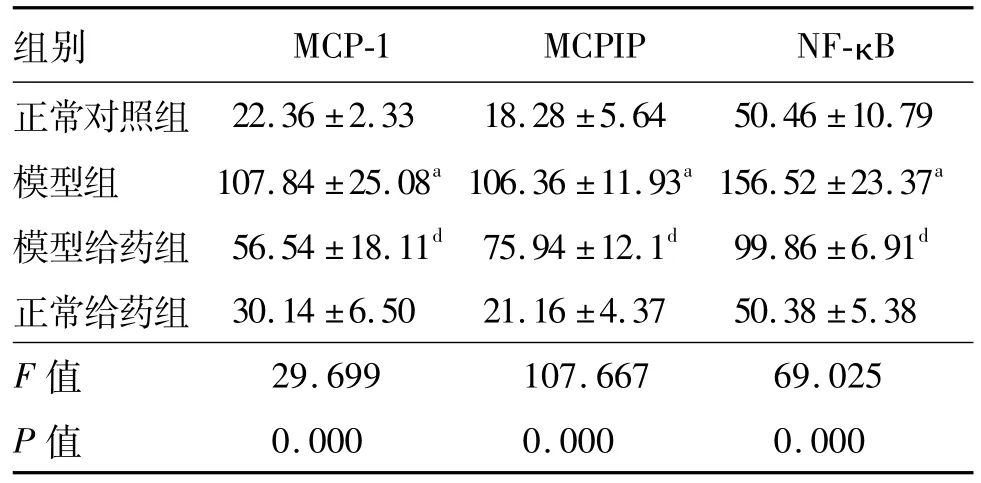
表2 SIF对大鼠胸主动脉MCP-1、MCPIP、NF-κB蛋白表达量的影响±s,n=5,IOD×10-3
a:P<0.01,与正常对照组比较;d:P<0.05,与模型组比较
组别 MCP-1 MCPIP NF-κB正常对照组22.36±2.33 18.28±5.64 50.46±10.79模型组 107.84±25.08a 106.36±11.93a 156.52±23.37a模型给药组 56.54±18.11d 75.94±12.1d 99.86±6.91d正常给药组 30.14±6.50 21.16±4.37 50.38±5.38 F值29.699 107.667 69.025 P值0.000 0.000 0.000
MCPIP是Kalattukudy P.E小组2006年在探讨MCP-1在心血管疾病中的作用时发现的一个具有转录活性的锌指蛋白。该研究组在用MCP-1作用于人外周血单核细胞后,该蛋白被诱导表达,因此将其命名为单核细胞趋化蛋白-1诱导蛋白[10]。2010年 Qin等[11]报道,在高脂喂饲的ApoE-/-As模型鼠主动脉中MCPIPmRNA表达量比野生型鼠增加了2.5倍;在人As斑块组织中MCPIP表达也显著增加。后续的研究发现MCP-1与CCR2结合后,通过NF-κB信号通路诱导MCPIP的表达,MCPIP发挥其转录激活和(或)RNA酶活性参与动脉粥样硬化等多种病理过程[12-14]。
CRP主要在肝脏合成,近年来的研究表明,在人As活动期进展斑块内也能产生CRP,且这些局部产生的CRP是As时血清CRP升高的重要来源。CRP不仅可作为心血管疾病的一种标志,其本身还可作为介质通过多种机制促进As发生发展[5]。
本实验的结果显示,与正常组比较,模型组MCP-1、CCR2、MCPIP、CRP基因转录活性明显增加,MCP-1、MCPIP及调控两者表达的转录因子NF-κB蛋白表达增强,结果与既往报道一致,进一步证实了这几个炎性分子参与了As发生发展过程。
从大体和病理观察的结果看,模型给药组大鼠血管粥样硬化病变较模型组明显减轻,进一步证实SIF可抑制As病变的形成。在模型给药组中,实验所检测的几个炎性分子mRNA转录量都较模型组明显减少,说明SIF可以抑制这几个炎性基因的表达,提示SIF抑制大鼠血管动脉粥样硬化病变形成与降低炎症分子的表达有密切关系。近期研究发现[15-16],MCPIP除由MCP-1诱导表达外,还能被IL-1β、TNF-α诱导,而且IL-6、IL-1和TNF-α也是诱导CRP的主要因子。MCP-1、IL-1β、TNF-α及IL-6的表达均受NF-κB的调控,免疫组化的结果发现,SIF抑制了NF-κB的激活,提示SIF可能是通过抑制NF-κB激活进而下调MCP-1及其他炎性分子表达,从而进一步减少了CRP和MCPIP的表达。
本实验设置了正常给药组与正常组比较,正常给药组血管大体观及病理检查均无改变,各炎性基因的表达差异无统计学意义,表明SIF对于正常血管中炎性基因的表达没有显著性的影响,也没有发现其会对血管造成损害。
综上所述,SIF能够抑制大鼠As病变的形成,其机制可能与SIF抑制NF-κB的活化,下调促As病变的炎症相关基因MCP-1、CCR2、MCPIP及CRP的表达有关。本研究从新的角度报道了SIF抗As的作用机制,为已投入市场的大豆异黄酮心血管保护作用提供了新的实验依据。
[1] 季华,王桔,于晶.大豆异黄酮的生理作用及应用前景[J].中国现代药物应用,2011,5(16):128-129.
[2] 刘亚琴,黄兆铨.大豆异黄酮抗动脉粥样硬化作用的研究进展[J].心脑血管病防治,2007,7(2):120-122.
[3] 唐朝克.以ABCA1为靶点防治动脉粥样硬化[J].中国动脉硬化杂志,2011,19(11):879-884.
[4] Ross R.Atherosclerosis-an inflammatory disease[J].N Engl JMed,1999,340(2):115-126.
[5] 范乐明.动脉粥样硬化炎症机制的再认识[J].中国动脉硬化杂志,2005,13(3):249-253.
[6] 张闻宇,娄桂予,钱民章.染料木黄酮对ox-LDL诱导人静脉平滑肌细胞MCP-1表达的影响[J].营养学报,2004,26(4):284-287.
[7] 徐海燕,唐俊利,孟爱霞,等.染料木黄酮对人肝细胞C-反应蛋白表达的影响[J].江苏大学学报:医学版,2007,17(4):305-308.
[8] Zhang X,Liu X,Shang H,et al.Monocyte chemoattractant protein-1 induces endothelial cell apoptosis in vitro through a p53-dependent mitochondrial pathway[J].Acta Biochim Biophys Sin(Shanghai),2011,43(10):787-795.
[9] 官秀梅,钱民章.单核细胞趋化蛋白1对人脐静脉平滑肌细胞增殖的影响[J].中国动脉硬化杂志,2005,13(3):309-312.
[10] Zhou LM,Azfer A,Niu JL,et al.Monocyte chemoattractant protein-1 induces a novel transcription factor that causes cardiac myocyte apoptosis and ventricular dysfunction[J].Circ Res,2006,98(9):1177-1185.
[11] Qin YF,Liang J,She ZG,et al.MCP-induced protein 1 suppresses TNFα-induced VCAM-1 expression in human endothelial cells[J].FEBS J,2010,584(2010):3065-3072.
[12] Kasza A,Wyrzykowska P,Horwacik I,et al.Transcription factor Elk-1 and SRF are engaged in IL-1-dependent regulation of ZC3H12A expression[J].BMC Mol Biol,2010,11:14.
[13] Kolattukudy PE,Niu J.Inflammation,endoplasmic reticulum stress,autophagy,and the monocyte chemoattractant protein-1/CCR2 pathway[J].Circ Res,2012,110(1):174-189.
[14] Niu J,Kolattukudy PE.Role of MCP-1 in cardiovascular disease:molecularmechanisms and clinical implications[J].Clin Sci(Lond),2009,117(3):95-109.
[15] Mizgalska D,Wegrzyn P,Murzyn K,et al.Interleukin-1-inducible MCPIP protein has structural and functional properties of RNase and participates in degradation of IL-1 betamRNA[J].FEBSJ,2009,276(24):7386-7399.
[16] Liang J,Wang J,Azfer A,et al.A novel CCCH-zinc finger protein family regulates proinflammatory activation ofmacrophages[J].J Biol Chem,2008,283(10):6337-6346.
Effect of soy isoflavones on the expression of inflammatory molecules gene in atherosclerosis rats
LUO Jie1,QIN Xu1,WEIYu2,QIAN Min-zhang1
(1.Department of Biological Chemistry,ZunyiMedical College,Zunyi Guizhou 563003;2.Department of Pharmacy,the Affiliated Hospital of ZunyiMedical College,ZunyiGuizhou 563003,China)
Objective:To investigate the effects of soy isoflavones(SIF)on the expression of gene for proinflammatory of atherosclerosis(As)in the As rats.M ethods:To establish the ratsmodel of As,were randomly divided into normal control,model,model+SIF and normal+SIF group;the pathological changes of thoracic aorta of rats in each group were observed by HE staining;Real time-PCR and immunohistochemical detection of the expression of gene for proinflammatory of As in vessels.Results:Themodel group showed severe atrophy and calcification of thoracic aorta compared with normal control group,even appear atherosclerotic plaques;compared with model group,model+SIF group showed actions in lessening the atherosclerosis lesion obviously;both normal control group and normal+SIF group without pathological changes of thoracic aorta.Compared with model group,mRNA level of MCP-1/CCR2,MCPIP and CRP were higher than that in normal control group of thoracic aorta(P<0.01 or P<0.05);mRNA level of the four genes inmodel+SIF group of thoracic aortawere lower than that inmodel group;there was not significant difference in mRNA level of the four genes between normal control group and normal+SIF group.Immunohistochemistry results showed thatexpression of positive staining and range ofMCPIP,MCP-1,and NF-κB in model group were higher than in normal control group(P<0.01),the expression of positive staining and range of the three protein in model+SIF group were lower than in model group(P<0.05).Between the normal control group and the normal+SIF group,the expression of positive staining and range of the three protein were no significant difference.Conclusion:SIF can obviously decrease the expression of genes related to proinflammatory of As,and inhibit the atherosclerosis formation in rats.
atherosclerosis;soybean isoflavones;MCP-1/CCR2;MCPIP;CRP;NF-κB
R543.1
A
1671-7783(2014)02-0099-06
10.13312/j.issn.1671-7783.y130283
book=104,ebook=17
遵义医学院2012年招标课题(F-613)
罗洁(1986—),女,硕士研究生;钱民章(通讯作者),教授,博士生导师,E-mail:qian_mzh@hotmail.com
2014-01-03 [编辑]何承志

