稳定表达狂犬病毒糖蛋白的重组新城疫病毒对人肺腺癌A549细胞荷瘤鼠瘤体生长的影响
贾丽娟,刘洋,张金,梁冰,张杰,严玉兰
(1.江苏大学临床医学院,江苏镇江212001;2.江苏大学附属人民医院呼吸科,江苏镇江212002)
稳定表达狂犬病毒糖蛋白的重组新城疫病毒对人肺腺癌A549细胞荷瘤鼠瘤体生长的影响
贾丽娟1,2,刘洋2,张金2,梁冰1,张杰1,严玉兰2
(1.江苏大学临床医学院,江苏镇江212001;2.江苏大学附属人民医院呼吸科,江苏镇江212002)
目的:探讨重组稳定表达狂犬病毒糖蛋白的新城疫病毒疫苗(recombinant avirulent newcastle disease virus LaSota strain expressing the rabies virus glycoprotein,rl-RVG)对人肺腺癌A549细胞荷瘤鼠的生长抑制作用及其可能的免疫机制。方法:建立A549荷瘤鼠模型并随机分为rl-RVG组、新城疫病毒(NDV)组和对照组,每组10只,分别于瘤体注射rl-RVG,NDV和PBS,每周2次,共3周。测量3组瘤体体积;免疫组织化学法测NDV及狂犬病毒糖蛋白(rabies virus glycoprotein,RVG)的表达;HE染色观察荷瘤小鼠的瘤体、脾、肺等组织病理改变;流式细胞术检测荷瘤小鼠脾脏NK细胞数。结果:与对照组相比,rl-RVG组及NDV组荷瘤鼠瘤体增长缓慢;NDV在rl-RVG组和NDV组中均有表达,而RVG仅在rl-RVG组中表达;rl-RVG组及NDV组瘤体出现大量凋亡坏死组织、脾脏多核巨细胞明显增多、肺组织炎症反应明显;rl-RVG组和NDV组NK细胞数明显增多,且rl-RVG组明显高于NDV组。结论:rl-RVG成功转染至A549荷瘤鼠,对其瘤体生长有着明显的抑制作用,可能与rl-RVG激活机体的免疫反应相关。
重组新城疫病毒;肺癌;免疫反应
溶瘤治疗是一种集基因、免疫治疗于一体的新的癌症治疗方法。近年来,研究发现多种病毒具有溶瘤作用,其中新城疫病毒(newcastle disease virus,NDV)的抗肿瘤作用已应用于临床试验研究;结果显示,NDV对结肠癌、骨肉瘤、胶质瘤、人卵巢癌、急性单核细胞白血病及乳腺癌等肿瘤细胞的生长,有明显的抑制作用[1-3],但关于其对肺癌的研究尚少。研究显示,对于人和动物而言,NDV是一个很有应用价值的疫苗载体,通过对其重组,可以更有效地作用于肿瘤细胞[4-6]。
狂犬病毒的基因组为不分节段的单股负链RNA,11 923~11 928核苷酸[7]从3′到5′的方向有5个结构基因,依次是核蛋白、磷酸蛋白、间质蛋白、糖蛋白和转录大蛋白[8]。其中,狂犬病毒糖蛋白(rabies virus glycoprotein,RVG)是有效的保护性抗原,可以诱导产生抗体及细胞免疫。因此,不少研究者将其克隆到其他病毒载体以构建重组活病毒疫苗。
本研究拟观察稳定表达狂犬病毒糖蛋白的重组新城疫病毒疫苗(recombinant avirulent NDV LaSota strain expressing the rabies virus glycoprotein,rl-RVG)对人肺腺癌A549细胞荷瘤鼠的生长抑制作用,并探讨其可能机制。
1 材料与方法
1.1 材料
rl-RVG与NDV由中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室惠赠;实验小鼠购自扬州大学;人肺腺癌A549细胞为本室保存;DMEM及胎牛血清购自维森特公司;小鼠抗狂犬病毒ERA株G蛋白一抗购自美国Santa Cruz公司,鸡抗LaSota株NDV一抗由中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室惠赠,山羊抗鼠二抗购自北京康维世纪有限公司,兔抗鸡二抗购自Earthox公司,小鼠淋巴细胞分离液购自南京凯基生物科技发展有限公司,Anti-mouse CD3e PE购自美国eBioscience公司;FITC anti-mouse CD49b购自美国biolegend公司。
1.2 方法
1.2.1 A549荷瘤鼠的建立 取30只4周龄裸鼠,体质量18~22 g。人肺腺癌A549细胞复苏后移入含有10%胎牛血清和双抗的DMEM中,37℃,5% CO2培养。待细胞生长至指数期,胰酶消化后收集,PBS配制成5×108/mL浓度。每只小鼠腋下皮下注射0.3 mL A549悬液,经10 d左右,每只小鼠皮下均长成直径为5~20 mm的瘤体。
1.2.2 实验分组 将成瘤的裸鼠随机均分为3组,每组10只,分别为rl-RVG组,NDV组及对照组,分别于瘤体注射rl-RVG 6.3×108pfu,NDV 6×107pfu,PBS液300μL。每周2次,持续3周。第21天时处死小鼠,钝性剥离瘤体,取肺及脾等,一部分用4%低聚甲醛固定,另一部分于-80℃保存备用。
1.2.3 肿瘤生长曲线及抑瘤率 自第1次注射日(0 d)开始,每7天1次用游标卡尺测量瘤体短径(a)及长径(b)(包括皮肤厚度在内),计算瘤体体积(V):V=a2×b×0.52,并绘制肿瘤生长曲线。根据末次肿瘤体积计算抑瘤率,抑瘤率=(对照组平均肿瘤体积-实验组平均肿瘤体积)/对照组平均肿瘤体积×100%。
1.2.4 免疫组织化学法测NDV及RVG的表达取小鼠瘤体组织,4%甲醛固定24 h,石蜡包埋,5 μm连续切片,二甲苯透明10 min,梯度乙醇(100%,95%,80%)脱蜡,各5 min。3%H2O2室温孵育5~10 min,蒸馏水洗,PBS浸泡5 min,5%~10%正常山羊血清(PBS稀释)封闭,室温孵育10 min。弃血清,分别滴加鼠抗RVG(1∶200),鸡抗NDV(1∶200),37℃孵育2 h。PBS冲洗,分别滴加兔抗鸡IgG-HRP(1∶1 000)、羊抗鼠IgG-HRP(1∶1 000)工作液,室温孵育30 min。PBS冲洗,DAB染色,避光孵育4~5 min。自来水冲洗,蒸馏水洗1次,苏木素复染45 s至1min,脱水,中性树胶封片,倒置显微镜下观察。
1.2.5 HE染色观察组织病理改变 取小鼠瘤体、脾、肺组织,4%甲醛固定,石蜡包埋,5μm连续切片,脱蜡,HE染色,脱水,透明,封固后,于温箱中烤干后镜下观察。
1.2.6 流式细胞术检测rl-RVG转染后脾NK细胞(CD3-CD49b+)数量 取脾脏研磨成脾细胞悬液,用0.83%TrisNH4Cl破坏红细胞,PBS(pH=7.4)洗涤3次,染色缓冲液调整细胞密度为1×106/mL备用。取试管加入100μL脾细胞悬液,0.5μL CD49b FITC,2.5μLCD3e PE,振荡混匀,避光孵育30 min。加PBS 1.5mL洗1次,1 500 r/min离心5~10min,弃上清,加300μL PBS振荡重悬细胞,上流式细胞仪检测。每组均设同种型对照,Cellquest软件获取数据,WinMDI 2.9软件分析数据。
1.3 统计学方法
采用SPSS 19.0统计软件,数据以均数±标准差表示,多组数据经正态性检验和方差齐性检验后行单因素方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 A549荷瘤鼠模型的建立
将收集到的A549细胞悬液注入小鼠腋下皮下,经10 d左右,每只小鼠皮下均长成直径为5~20 mm的瘤体。见图1。
图1 A549细胞荷瘤裸鼠
2.2 肿瘤生长曲线及抑瘤率
21 d后,rl-RVG组,NDV组和对照组3组瘤裸鼠瘤体体积分别为(779.68±123.59)mm3,(1 073.57±111.82)mm3,(1 716.17±241.70)mm3(F=36.289,P<0.01)。rl-RVG组和NDV组肿瘤体积明显小于对照组(t分别为-5.970,-4.814,P均<0.05),表明其肿瘤生长缓慢,且rl-RVG组瘤体生长较NDV组慢(t=-3.648,P<0.05),见图2。根据4次所测肿瘤体积绘制肿瘤生长曲线,rl-RVG组及NDV组生长曲线较对照组平缓。见图3。
根据末次测量肿瘤体积及计算公式计算抑瘤率:rl-RVG的抑瘤率为54.5%,即rl-RVG组较对照组肿瘤生长抑制了54.5%;NDV的抑瘤率为37.5%,即NDV组较对照组肿瘤生长抑制了37.5%。
图2 3周时各组荷瘤裸鼠瘤体体积
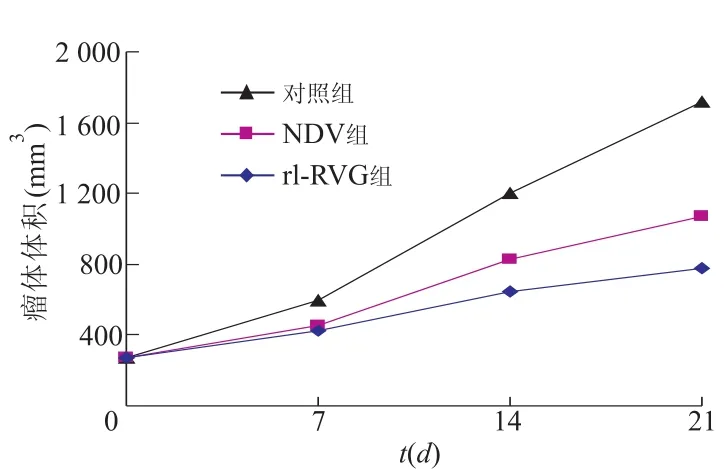
图3 瘤体生长曲线
2.3 免疫组织化学检测NDV及RVG的表达
结果显示,NDV蛋白在rl-RVG组及NDV组中呈阳性表达,而在对照组中无表达。RVG蛋白在rl-RVG组中细胞的细胞质中呈阳性表达,而在NDV组及对照组中几乎无表达。见图4。
图4 新城疫病毒(NDV)及狂犬病毒糖蛋白(RVG)的表达(免疫组化染色,×200)
2.4 rl-RVG转染后组织的病理改变
rl-RVG组及NDV组皮下瘤体中间剖开后呈囊样变,而对照组为实体瘤改变。HE染色结果显示,rl-RVG组及NDV组皮下瘤体较对照组坏死明显增多,细胞体积变小,结构消失,核浓缩,胞质较少或消失,肿瘤细胞大片死亡,且rl-RVG组死亡细胞较NDV组多;rl-RVG组及NDV组脾脏组织较对照组明显增大,镜下脾多核巨细胞增多;rl-RVG组及NDV组肺组织充血、炎症反应较对照组明显,淋巴细胞明显增多,部分出现肺水肿表现,且rl-RVG组较NDV组更明显。见图5。
2.5 rl-RVG转染后脾NK细胞数量变化
流式细胞术检测结果显示,rl-RVG组、NDV组和对照组NK(CD3-CD49b+)细胞数分别为(34.00± 4.47)%,(25.60±4.33)%,(14.60±3.85)%(F=26.489,P<0.01);其中,rl-RVG组和NDV组明显高于对照组(t分别为6.147,3.751,P均<0.05),且rl-RVG组明显高于NDV组(t=7.203,P<0.05)。见图6。
图5 rl-RVG转染后组织的病理改变(HE染色,×200)
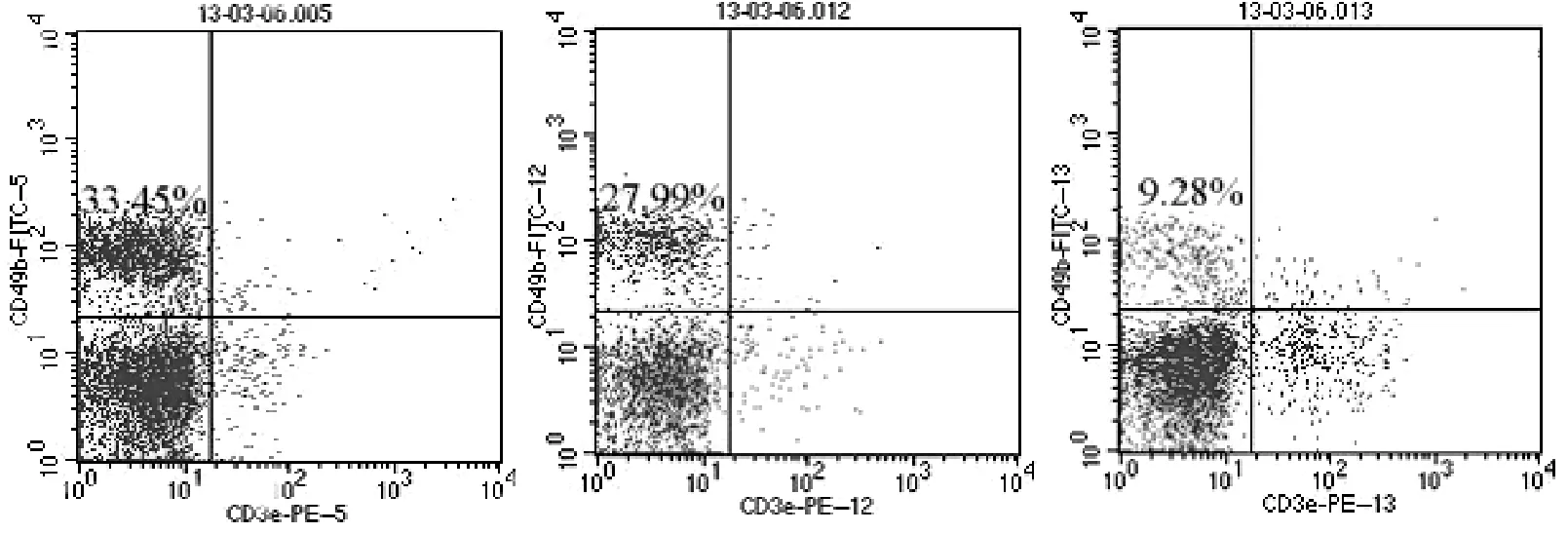
图6 rl-RVG转染后各组NK细胞数
3 讨论
溶瘤治疗的原理是通过对自然界存在的一些致病力较弱的病毒进行基因改造制成特殊的溶瘤病毒,利用靶细胞中抑癌基因的失活或缺陷从而选择性地感染肿瘤细胞,在其内大量复制并最终摧毁肿瘤细胞。
NDV是一个很有潜力的溶瘤病毒[1],为一种鸡瘟病毒,以感染禽类为主。NDV基因组全长15 186个核苷酸,有6个独立转录单元,分别编码核蛋白、磷蛋白、基质蛋白、融合蛋白、血凝集素神经氨酸酶蛋白(HN)和大聚合酶蛋白[9]。
NDV选择性地复制并杀死肿瘤细胞,同时保留正常的细胞,由此可以用于抗肿瘤的治疗[10-13]。NDV还可作为免疫疗法应用于神经母细胞瘤[14],黑色素瘤[15]及其他恶性肿瘤。目前对NDV杀伤的肿瘤机制仍不明确,主要认为有以下几个方面:NDV能够直接并且特异性地杀伤肿瘤细胞;NDV能够激发机体的细胞及体液免疫反应[16];NDV能够刺激各种细胞因子的释放以增强机体的免疫功能[17]。同时在病毒表面的糖蛋白HN与唾液酸相互作用,可以激活NK细胞,进而产生IL-2、IFN-γ及TNF-α等细胞因子,更进一步影响和激活其他免疫细胞的功能,对于肿瘤细胞更具有溶细胞作用[17]。
Ge等[18]成功构建rl-RVG,且rl-RVG转染后能稳定表达RVG,其表达可以增加NDV在细胞之间的扩散;RVG可以整合到NDV微粒的表面上,但不改变NDV在哺乳动物细胞之间的胰酶依赖的感染;RVG的表达不会明显影响NDV引起的机体细胞产生的免疫反应[18],RVG的表达不会增加NDV对禽类和老鼠的毒性[19]。RVG还可以调节受体的结合和渗透[20]。RVG的表达进一步地增加了rl-RVG对肿瘤细胞的杀伤作用,使得rl-RVG更有效地作用于肿瘤细胞。
本实验免疫组化结果显示,RVG蛋白在rl-RVG组瘤体组织中表达,NDV蛋白在rl-RVG组及NDV组瘤体组织中表达,说明rl-RVG及NDV成功转染至A549荷瘤鼠内。rl-RVG组及NDV组的肿瘤体积生长速度明显慢于对照组,且肿瘤体积明显小于对照组,说明rl-RVG及NDV对肺腺癌有着明显的抑制作用,且rl-RVG的作用较NDV更加显著。本实验结果显示,与对照组比较,rl-RVG组及NDV组脾脏明显增大,多核巨细胞和NK细胞明显增多,且rl-RVG组较NDV组增多更加明显,说明rl-RVG及NDV激活了机体的免疫反应,使得患瘤机体脾脏增生、增大,功能亢进,NK细胞明显增生,增加机体对肿瘤细胞的杀伤作用,rl-RVG的作用较NDV更加明显。
综上所述,本实验明确了重组新城疫病毒rl-RVG对A549荷瘤鼠能够成功转染,且对肺腺癌的荷瘤鼠的肿瘤生长有着明显的抑制作用,其机制可能与rl-RVG自身溶瘤作用及其导致的免疫系统的激活有着密切的关系。
[1] 张琪,杨呜琦,王根辈,等.新城疫病毒和康莱特注射液联合抗肿瘤试验中瘤组织的病理变化及IL-6表达的研究[J].中国兽医杂志,2010,46(10):33-34.
[2] 王亚君,宋纯,李晓辉,等.新城疫病毒抗人急性单核细胞白血病作用的实验研究[J].中国当代儿科杂志,2011,13(2):149-152.
[3] 宫金伶,黄川,宋德志,等.新城疫病毒7793株对人结肠癌细胞的杀伤作用[J].现代肿瘤医学,2011,19(3):414-417.
[4] Bukreyev A,Huang Z,Yang L,et al.Recombinant newcastle disease virus expressing a foreign viral antigen is attenuated and highly immunogenic in primates[J].J Virol,2005,79(21):13275-13284.
[5] DiNapoli JM,Kotelkin A,Yang L,et al.Newcastle disease virus,a host range-restricted virus,as a vaccine vector for intranasal immunization against emerging pathogens[J].Proc Natl Acad Sci U S A,2007,104(23):9788-9793.
[6] DiNapoli JM,Nayak B,Yang L,et al.Newcastle disease virus-vectored vaccines expressing the hemagglutinin or neuraminidase protein of H5N1 highly pathogenic avian influenza virus protect against virus challenge in monkeys[J].JVirol,2010,84(3):1489-1503.
[7] Inoue Ki,Shoji Y,Kurane I,etal.An improvedmethod for recovering rabies virus from cloned cDNA[J].J Virol Methods,2003,107(2):229-236.
[8] Pr haud C,Lay S,Dietzschold B,etal.Glycoprotein of nonpathogenic rabies virus is a key determinant of human cell apoptosis[J].JVirol,2003,77(19):10537-10547.
[9] McGinners LW,Morrison TG.Modulation of the activities of HN protein of Newcastle disease virus by nonconserved cystein residues[J].Virus Res,1994,34(3):305-316.
[10] Wheelock EF,Dingle JH.Observations on the repeated administration of viruses to a patient with acute leukaemia.A preliminary report[J].N Engl JMed,1964,271:645-651.
[11] Elankumaran S,Rockemann D,Samal SK.Newcastle disease virus exerts oncolysis by both intrinsic and extrinsic caspase-dependent pathways of cell death[J].J Virol,2006,80(15):7522-7534.
[12] Hrabák A,Csuka I,Bajor T,et al.The cytotoxic antitumor effect of MTH-68/H,a live attenuated Newcastle disease virus ismediated by the induction of nitric oxide synthesis in rat peritoneal macrophages in vitro[J].Cancer Lett,2006,231(2):279-289.
[13] Bian H,Fournier P,Peeters B,et al.Tumor-targeted gene transfer in vivo via recombinant Newcastle disease virusmodified by a bispecific fusion protein[J].Int J Oncol,2005,27(2):377-384.
[14] CasselWA,Murray DR.Treatment of stageⅡmalignant melanoma patientswith a Newcastle disease virus oncolysate[J].Nat Immun Cell Growth Regul,1988,7(5/6):351-352.
[15] Johnson N,Letshwenyo M,Baipoledi EK,etal.Molecular epidemiology of rabies on Botswana:a comparison between antibody typing and nucleotide sequence phylogeny[J].Vet Microbiol,2004,101(1):31-38.
[16] 李银聚,吴庭才.鸡新城疫病毒抗人肿瘤性疾病的分子机制[J].生物学通报,2009,44(6):13-14.
[17] Zeng J,Fournier P,Schirrmacher V.Induction of interferon-αand tumor necrosis factor-related apoptosis-inducing ligand in human blood mononuclear cells by hemagglutinin-neuraminidase but not F protein of Newcastle disease virus[J].Virology,2002,297(1):19-30.
[18] Ge J,Wang X,Tao L,et al.Newcastle disease virusvectored rabies vaccine is safe,highly immunogenic,and provides long-lasting protection in dogs and cats[J].JVirol,2011,85(16):8241-8252.
[19] Dietzschold B,Schnell M,Koprowski H.Pathogenesis of rabies[J].Curr Top Microbiol Immunol,2005,292:45-56.
[20] 白莲花,钱振超,于春,等.新城鸡瘟病毒激活的巨噬细胞抗肿瘤转移作用的研究[J].上海免疫学杂志,1994,14(6):334-336.
Tumor grow th influence of rl-RVG on lung adenocarcinoma A549 transfected in vivo
JIA Li-juan1,2,LIU Yang2,ZHANG Jin2,LIANG Bing1,ZHANG Jie1,YAN Yu-lan2
(1.School of Clinical Medicine,Jiangsu University,Zhenjiang Jiangsu 212001;2.Department of Respiratory Medicine,Affiliated People′s Hospital of Jiangsu University,Zhenjiang Jiangsu 212002,China)
Objective:To explore the effects of recombinant avirulent newcastle disease virus LaSota strain expressing the rabies virus glycoprotein(rl-RVG)on the proliferation of A549 lung adenocarcinoma tumor-bearingmice and potential immunemechanism.M ethods:A tumormodel of human A549 into nude mice was constructed and divided randomly into rl-RVG group,newcastle disease virus(NDV)group and control group.The mice in each group
rl-RVG,NDV and PBS injection,respectively,twice a week,for 3 weeks.The growth of tumor were recorded,and the expression of NDV and rabies virus glycoprotein(RVG)were assayed by immunohistochemistry.The pathological change of the tissues were observed by HE staining.The number of NK(CD3-CD49+)cellswere detected by flow cytometry.Results:Compared with the control group,the growth of tumor in rl-RVG group and NDV group were inhibitedmore effectively.The subcutaneous tumor necrosisweremore evident and there weremuch moremultinucleated giant cells in the spleen tissue of themice in rl-RVG group and NDV group.Immunohistochemical analysis showed that RVG protein was expressed in rl-RVG group and NDV protein was expressed in both rl-RVG group and NDV group.The number of NK cells was significantly higher in rl-RVG group and NDV group than that in the control group,and in rl-RVG group itwasmore higher than that in NDV group.Conclu-sion:Recombinant rl-RVG transfected successfully,and effectively inhibited the growth of A549 lung adenocarcinoma bymechanism which activating cell immune response.
rl-RVG;lung cancer;immune response
R734
A
1671-7783(2014)02-0105-05
10.13312/j.issn.1671-7783.y130261
镇江市社会发展基金资助项目(2013041)
贾丽娟(1987—),女,硕士研究生;严玉兰(通讯作者),主任医师,博士,硕士生导师,E-mail:ylyan2005@126.com
2013-11-25 [编辑] 刘星星

