极低出生体重儿支气管肺发育不良危险因素分析
赵玮婷,刘江勤,贲晓明
(同济大学附属第一妇婴保健院新生儿科,上海200126)
极低出生体重儿支气管肺发育不良危险因素分析
赵玮婷,刘江勤,贲晓明
(同济大学附属第一妇婴保健院新生儿科,上海200126)
目的:探讨小胎龄低体重儿支气管肺发育不良(bronchopulmonary dysplasia,BPD)的发生率、危险因素及相关防治措施。方法:141例极低出生体重儿中,BPD患儿43例,非BPD早产儿98例,采用SPSS 19.0统计软件包,从母亲因素、患儿出生情况、生后治疗等方面分析,探讨极低出生体重儿BPD发生的高危因素及防治措施。结果:极低出生体重儿BPD发生率为30.5%,胎龄<28周的超未成熟儿共8例,均发生BPD。BPD组胎龄及出生体重均较非BPD组低(P<0.01),BPD主要发生在胎龄<30周、出生体重<1.25 kg的早产儿。单因素分析发现,两组间胎龄、出生体重、母亲产前感染史、新生儿感染(包括肺部感染、败血症)、新生儿贫血、新生儿呼吸窘迫综合征、机械通气与否、机械通气时间、用氧时间、肺表面活性物质治疗均有统计学意义。Logistic多因素分析结果表明,胎龄<30周(OR 11.364,P<0.01)、出生体重<1.25 kg(OR 3.048,P<0.05)、机械通气(OR 11.890,P<0.01)是BPD发生的高危因素。结论:低出生体重、低胎龄及机械通气是BPD发生的危险因素,而母亲产前感染、新生儿感染、新生儿贫血、呼吸窘迫综合征、用氧时间也与BPD的发生有关,因此,避免早产及低出生体重儿、尽量缩短机械通气及用氧时间、防止及减少反复肺部感染,积极早期综合治疗是预防早产儿BPD的有效措施。
早产儿;支气管肺发育不良;危险因素
近年来,随着我国胎儿医学、产科技术及新生儿危重症救治水平的提高,越来越多的小胎龄、低体重儿得以存活,但各种影响预后的早产相关并发症的发生率也随之增加。其中,支气管肺发育不良(bronchopulmonary dysplasia,BPD)是最严重的并发症之一,已成为影响早产儿生存质量和预后的重要因素。我们回顾性分析了2011年1月至2013年4月同济大学附属第一妇婴保健院新生儿ICU诊治的141例极低出生体重儿(出生体质量小于1.5 kg)的临床资料,以探讨极低出生体重儿BPD发生的高危因素及防治措施。
1 对象与方法
1.1 研究对象
将2011年1月至2013年4月同济大学附属第一妇婴保健院NICU收治的出生体重<1.5 kg的早产儿纳入研究对象,并将28 d以内不能离开氧气但自动出院的患儿、先天畸形者排除。
诊断标准采用2001年美国多家国立卫生研究机构BPD研讨会上提出的诊断标准:任何氧依赖(>21%)超过28 d的新生儿为支气管肺发育不良病例[1]。
1.2 方法
检索相关临床病历,收集并整理患儿性别、胎龄、出生体重、胎膜早破、新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)发生情况、肺表面活性物质使用情况、呼吸机使用时间、用氧时间,并根据诊断标准将病例分为BPD组与非BPD组进行对比研究,分析极低出生体重儿BPD的危险因素及防治办法。
1.3 统计学处理
采用SPSS 19.0统计软件进行数据处理,组间计量资料的比较采用t检验,以±s表示,计数资料采用单因素卡方检验,独立高危因素分析采用Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 BPD发生率及一般临床资料
合计141例极低出生体重儿符合纳入标准,其中,单胎81例,双胎59例,三胎1例;男72例,女69例,男女性别之比为1.04∶1;胎龄(30.91±2.24)周,出生体重(1.28±0.17)kg。根据诊断标准,43例极低出生体重儿为BPD组,98例为非BPD组,BPD发生率为30.5%。
2.2 单因素分析
BPD组胎龄及出生体重分别为(29.07± 1.96)周、(1.15±0.18)kg,均低于非BPD组(P<0.01);胎龄<28周的,出生体重<1 kg的早产儿均发生BPD;两组间单/多胎的差异无统计学意义;BPD组母亲产前感染史高于非BPD组(P<0.05),新生儿感染(包括肺部感染、败血症)和贫血的发生率也明显高于非BPD组(P<0.01);BPD组母亲胎膜早破的发生率高于BPD组,但差异无统计学意义(P>0.05)。BPD组NRDS发生率及肺表面活性物质使用率均明显高于非BPD组(P<0.01)。见表1。

表1 各组早产儿临床特征的比较
2.3 机械通气及用氧资料对比
BPD组患儿使用机械通气的比例明显高于非BPD组(P<0.01),而且,呼吸机应用时间以及氧疗时间均较非BPD组长(P均<0.01),见表2。

表2 两组新生儿机械通气及用氧时间的比较
2.4 多因素Logistic回归分析
基于上述单因素分析得出的具有统计学意义的高危因素,进一步采用Logistic回归方法进行多因素分析。结果显示,胎龄<30周、出生体重、机械通气是极低出生体重儿BPD发生的危险因素。见表3。
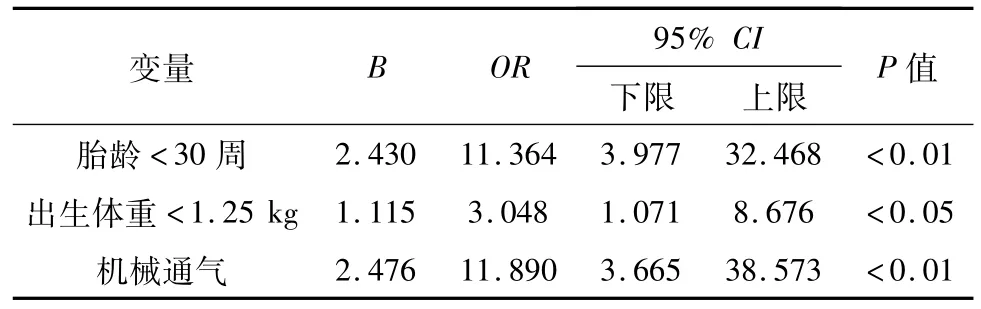
表3 独立性高危因素Logistic回归分析结果
3 讨论
BPD是新生儿期慢性肺疾病的最常见形式。“经典型BPD”于1967年被首次报道,主要特点是严重呼吸窘迫综合征的早产儿,在上呼吸机支持后出现撤机或离氧困难,持续用氧超过28 d,胸片有相关改变,病理以肺泡和气道结构严重破坏、肺组织严重纤维化为主要表现[2-3]。近年来,随着对氧疗、高压力通气造成肺损害的重视,治疗技术的改进,这种经典BPD发生率显著降低,但一种新型BPD却日益增多。新型BPD通常发生在出生体重<1.2 kg,胎龄<30周的极不成熟早产儿,该型早产儿出生时仅有轻度或无肺部疾病,不需氧或仅需低浓度氧,而住院期间逐渐出现氧依赖,停氧困难,持续用氧时间超过纠正胎龄36周[4]。新型BPD病理学改变通常为肺泡数目减少、结构简单化,肺部毛细血管数减少,提示肺发育在管道形成期受到干扰或停滞[5-6]。国外报道BPD在体重<1.5 kg早产儿发生率达54%,胎龄25周至32周的早产儿发生率为12%,本文的研究结果显示,<1.5 kg早产儿BPD发生率为30.5%,较国外报道略少。
本文研究发现,低胎龄及低出生体重是BPD发生的重要高危因素。早产儿肺发育不成熟,易在高氧、机械通气的气压伤和(或)容量伤、感染等各种不利因素的影响下发生肺部损伤和损伤后的异常修复,从而影响肺通气和(或)换气功能。BPD在胎龄<30周、出生体重<1.25 kg的早产儿发生率较高,国外相关研究显示超低(体重<1 kg)出生体重儿BPD的发生率高达50%[6]。目前,有学者提出BPD的发生除了与感染、氧疗和气压伤等因素相关外,还与出生后是否缺乏肺发育生长因子有关,但仍需进一步研究[7]。本研究中胎龄<28周,出生体重<1 kg的早产儿均发生BPD,通过Logistic回归分析得出胎龄<30周,出生体重<1.25 kg为高危因素。
Speer[8-9]研究提出,产前和产后感染在早产儿BPD发生发展中具有重要作用。存在产前感染时,炎症介质或细菌通过胎儿胃肠道、气道和脐带使胎儿感染,胎儿肺暴露在高浓度炎症介质中,炎症介质通过影响肺泡上皮细胞及内皮细胞的完整性,使正常肺泡和肺部血管发育停滞导致BPD发生[10]。Goldenberg等[11]研究显示,如感染B组链球菌、解脲支原体等可引起机体炎症反应,造成肺组织损伤及损伤后异常修复,其与小胎龄儿BPD发生发展紧密相关。机体促炎和抗炎系统失衡可影响肺泡和肺部血管的正常发育,很多研究均显示BPD患儿羊水、支气管肺泡灌洗液、血液中诸多炎性因子均较非BPD患儿增高[12]。本组资料也提示存在母亲产前感染及新生儿感染的BPD发生率明显增加,同样证实了感染在BPD发生发展中的作用。
本文研究发现,NRDS、机械通气、用氧时间与BPD发生发展之间存在关联。NRDS常见于小胎龄、低体重儿,这些早产儿肺发育不成熟,常需要呼吸机支持或用氧等治疗,而机械通气和氧疗可造成肺损伤,使本身不成熟的肺发育停滞,从而共同促进BPD的发生发展。胎龄<30周的早产儿,肺部发育处于囊泡期,上述各损伤因素导致肺泡结构的简单化和血管生成异常。王伟等[13]对动物模型的研究已证实,高氧使肺 毛细血管膜屏障受损,肺部渗出增加,肺泡数目减少、结构简单化和囊泡化;而炎症反应下调了肺组织的血管内皮生长因子及受体的表达,导致肺血管发育障碍[13]。临床上,作为NRDS的常规治疗,使用肺表面活性物质可改善患儿的通气,缩短早产儿机械通气时间。Bancalari等[14]研究显示,气道内使用肺表面活性物质可降低BPD的发生率,且越早使用效果越明显。2013年最新欧洲早产儿呼吸窘迫综合征管理共识指南推荐:诊断为RDS的早产儿应使用天然型肺表面活性物质;有如下情形,如极不成熟早产儿、母亲产前未用糖皮质激素或需气管插管复苏者,建议在产房即使用肺表面活性物质。本文数据提示肺表面活性物质使用未降低BPD发生率,可能与使用时间点较晚及部分呼吸窘迫早产儿生后立即应用气管插管机械通气治疗有关。综上所述,低胎龄、低出生体重、NRDS、感染、机械通气、用氧时间是BPD发生的高危因素,通过预防早产、积极防治产前产后感染、采取肺保护性通气策略、积极综合支持治疗可降低BPD的发生率。
[1] Jobe AH,Bancalari E.Bronchopulmonary dysplasia:NHLBWorkshop Summary[J].Am JRespir Crit Care Med,2001,163(7):1723-1729.
[2] Fanaroff A,Martin RJ.Neonatal-perinatal medicine[M].7 th ed.London:Mosby,2002:1057.
[3] Avery GB,Fletcher MA,MacDonald MG,et al.Neonatology pathophysiology&management of the newborn[M].5th ed.Philadelphia:Lippincott Williams&Wilkins,1999:509.
[4] Jobe AJ.The new BPD:an arrest of lung development[J].Pediatr Res,1999,46(6):641-643.
[5] 柳国胜.我国新生儿呼吸系统疾病诊治的现状与展望[J].中国新生儿科杂志,2009,24(1):5-7.
[6] Kimella JP,Greenoug IA,Abman SH,etal.Bronchopulmonary dysplasia[J].Lancet,2006,367(9520):142l-1431.
[7] Bose CL,Dammarnn CE,Laughon MM,et al.Bronchopulmonary dysplasia and inflammatory biomarkers in the premature neonate[J].Arch Dis Child Fetal Neonatal Ed,2008,93(6):F455-F461.
[8] Speer CP.Inflammation and bronchopulmonary dysplasia:a continuing story[J].Semin Fetal Neonatal Med,2006,11(5):354-362.
[9] Speer CP.Pulmonary inflammation and bronchopulmonary dysplasia[J].J Perinatol,2006,26(Suppl 1):57-62.
[10] Speer CP.Inflammation and bronchopulmonary dysplasia[J].Semin Neonatol,2003,8(1):29-38.
[11] Goldenberg RL,Andrews WW,Goepfert AR,et al.The Alabama Preterm Birth Study:umbilical cord blood Ureaplasma urealyticum and Mycoplasma hominis cultures in very preterm newborn infants[J].Am JObstet Gynecol,2008,198(1):43-45.
[12] Paananen R,Husa AK,Vuolteenaho R,et al.Blood cytokines during the perinatal period in very preterm infants:relationship of inflammatory response and bronchopulmonary dysplasia[J].JPediatr,2009,154(1):39-43.
[13] 王伟,韦伟,宁琴,等.宫内炎性预敏及生后高氧暴露对早产大鼠肺血管内皮生长因子及其受体表达的影响[J].中华儿科杂志,2007,45(7):533-538.
[14] Bancalari E,del Moral T.Bronchopulmonary dysplasia and surfactant[J].Biol Neonate,2001,80(1):7-12.
R722.19
B
1671-7783(2014)02-0160-03
10.13312/j.issn.1671-7783.y140041
2014-02-09 [编辑] 陈海林

