肺腺癌转移相关转录子-1和核因子-κB在食管鳞癌组织中的表达及其相关性
尹越,张曌玥,牟笑,吴诗,毛朝明,陈德玉
(1.江苏大学临床医学院,江苏镇江212001;2.江苏大学附属医院肿瘤研究院,江苏镇江212001)
肺腺癌转移相关转录子-1和核因子-κB在食管鳞癌组织中的表达及其相关性
尹越1,张曌玥1,牟笑1,吴诗1,毛朝明2,陈德玉2
(1.江苏大学临床医学院,江苏镇江212001;2.江苏大学附属医院肿瘤研究院,江苏镇江212001)
目的:研究肺腺癌转移相关转录子-1(metastasis-associated lung adenocarcinoma transcript1,MALAT-1)和核因子-κB(NF-κB)在食管鳞状细胞癌(鳞癌)组织中的表达及其相关性。方法:采用qRT-PCR技术检测60例食管鳞癌组织和癌旁组织中MALAT-1和NF-κB的mRNA水平的表达,免疫组化SP方法检测NF-κB的蛋白表达水平。统计分析MALAT-1及NF-κB与患者临床病理特征之间的关系以及两者的相关性。结果:MALAT-1和NF-κB mRNA在60例食管鳞癌组织中的表达均高于癌旁组织(Z=-3.600,P<0.001;Z=-2.856,P<0.05),且NF-κB蛋白在食管鳞癌组织中的阳性表达率显著高于癌旁组织(χ2=36.39,P<0.001)。MALAT-1、NF-κB的表达均与食管鳞癌的分化程度、淋巴结转移以及TNM分期密切相关(P<0.05)。MALAT-1与NF-κB之间存在正相关(r=0.795,P<0.001)。结论:长链非编码RNA MALAT-1可能在食管鳞癌的发生发展中发挥重要作用。
肺腺癌转移相关转录子-1;核因子-κB;食管鳞状细胞癌;临床病理特征
食管癌死亡率居于全球恶性肿瘤致死率第6位[1]。其发生与发展是多因素的复杂过程,在分子水平上涉及众多基因及蛋白质的改变,甚至部分RNA的变化。长链非编码RNA(lncRNA)是一类转录本长度超过200 bp的非编码RNA,本身并不参与编码蛋白质,而是在基因表观遗传学修饰、蛋白质的转录与翻译等多层面发挥调控作用[2]。最新研究发现肺腺癌转移相关转录子-1(metastasis-associated lung adenocarcinoma transcript 1,MALAT-1)作为lncRNA家族中的一员,在脑、骨髓、食管、胆囊、卵巢等组织的恶性肿瘤中均出现升高[3]。现有资料表明,lncRNA还参与多种肿瘤的转移、侵袭、凋亡等过程[4-5]。但是,对于MALAT-1在食管癌中的作用机制和生物学功能尚不清楚。本实验采用qRT-PCR技术检测60例食管鳞癌患者癌组织和癌旁组织中的MALAT-1和核因子-κB(NF-κB)的mRNA表达水平,采用免疫组化技术检测NF-κB的蛋白表达水平,并分析两者与患者临床病理特征之间的关系以及两者之间的相关性。
1 材料与方法
1.1 材料
收集江苏大学附属医院胸外科2012年1月至2013年11月60例食管鳞癌患者的新鲜手术标本,术后经病理证实为食管鳞癌。癌旁组织选取距离肿块边缘5 cm的正常组织。术前未行放化疗。组织取出后立即置入-80℃冰箱冻存。研究过程严格遵循江苏大学医学院医学伦理委员会关于人体试验的伦理学标准并均获得入选对象的知情同意。
1.2 MALAT-1和NF-κB的qRT-PCR
采用Trizol试剂提取标本的总RNA。按照反转录试剂盒的说明,使用10μL反应体系进行cDNA的合成。并使用25μL体系进行PCR反应。用2%的琼脂糖凝胶电泳检测PCR产物。所有引物序列如下,MALAT-1上游引物:5′-ACTACTTTTTGCCTCCCTCACA-3′,下游引物:5′-AACTTATCTGCGGTTTCCTCAA-3′,产物长度为174 bp。NF-κB上游引物:5′-GGAGCACAGATACCACCAAGA-3′,下游引物:5′-CGCTTCTTCACACACTGGATT-3′,产物长度为223 bp。GAPDH上游引物:5′-TCAACGGATTTGGTCGTATTG-3′,下游引物:5′-TGGGTGGAATCAT-ATTGGAAC-3′,产物长度为136 bp。
1.3 NF-κB的免疫组织化学染色
采用链霉菌抗生物素蛋白 过氧化物酶连结(SP)法。对60例食管鳞癌组织依次进行低聚甲醛固定、石蜡包埋、连续切片,常规脱蜡、水化,抗原修复,血清封闭;然后进行兔抗人NF-κB(p65/REAL)多克隆抗体4℃孵育过夜。采用即用型快捷免疫组化试剂盒中二抗,按照说明书操作,室温孵育30 min,DAB显色5~10 min,苏木精复染,常规脱水、透明、干燥、封片,光镜下观察。用PBS代替一抗作为阴性对照。
结果判定:NF-κB免疫组化染色阳性产物主要定位于细胞质内,呈棕黄色。根据阳性细胞所占百分比,无明显阳性反应细胞为阴性(-),阳性细胞百分率<25%为弱阳性(+),25%~75%为中等阳性(++),>75%为强阳性(+++)。
1.4 统计学处理
使用统计软件SPSS 20.0进行统计分析。对于非正态分布,经Wilcoxon检验和Mann-Whitney U检验分析。对于正态分布使用t检验。计数资料用率表示,组间比较采用χ2检验和Fisher确切概率法。MALAT-1与NF-κB的相对表达量(2-ΔΔCt)经log2正态性转换后采用Pearson′s相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 食管鳞癌组织和癌旁组织中MALAT-1和NF-κB的mRNA表达情况
MALAT-1和NF-κB扩增曲线良好,熔解曲线均为单峰,产物的特异性好(图1)。将食管鳞癌组织和癌旁组织的PCR结果进行统计分析,显示在食管鳞癌组织中MALAT-1和NF-κB的mRNA表达均高于癌旁组织(Z=-3.600,P<0.001;Z=-2.856,P<0.05)(图2)。
2.2 NF-κB蛋白的免疫组化结果
在60例食管鳞癌组织中,NF-κB蛋白表达阴性12例,弱阳性32例,中等阳性16例,强阳性0例。而在相应的癌旁组织中NF-κB的蛋白表达阴性45例,弱阳性11例,中等阳性4例,强阳性0例。NF-κB在食管鳞癌癌组织中的阳性表达率(48/60)显著高于癌旁组织(15/60)(χ2=36.39,P<0.001)。NF-κB免疫组化染色的阳性产物主要定位于细胞质,呈棕黄色(图3)。
2.3 MALAT-1和NF-κB的mRNA表达与食管鳞癌临床病理相关性分析
食管鳞癌组织和癌旁组织中MALAT-1和NF-κBmRNA水平的表达与患者的性别、年龄、肿瘤位置均无统计学意义(P>0.05),而与肿瘤的分化程度、淋巴结转移及TNM分期相关(P<0.05)。见表1。
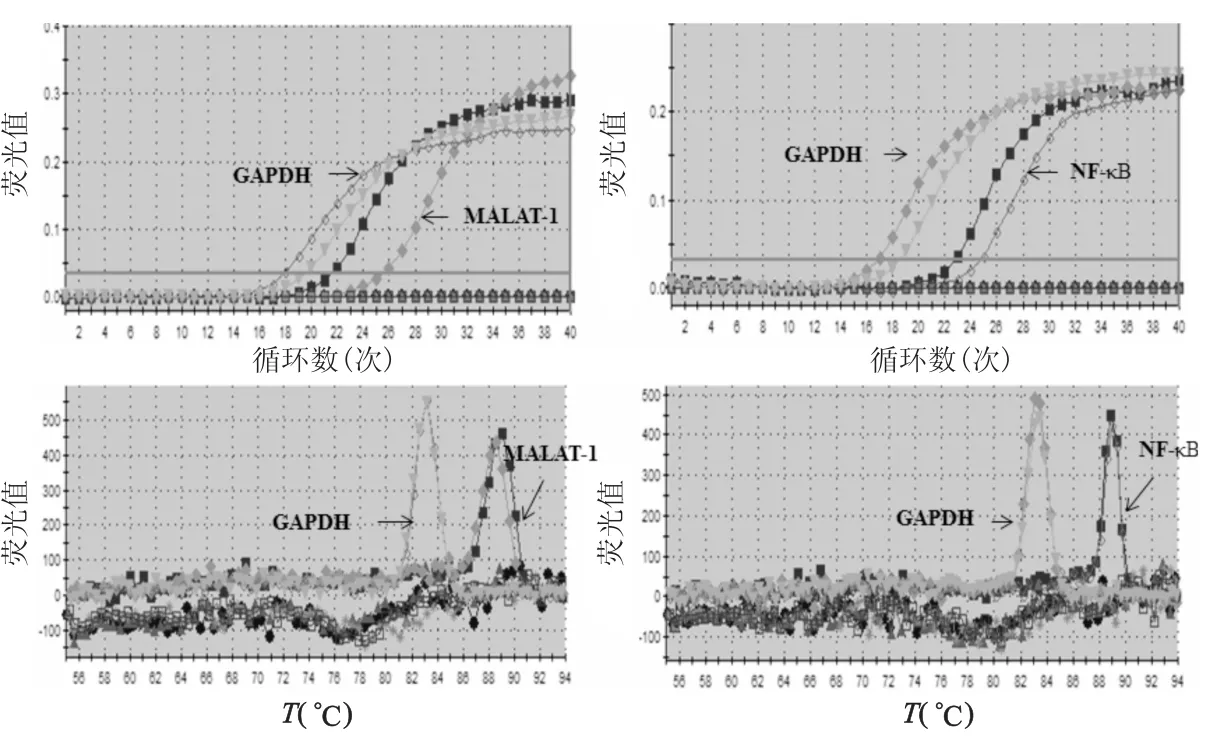
图1 实时荧光定量PCR曲线
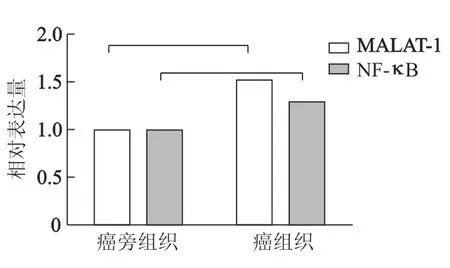
图2 MALAT-1和NF-κB在食管鳞癌组织和癌旁组织中的表达
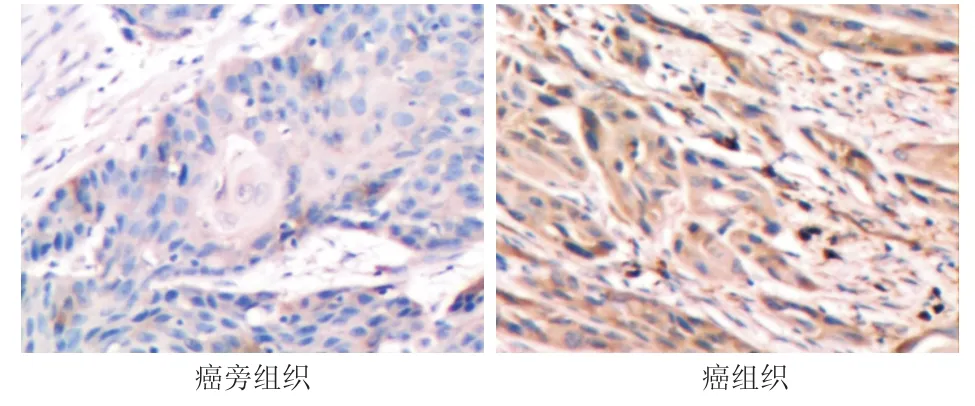
图3 NF-κB免疫组化染色结果(SP法×400)
2.4 NF-κB蛋白表达与食管鳞癌临床病理相关性分析
食管鳞癌组织中NF-κB蛋白水平的表达与患者的性别、年龄、肿瘤位置均无统计学意义(P>0.05),而与肿瘤的分化程度、淋巴结转移及TNM分期相关(P<0.05)。见表2。
2.5 NF-κB与MALAT-1表达的相关性分析
将MALAT-1与NF-κB mRNA的相对表达量通过log2正态性转换后,行Pearson′s相关性分析,发现MALAT-1与NF-κB在mRNA水平上存在正相关(r=0.795,P<0.001)。见图4。此外MALAT-1在鳞癌组织中的表达与NF-κB蛋白水平的表达相关,NF-κB蛋白阳性组(48例)MALAT-1的相对表达量为0.017,高于NF-κB蛋白阴性组(12例)的0.006的表达量(t=7.916,P<0.001)。
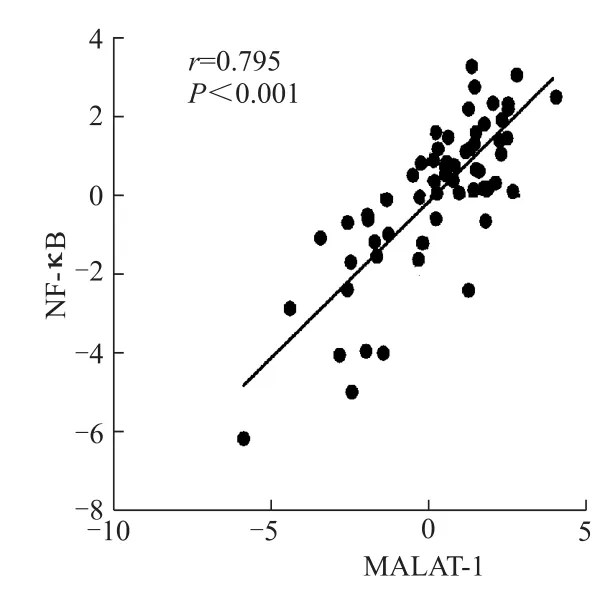
图4 MALAT-1和NF-κB m RNA表达的相关性
3 讨论
MALAT-1作为lncRNA家族中的一员,其基因位于染色体11q13,而该区域又与肿瘤的发生密切相关[6]。同时,MALAT-1是首个被发现的与肿瘤转移潜能相关的lncRNA[7]。近年研究显示,MALAT-1与许多恶性肿瘤密切相关,并且参与了肿瘤细胞的增殖、凋亡、转移和分化等多种生物学过程[5,8]。在小细胞肺癌中,MALAT-1与转移密切相关[9];在宫颈癌中,通过调控Caspase-3、Bax、Bcl-2等促进肿瘤的增殖[10];MALAT-1还通过调控抑癌基因p53的表达参与到肿瘤的形成[11];在前列腺癌中,MALAT-1通过参与细胞周期的调控来促进肿瘤细胞的增长、侵袭与扩散[12]。NF-κB作为一个重要的转录因子,参与了肿瘤发生发展过程中的多项调节,包括肿瘤的转移、扩散增殖及抑制凋亡等[13]。例如凋亡相关基因Caspase-3、Bcl-2,侵袭转移最直接最重要的基质金属蛋白酶9等均为NF-κB的下游靶基因[14-16]。现有研究证实NF-κB在食管癌的发生发展中起了重要的作用[17-18]。
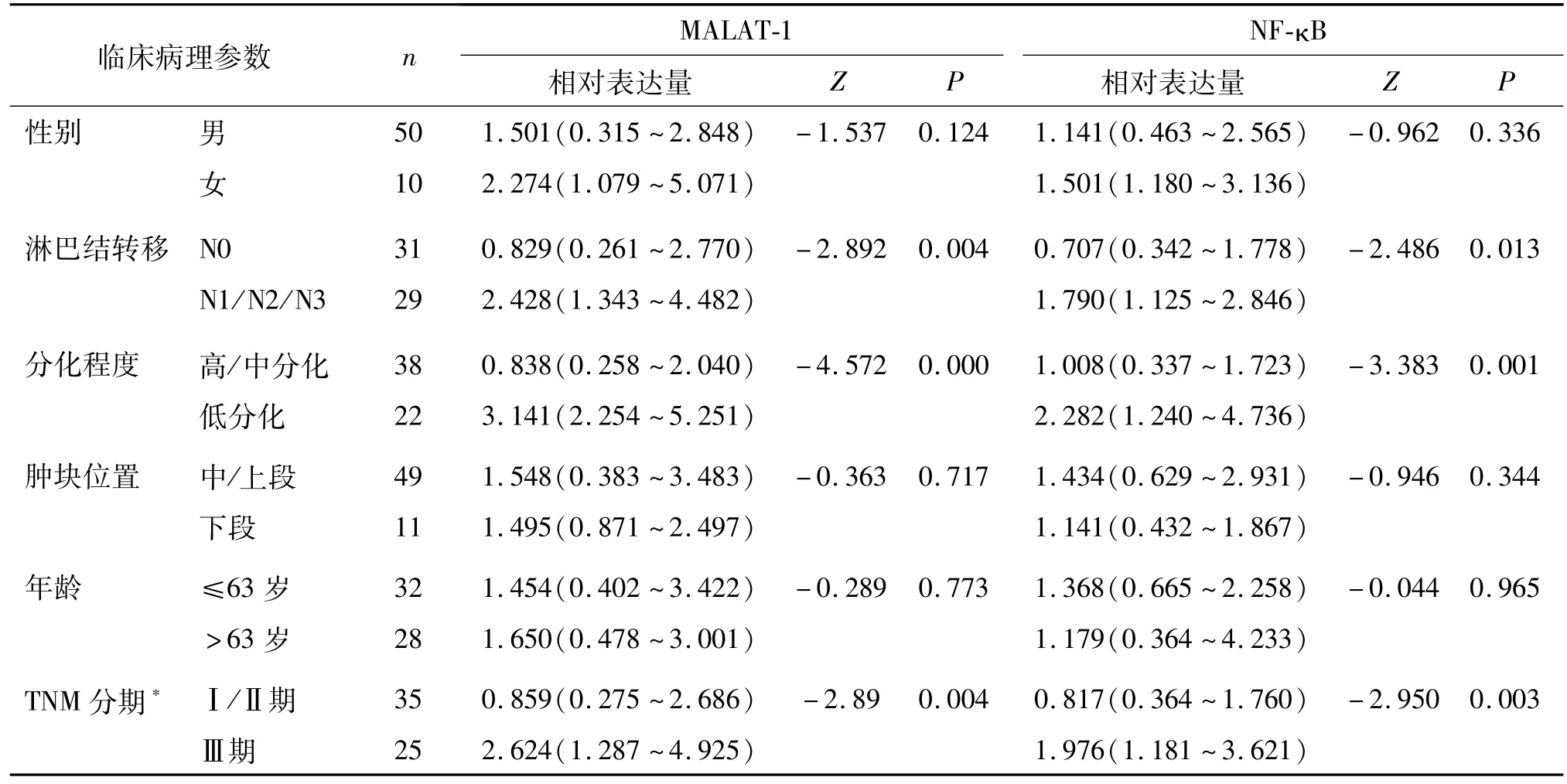
表1 MALAT-1和NF-κB的m RNA表达与食管鳞癌临床病理特征的关系
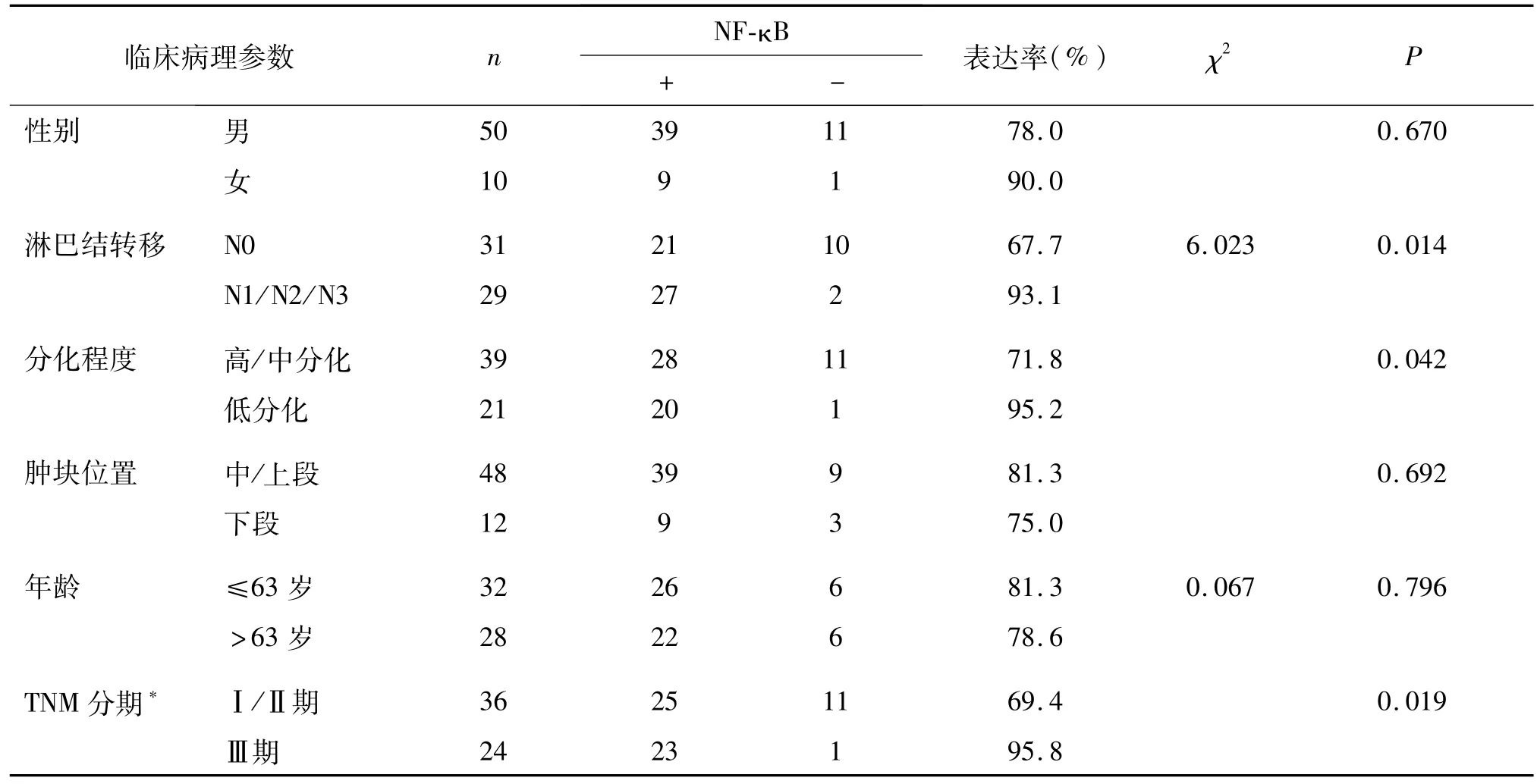
表2 NF-κB的蛋白表达与食管鳞癌临床病理特征的关系
本实验结果表明在食管鳞癌组织中MALAT-1的mRNA表达水平高于癌旁组织,且与食管鳞癌的分化程度、淋巴结转移、TNM分期相关。提示MALAT-1在食管鳞癌的发生发展中起作用。同时食管鳞癌组织中NF-κB的mRNA水平和蛋白水平的表达也均高于癌旁组织,而且NF-κB的mRNA水平和蛋白水平的表达也均与食管鳞癌的分化程度、淋巴结转移、TNM分期相关。Pearson′s相关性分析后发现,MALAT-1和NF-κB间存在正相关关系,且NF-κB蛋白阳性组的MALAT-1的表达量高于阴性组。表明在食管鳞癌中,高表达的MALAT-1可能与同样高表达的NF-κB相互作用,导致了食管鳞癌的发生。但是两者间的调控与被调控机制并不清楚,下一步将通过体外细胞培养和转染等实验来进一步研究。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2] Caley DP,Pink RC,Trujillano D,et al.Long noncoding RNAs,chromatin,and development[J].Scientific World Journal,2010,10:90-102.
[3] Gibb EA,Vucic EA,Enfield KS,et al.Human cancer long non-coding RNA transcriptomes[J].PLoS One,2011,6(10):e25915.
[4] Feng J,Tian L,Sun Y,et al.Expression of long noncoding ribonucleic acid metastasis-associated lung adenocarcinoma transcript-1 is correlated with progress and apoptosis of laryngeal squamous cell carcinoma[J].Head Neck Oncol,2012,4:46.
[5] Ying L,Chen Q,Wang Y,et al.Upregulated MALAT-1 contributes to bladder cancer cell migration by inducing epithelial-to-mesenchymal transition[J].Mol Biosyst,2012,8(9):2289-2294.
[6] BekriS,Adelaide J,Merscher S,etal.Detailedmap of a region commonly amplified at 11q13→q14 in human breast carcinoma[J].Cytogenet Cell Genet,1997,79(1/2):125-131.
[7] Ji P,Diederichs S,WangW,etal.MALAT-1,a novel noncoding RNA,and thymosinβ4 predict metastasis and survival in early-stage non-small cell lung cancer[J].Oncogene,2003,22(39):8031-8041.
[8] Tripathi V,Ellis JD,Shen Z,et al.The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing bymodulating SR splicing factor phosphorylation[J].Mol Cell,2010,39(6):925-938.
[9] Schmidt LH,Spieker T,Koschmieder S,et al.The long noncoding MALAT-1 RNA indicates a poor prognosis in non-small cell lung cancer and inducesmigration and tumor growth[J].J Thorac Oncol,2011,6(12):1984-1992.
[10] Guo F,Li Y,Liu Y,et al.Inhibition ofmetastasis-associated lung adenocarcinoma transcript 1 in CaSki human cervical cancer cells suppresses cell proliferation and invasion[J].Acta Biochim Biophys Sin(Shanghai),2010,42(3):224-229.
[11] Jeffers LK,Duan K,Ellies LG,et al.Correlation of transcription of MALAT-1,a novel noncoding RNA,with deregulated expression of tumor suppressor p53 in small DNA tumor virus models[J].J Cancer Ther,2013,4(3).
[12] Ren S,Liu Y,Xu W,et al.Long noncoding RNA MALAT-1 is a new potential therapeutic target for castration resistant prostate cancer[J].J Urol,2013,190(6):2278-2287.
[13] Karin M.Nuclear factor-κB in cancer development and progression[J].Nature,2006,441(7092):431-436.
[14] Lei K,Nimnual A,ZongWX,et al.The Bax subfamily of Bcl2-related proteins is essential for apoptotic signal transduction by c-Jun NH(2)-terminal kinase[J].Mol Cell Biol,2002,22(13):4929-4942.
[15] Ismail N,Pihie AH,Nallapan M.Xanthorrhizol induces apoptosis via the up-regulation of bax and p53 in HeLa cells[J].Anticancer Res,2005,25(3B):2221-2227.
[16] Lee KW,Kim MS,Kang NJ,et al.H-Ras selectively up-regulates MMP-9 and COX-2 through activation of ERK1/2 and NF-κB:an implication for invasive phenotype in rat liver epithelial cells[J].Int JCancer,2006,119(8):1767-1775.
[17] Lin C,Song L,Gong H,et al.Nkx2-8 downregulation promotes angiogenesis and activates NF-κB in esophageal cancer[J].Cancer Res,2013,73(12):3638-3648.
[18] Gong H,Song L,Lin C,et al.Downregulation ofmiR-138 sustains NF-κB activation and promotes lipid raft formation in esophageal squamous cell carcinoma[J].Clin Cancer Res,2013,19(5):1083-1093.
Expressions and correlations of lncRNA MALAT-1 and NF-κB in patients w ith esophageal squamous cell carcinoma
YIN Yue1,ZHANG Zhao-yue1,MOU Xiao1,WU Shi1,MAO Chao-ming2,CHEN De-yu2
(1.School of Clinical Medicine,Jiangsu University,Zhenjiang Jiangsu 212001;2.Institute of Oncology,the Affiliated Hospital of Jiangsu U-niversity,Zhenjiang Jiangsu 212001,China)
Objective:To evaluate the expression and correlations ofmetastasis-associated lung adenocarcinoma transcript 1(MALAT-1),and NF-κB in the esophageal squamous cell carcinoma(ESCC)tissue.M ethods:The expressions of MALAT-1 and NF-κB mRNA were detected by qRT-PCR in 60 ESCC tissues and adjacent non-tumorous tissues.The expression of NF-κB protein was detected by immunohistochemical staining(SPmethod),and the relationship between MALAT-1 and clinico-pathological feature of ESCC patientswas analyzed,and the correlation was explored.Results:The expression of MALAT-1 and NF-κB both were higher in ESCC tissues than that in adjacent non-tumorous tissues(Z=-3.600,P<0.001;Z=-2.856,P<0.05).The positive rate of NF-κB protein in ESCC tissues was significantly higher than that in adjacent non-tumor tissues(χ2=36.39,P<0.001).Meanwhile,the higher expression of MALAT-1 and NF-κB were correlated with the differentiation degree,lymphnode metastasis and clinical stage of ESCC(P<0.05).And the expression of MALAT-1 and NF-κB was positive correlated(r=0.795,P<0.001).Conclusion:MALAT-1 might play a significant role in the occurrence and development of ESCC.
metastasis-associated lung adenocarcinoma transcript1;NF-κB;esophageal squamous cell carcinoma;clinicopathological features
尹越(1988—),女,硕士研究生;陈德玉(通讯作者),教授,主任医师,E-mail:cdeyu@hotmail.com
R735.1
A
1671-7783(2014)02-0129-05
10.13312/j.issn.1671-7783.y130264
镇江市社会发展支撑计划项目(SH2011019,SH2012023)
2013-11-27 [编辑] 何承志

