纤维素-三(3,5-二甲苯基氨基甲酸酯)手性固定相拆分氨鲁米特对映体
林小建, 龚如金, 李 平, 于建国
(华东理工大学化工学院,化学工程联合国家重点实验室,上海200237)
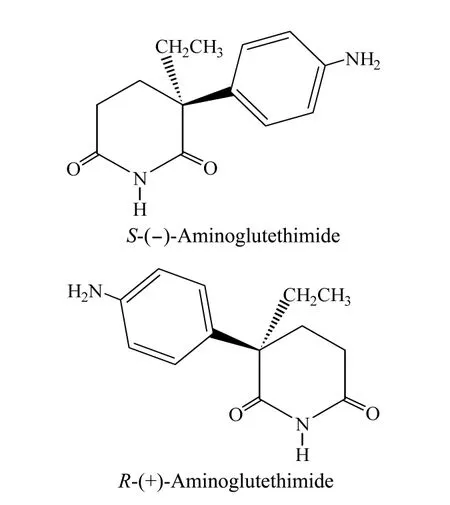
图1 氨鲁米特对映体的化学结构式Fig.1 Chemical structures of aminoglutethimide enantiomers
纤维素-三(3,5-二甲苯基氨基甲酸酯)手性固定相(Chiralcel OD-H)具有很高的对映体选择性,且负载量大,是目前应用较广泛的一种手性固定相[10-12]。本文采用该固定相在正相色谱条件下研究了氨鲁米特对映体的拆分。本文通过测定氨鲁米特在两种流动相体系中的溶解度,优选了对样品溶解度大的流动相体系,并考察了流动相添加剂乙醇胺(MEA)对对映体拆分的影响。在此基础上研究了流动相中醇含量、柱温以及进样量对分离因子、分离度、不对称因子和理论板数的影响。
1 实验部分
制备单一对映体的方法主要有手性合成和手性拆分两种方法[2,3]。手性合成是以手性物质为原料合成其他手性化合物或者在催化剂的作用下合成单一对映体化合物;手性拆分是指使用特定的拆分剂,利用物理、化学或生物方法将外消旋体拆分成两个单一对映体。手性色谱拆分法是应用最为广泛的一种手性拆分方法,其中液相色谱拆分法因具有高选择性、高稳定性、高效率等诸多优势,在手性拆分中占有重要地位,已有多篇采用手性固定相在高效液相色谱中拆分手性化合物的报道[4-6]。
手性固定相法在高效液相色谱中拆分氨鲁米特对映体国内未见报道,主要集中于国外的研究。Ali等[7]使用Chiralpak IA手性柱和Chiralpak IB手性柱,分别以甲基叔丁醚-四氢呋喃(THF)(90∶10,v/v)、100%二氯甲烷和100%乙腈为流动相拆分氨鲁米特,研究结果表明Chiralpak IA柱在3种流动相中均能拆分氨鲁米特对映体,而Chiralpak IB柱均不能实现拆分。Aboul-Enein等[8]以正己烷/乙醇(50∶50,v/v)为流动相,使用Chiralcel OD柱对氨鲁米特进行了拆分,分离因子为1.43。该作者[9]还
1.1 仪器与试剂
实验所用Dionex 3000高效液相色谱系统(ThermoFisher,美国)由 U3000二元梯度泵、U3000自动进样器、U3000RS柱温箱、U3000RS紫外检测器以及Chromeleon6.8色谱工作站组成。2300TH型超声仪(上海安谱科学仪器有限公司)。W5-100SP水浴锅(上海申生科技有限公司)。手性柱 Chiralcel OD-H(150 mm ×4.6 mm,5 μm)购自日本Daicel公司。
氨鲁米特外消旋体(纯度>99.0%)购自大连美仑生物技术有限公司;1,3,5-三叔丁基苯(TTBB,纯度>98.0%)购自梯希爱(上海)化成工业发展有限公司;正己烷、乙醇、异丙醇(色谱纯,国药集团化学试剂有限公司);乙醇胺(分析纯,上海凌峰化学试剂有限公司)。
1.2 色谱拆分条件
色谱柱为Chiralcel OD-H,流动相为30∶70∶0.1(v/v/v)的正己烷/乙醇/乙醇胺,流动相使用前超声脱气10 min。检测器波长为254 nm;柱温为25℃;流速为0.6 mL/min;进样体积为20 μL。
1.3 对映体色谱分离性能评价参数
文中用于评价分离性能的参数如下:异构体的保留因子k=(tR-t0)/t0,反映色谱柱对异构体的保留特性;分离因子α=k2/k1,柱选择性的量度;分离度Rs=2(t2-t1)/(w1+w2),判断异构体在色谱柱中的分离情况;理论板数N=5.54(tR/Wh/2)2,定量表示色谱柱的分离效率;不对称因子As=W0.05h/2a,描述色谱峰的不对称程度。以上各式中,tR为保留时间,其中t1为弱保留化合物的保留时间,t2为强保留化合物的保留时间;t0为色谱柱的死时间;w1和w2为两异构体的峰宽;Wh/2为半峰高处的峰宽;W0.05h为5%峰高处的峰宽;a为峰极大至5%峰高处的前半峰宽。
1.4 溶解度测定方法
本文采用重量法[13]测定氨鲁米特外消旋体在流动相中的溶解度。实验方法:首先用相同体积不同组成的流动相在玻璃瓶中溶解过量的氨鲁米特粉末,将玻璃瓶放至30℃的水浴中恒温12 h,得到饱和溶液。取500 μL饱和上清液至重量为mV的玻璃瓶中,称重并记为mVS。将装有上清液的玻璃瓶放至70℃的烘箱中进行溶剂挥发,直至玻璃瓶重量不再发生变化,此时玻璃瓶重量记为mVR。氨鲁米特外消旋体在溶剂中的饱和溶解度S(g/kg)可按下式计算:
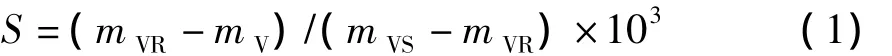
2 结果与讨论
2.1 氨鲁米特在流动相中的溶解度
本实验所使用的固定相为涂敷型手性固定相,根据该类手性固定相使用说明书,本文选择正己烷/乙醇、正己烷/异丙醇作为流动相,测定了氨鲁米特外消旋体在这两种流动相体系中的溶解度,结果见图2。可以看出,当醇含量为0即流动相为100%正己烷时,氨鲁米特溶解度为0,说明氨鲁米特不溶于正己烷。随着流动相中醇含量的增加,氨鲁米特的溶解度不断增大。比较30℃时两种流动相体系对样品的溶解度可发现,在醇含量相同的情况下,氨鲁米特在正己烷/乙醇中的溶解度高于氨鲁米特在正己烷/异丙醇中的溶解度,并且随着醇含量增加,两者差值加大;至醇含量达到100%时,氨鲁米特在乙醇中的溶解度(39.84 g/kg)是异丙醇(14.86 g/kg)的近3倍。在单一对映体制备过程中,样品在流动相中的溶解度是关键因素,它关系着制备分离的生产量。本文所选用的正己烷、乙醇、异丙醇对氨鲁米特的溶解度偏低,即使乙醇溶解度较好,在30℃条件下的最大溶解度值也仅为39.84 g/kg,因此在后续研究过程中,进一步优化溶剂种类以提高氨鲁米特的溶解度是非常重要的。
本文通过Eviews 6.0软件,采用普通最小二乘法基于截面数据进行多元线性回归分析.首先,对浙江省对外直接投资的出口效应进行检验,回归结果如下:
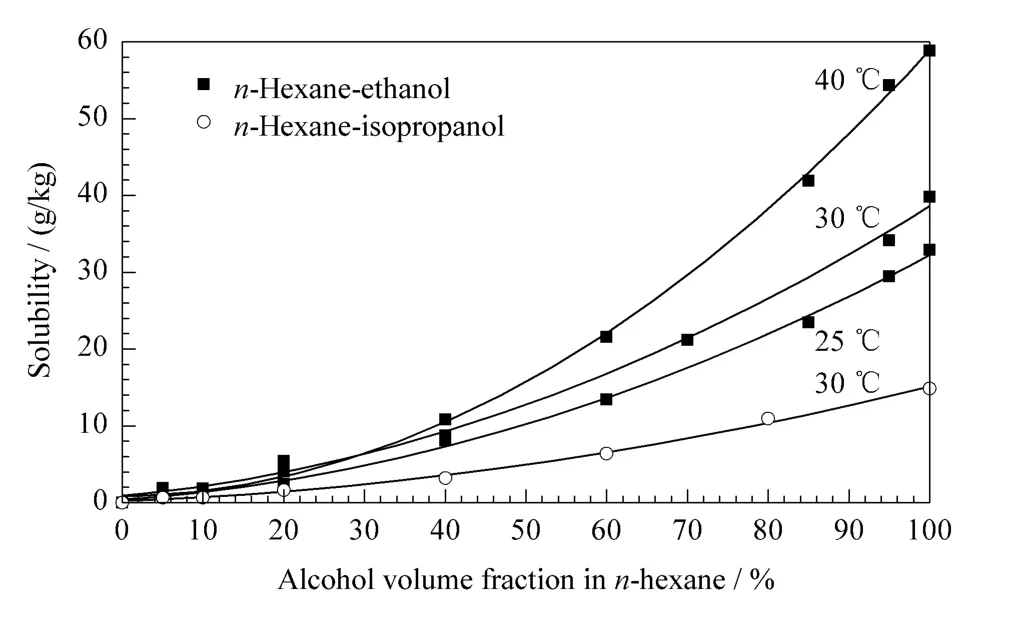
图2 氨鲁米特外消旋体在两种流动相体系中的溶解度Fig.2 Solubility of racemic aminoglutethimide in the two different solvents
此外,以正己烷/乙醇为流动相,还考察了温度对氨鲁米特溶解度的影响,结果如图2所示。可以看出,温度越高,氨鲁米特在正己烷/乙醇中的溶解度越大,这一现象随着乙醇含量的增加越发明显。可见选择高温操作和高醇含量流动相更有利于样品的溶解。然而,由于操作温度以及流动相中醇含量均影响对映体在固定相上的吸附和分离,因此,本文将综合考虑这些因素,选择合适的操作温度和流动相中的乙醇含量。
2.2 流动相添加剂对氨鲁米特拆分的影响
流动相添加剂一般用来调整溶质保留时间或改善色谱峰形,它的另一个重要作用是调节体系的pH值,从而建立稳定的溶质-固定相作用环境[14]。本文以正己烷/乙醇(30∶70,v/v)为流动相,乙醇胺为流动相添加剂,比较了不加乙醇胺和添加0.1%(体积分数)乙醇胺两种流动相组成下氨鲁米特对映体的拆分效果,色谱图见图3。色谱分离后的样品通过旋光仪(IBZ,德国)测定旋光度,结果证明 S-(-)-氨鲁米特先出峰,R-(+)-氨鲁米特后出峰,出峰顺序与文献[8]一致。从图3可看出,当流动相中不添加乙醇胺时,色谱峰形较差,主峰前面出现了一个较大的杂峰,推测这是由于固定相表面残余硅羟基对溶质的非立体选择性吸附引起的。当流动相中添加了0.1%乙醇胺时,主峰前的杂峰不再存在,主峰的峰形较不添加乙醇胺时更为“尖锐”,分离效果得到明显改善。此外,观察保留时间可发现,当流动相中加有0.1%的乙醇胺时,两异构体的保留时间均变小,这可能是由于添加剂与溶质在固定相的吸附位点上发生了竞争性吸附,从而影响了溶质的保留时间。
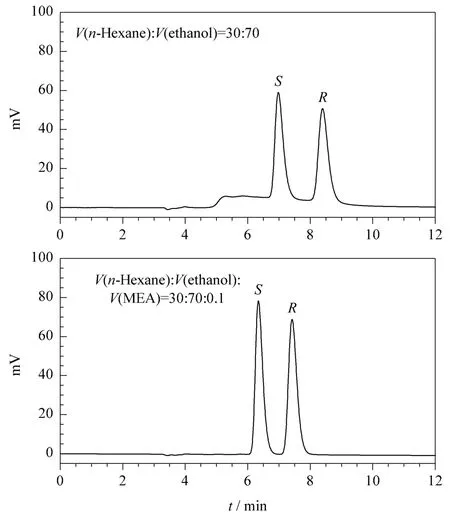
图3 流动相添加剂对氨鲁米特手性拆分的影响Fig.3 Effect of mobile phase additive on the enantioseparation of aminoglutethimide
2.3 流动相中醇含量对氨鲁米特拆分的影响
以正己烷/乙醇添加0.1%(体积分数)的乙醇胺为流动相,在25℃下研究了不同醇含量对氨鲁米特对映体拆分的影响,色谱柱的死时间t0由不保留物质TTBB测定,实验结果见表1。
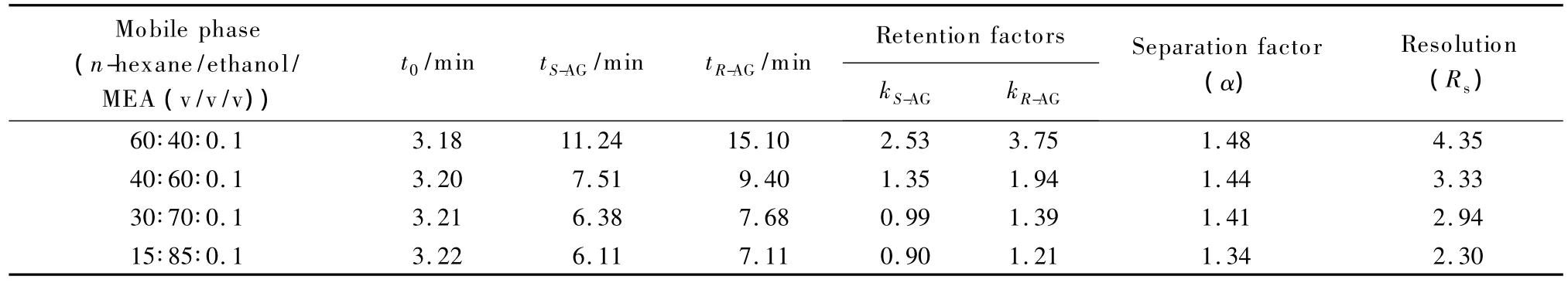
表1 流动相中乙醇含量对氨鲁米特对映体拆分的影响Table 1 Effect of the ethanol content in mobile phase on the enantioseparation of aminoglutethimide
由表1可知,随着流动相中乙醇含量的增加,即流动相的极性越来越大时,氨鲁米特对映体的保留时间、保留因子、选择性因子和分离度均越来越小。可能有3点原因:第一,随着流动相中乙醇含量的增加,流动相的极性变大,不利于氨鲁米特在固定相上的吸附,因此对映体更容易被洗脱下来,保留时间变的更短;第二,乙醇与固定相之间的氢键作用抑制了氨鲁米特对映体与固定相间的作用,流动相中乙醇含量的增大引起保留时间缩短,分离度也变小;第三,随着乙醇含量的增加,对映体与手性固定相上的识别可能也受到抑制,从而导致分离因子的下降。
从制备角度出发,在保证得到较好分离度的情况下,应采用对样品溶解度较大的流动相[15],即醇含量高的流动相。同时,必须考虑到乙醇黏度较大,乙醇含量太高会造成系统压力过高,特别是对多柱串联的模拟移动床色谱而言,过高的系统压力会对设备提出更高的要求。因此本文最终确定的流动相组成是正己烷/乙醇/乙醇胺体积比为30∶70∶0.1。
2.4 柱温对氨鲁米特拆分的影响
本文以Chiralcel OD-H手性柱为固定相,正己烷/乙醇/乙醇胺(30∶70∶0.1,v/v/v)为流动相,流速为0.6 mL/min,研究了25~40℃范围内温度对氨鲁米特拆分的影响,结果见表2。
从表2可知,随着温度的升高,保留时间、分离度明显下降,分离因子变化很小,说明温度对对映体选择性的影响很小。通常在低温条件下,对映体与手性固定相形成的配合物较高温条件时更加稳定,更不易被洗脱下来,有利于保留和提高分离因子,但也有文献报道了分离因子随柱温升高而升高或基本保持不变的,这主要跟固定相的种类有关[16,17]。理论板数随温度升高而增加,这是因为升温有利于扩散传质,从而提高色谱柱柱效。结合溶解度实验和柱温实验结果,温度升高虽有利于样品的溶解,但不利于对映体在固定相上的吸附和分离,而且工业生产中在较高温度下操作势必会增加能耗,增加生产成本。因此,本文选择25℃为合适的操作温度。
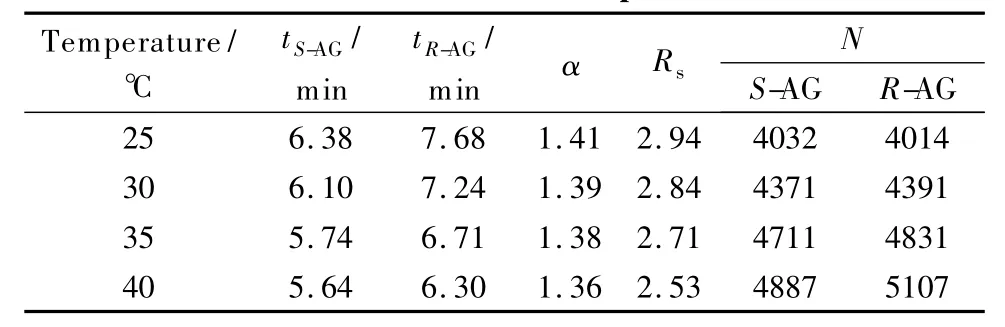
表2 柱温对氨鲁米特对映体拆分的影响Table 2 Effect of column temperature on the enantiomeric separation
综上所述,本文确定的最佳拆分条件是Chiralcel OD-H 为固定相,30∶70∶0.1(v/v/v)的正己烷/乙醇/乙醇胺为流动相,柱温25℃。在0.6 mL/min的流速下拆分氨鲁米特对映体,分离因子为1.43,分离度可达2.94,理论板数超过4 000。与前言报道的文献相比,Ali等[7]在Chiralpak IA柱中实现了氨鲁米特的拆分,选用的3组流动相的分离因子(3.52,2.32,1.88)较本文更高;Aboul-Enein 等[8]采用的分离体系的分离因子(1.43)虽与本文相近,但异构体保留时间长达为16.02 min和20.46 min,不利于分析和制备,且采用的流动相中醇含量为50%,样品在流动相中的溶解度偏低;文献[9]选用的分离体系对氨鲁米特对映体的分离度仅为0.68,不能实现氨鲁米特的拆分。因此,本研究采用的方法具有简便、快速、分离效果好等优点,同时从制备角度优选了流动相组成,为制备分离提供了参考数据。
2.5 进样量对氨鲁米特拆分的影响
本文在上述最佳色谱条件下,又研究了进样浓度对对映体拆分的影响。根据样品在流动相中的溶解度,本研究选用的氨鲁米特外消旋体质量浓度分别为 2.00、4.90和 10.30 g/L,进样体积均为 20 μL,得到的手性拆分色谱图如图4所示,相关色谱参数见表3。
从表3可看出,随着进样浓度的增大,两异构体的保留时间均减小,说明氨鲁米特对映体在固定相上的吸附行为可用非线性等温线来描述。分离度和理论板数随进样浓度增大均减小,这是由于随着浓度增大,对映体不仅与流动相和固定相表面分子相互作用,同时与另一对映体之间还发生相互作用,从而影响了分离度和分离效率。而分离因子并未随进样浓度增大发生改变,且数值均较大,说明选择性高,本文优选的分离体系适合用于拆分氨鲁米特对映体。对映体色谱峰的不对称因子随浓度增大而增大,说明体系在浓度越高的条件下非线性越强,此时,溶液中两对映体之间的相互作用不能忽略,有时甚至会成为影响氨鲁米特拆分的主要因素。
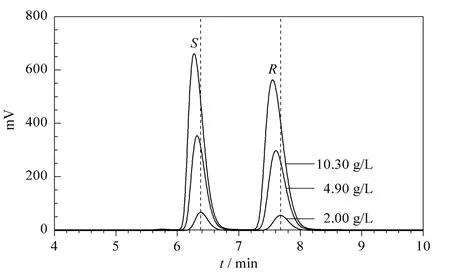
图4 不同进样浓度下氨鲁米特的手性分离色谱图Fig.4 Enantioseparation chromatograms of aminoglutethimide at different injection concentrations
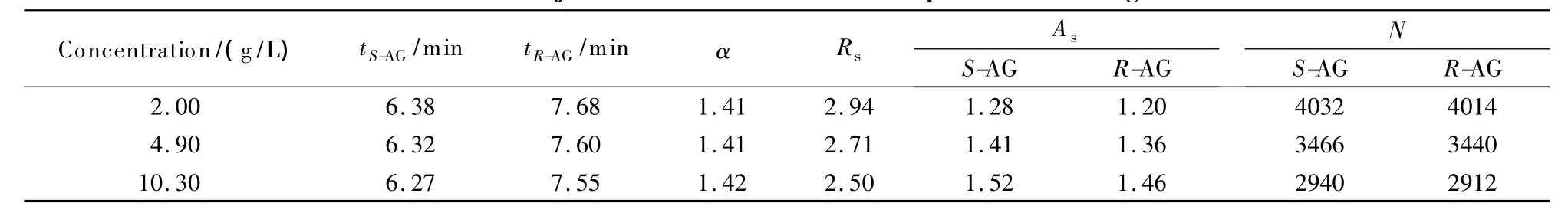
表3 进样浓度对氨鲁米特手性拆分的影响Table 3 Effect of injection concentration on enantioseparation of aminoglutethimide
对于制备分离,色谱柱的最大负载量是提高生产能力的重要参数,它与进样浓度和进样体积有关,由溶质在固定相上的吸附平衡决定。本工作在氨鲁米特溶解度允许范围内,选取高进样浓度,总进样质量浓度为10.42 g/L,在最佳拆分条件下研究了进样体积对对映体分离的影响,得到的色谱图如图5所示,相关色谱分离结果见表4。
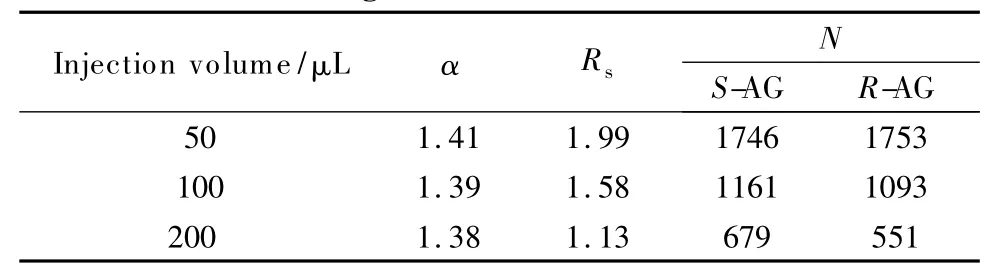
表4 进样体积对氨鲁米特色谱拆分的影响Table 4 Effect of injection volume on enantioseparationof aminoglutethimide
从表4可以看出,随着进样体积的不断增大,氨鲁米特对映体的分离度不断减小,对映体色谱峰发生展宽(见图5)。而进样体积对分离因子的影响较小,分离因子基本不变,说明进样量对选择性影响很小。当进样体积为100 μL时,分离度为1.58,满足基线分离的要求。加大进样体积至200 μL,分离度下降至1.13,继续增大进样体积将不能实现对映体的分离。
3 结语
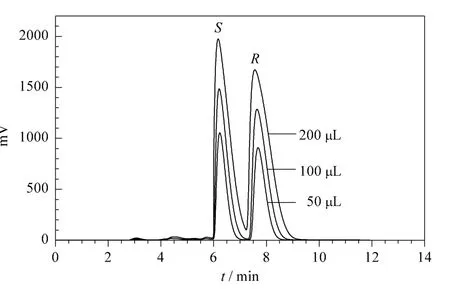
图5 不同进样体积下氨鲁米特的手性分离色谱图Fig.5 Enantioseparation chromatograms of aminoglutethimide at different injection volumes
以纤维素-三(3,5-二甲苯基氨基甲酸酯)为固定相,正己烷/乙醇/乙醇胺为流动相,在高效液相色谱中实现了氨鲁米特对映体的拆分,拆分效果良好。通过实验确定的最佳拆分条件如下:流动相为正己烷/乙醇/乙醇胺(体积比为 30∶70∶0.1),柱温为 25℃,流速为0.6 mL/min,分离度可达2.94,理论板数超过4 000。研究发现,在高浓度进样条件下,氨鲁米特在固定相上的吸附行为呈非线性,这在制备分离中可能成为影响氨鲁米特拆分的主要因素。因此,进一步测定高浓度的非线性吸附平衡具有重要意义。本研究所得结果可为工业化放大提供基础数据。
[1] Elbashir A A,Suliman F E O,Saad B,et al.Talanta,2009,77(4):1388
[2] Lu D Q,Li Y L,Ling X Q,et al.Lishizhen Medicine and Materia Medica Research(卢定强,李衍亮,凌岫泉,等.时珍国医国药),2009,20(7):1731
[3] Huang B,Yang L R,Wu J P.Chemical Industry and Engineering Progress(黄蓓,杨立荣,吴坚平.化工进展),2002,21(6):375
[4] Wang M.Chinese Journal of Chromatography(王敏.色谱),2014,32(2):198
[5] Wang L P,Fan H J,Wu K H,et al.Chinese Journal of Chromatography(王李平,范华均,巫坤宏,等.色谱),2012,30(12):1265
[6] Lee E,Park M B,Kim J M,et al.Korean J Chem Eng,2010,27(1):231
[7] Ali I,Naim L,Ghanem A,et al.Talanta,2006,69(4):1013
[8] Aboul-Enein H Y,Serignese V.Chirality,1994,6(5):378
[9] Aboul-Enein H Y,Serignese V.Chirality,1998,10(4):358
[10] Gong R,Li P,Yu J G.J Chromatogr A,2013,1286:119
[11] Mao S,Zhang Y,Rohani S,et al.J Sep Sci,2012,35(17):2273
[12] Du X,Wang Q,He X.Chemical Reagents(杜曦,王钦,何晓.化学试剂),2011,33(7):652
[13] Ribeiro A E,Graca N S,Pais L S,et al.Sep Pur Technol,2008,61(3):375
[14] Arnell R,Forssén P,Fornstedt T,et al.J Chromatogr A,2009,1216(16):3480
[15] Patil N S,Mendhe R B,Sankar A A,et al.J Chromatogr A,2008,1177(2):234
[16] Kusters E,Spondlin C.J Chromatogr A,1996,737(2):333
[17] Ellington J J,Evans J J,Prickett K B,et al.J Chromatogr A,2001,928(2):145

