纳米TiO2的制备及其表征*
桑俊, 陈芮
(云南师范大学 化学化工学院,云南 昆明 650500)
纳米TiO2作为最早研究的无机纳米材料之一,除具有普通TiO2的物理化学性质以外,还具有很多纳米材料的特性,由于粒径小,比表面积和比表面能大,表面原子数多,因而具有小尺寸效应、表面效应、量子尺寸效应及宏观量子隧道效应等[1-4].这些效应引起其相转变温度、熔点及烧结温度降低,吸附能力、化学活性及催化活性增强,且光学性质和磁性发生变化.另外,纳米量级的尺寸还赋予TiO2一些特殊的性质,如对可见光的透明性[5]、紫外屏蔽特性[6]、光催化活性[7-8]、随角异色效应[9]、表面超双亲性[10-11]等.因此,纳米TiO2被广泛应用于许多领域,如作为紫外线屏蔽剂添加在纺织品、化妆品中;作为杀菌、除臭、自洁材料添加于涂料、油漆、玻璃、食品包装材料中;用作光催化材料及高能效电池原料等.
已报道的纳米TiO2的制备方法有物理法和化学法两大类.根据反应物的相态,化学法分为:气相法、液相法和固相法.气相法一次性投资较高.液相法分为溶胶法[12]、溶胶-凝胶法[13-14]及沉淀法[15].溶胶法和溶胶-凝胶法制得的纳米TiO2颗粒均匀、分散性好、纯度高、操作简单、反应易控制,但原料价格昂贵.固相法具有工艺简单,操作简便易行的特点,但得到的纳米TiO2粒径分布较宽.
本文以H2TiO3为主要原料,NH3·H2O为沉淀剂,采用直接沉淀法首先制备了无定形沉淀TiO(OH)2,沉淀经过滤、洗涤、干燥得到前驱体.灼烧前驱体得到颗粒大小在60 nm左右的四方晶系金红石结构的纳米TiO2.通过讨论前驱体的热分解行为,进一步分析了纳米TiO2的紫外吸收特性、晶型及形貌等.
1 实验部分
1.1 实验试剂与仪器设备
1.1.1 实验试剂
本实验所用H2TiO3、H2SO4、NH3·H2O、无水乙醇等试剂均为分析纯;所用水为去离子水.
1.1.2 仪器设备
ZRY-1P型热重分析仪(上海天平仪器厂);TU-1901型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);DX-2700型X-射线粉末衍射仪(丹东方圆仪器有限公司);JEM-2100型透射电子显微镜(日本电子株式会社).
1.2 实验方法
1.2.1 样品制备
称取H2TiO3,加入一定量的浓硫酸加热、搅拌使反应完全,生成TiOSO4.向反应体系中加入去离子水,继续搅拌30 min,使TiOSO4完全溶解,溶液呈均相体系.滴加氨水,调节溶液的pH为4~5,此时溶液呈白色浑浊状,即生成TiO(OH)2.用去离子水和无水乙醇洗涤3次后,在70 ℃下干燥沉淀2 h即可制得粉末状前驱体TiO(OH)2.在500~900 ℃下分别灼烧前驱体2.5 h,即可得到纳米TiO2粉末.样品制备过程中发生的反应如下:
H2TiO3+H2SO4=TiOSO4+2H2O
(1)
TiOSO4+2NH3·H2O
=TiO(OH)2+(NH4)2SO4
(2)
1.2.2 样品表征
用热重分析仪分析前驱体的热分解过程;用双光束紫外-可见分光光度计表征样品的紫外吸收特性;用X-射线粉末射衍射仪表征样品的晶型;用透射电子显微镜观察颗粒的形貌和大小.
2 结果与讨论
2.1 前驱体的热分解过程

图1 前驱体TiO(OH)2的热分解过程曲线图
前驱体TiO(OH)2的热分解行为如图1所示.当灼烧温度低于700 ℃时,随着温度升高,前驱体的热失重率增加;当灼烧温度达700 ℃,前驱体的热失重率趋于恒定,这表明此时前驱体已分解完全.经计算得:前驱体TiO(OH)2的理论失重率应为18.39%,而实际失重率达19.52%.理论失重率低于实际失重率的原因在于进行热重分析时,前驱体中残留有少量的水分(从图1可知,当前驱体的加热温度为48 ℃时,热失重率已达1.13%).前驱体的热分解行为如下:
2.2 样品的紫外吸收特性
图2为不同灼烧温度下制得的纳米TiO2的紫外吸收特性曲线.测试样品的浓度均为2.75×10-3mol/L.由图2可知:制得的纳米TiO2在紫外区有强的吸收,其最大吸收对应的波长约为340 nm,摩尔吸收系数随灼烧温度的变化而不同.结果表明:灼烧温度为800 ℃时,制得的纳米TiO2的紫外吸收最强,其最大摩尔吸收系数εmax=3.07×102L/(mol·cm).当灼烧温度大于800 ℃时,纳米TiO2的紫外吸收能力降低,并且吸收峰发生红移.
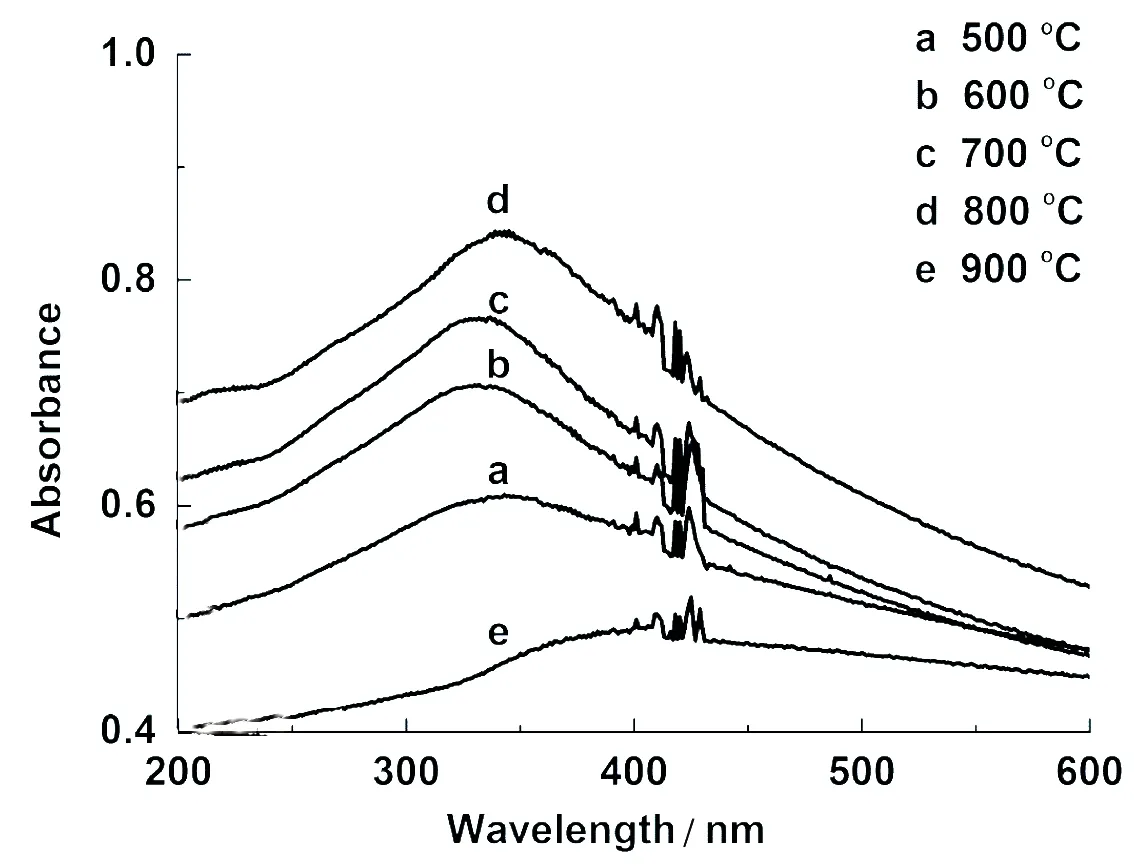
图2 不同温度下灼烧前驱体2.5 h得到的纳米TiO2的紫外吸收光谱
2.3 样品的晶型
在600~900 ℃下灼烧前驱体制得的样品的X-射线粉末衍射图如图3所示.从图中可以看到:随着灼烧温度的升高,所获得的纳米TiO2的晶型逐渐与标准谱图No.88-1172接近.当灼烧温度到达900 ℃时,样品的衍射角位置及衍射峰强度与标准谱图No.88-1172吻合.这表明:此时样品已经成型,为四方晶系金红石结构.
由Scherrer公式:d=0.89λ/βcosθ可计算样品的粒径(式中λ、β和θ分别表示X-射线的波长、衍射峰的半峰宽及布拉格衍射角).计算结果表明:在800 ℃灼烧前驱体所得样品的颗粒直径约为28.5~65.7 nm;当灼烧温度达900 ℃,所得TiO2颗粒粒径为50.4~68.7 nm.
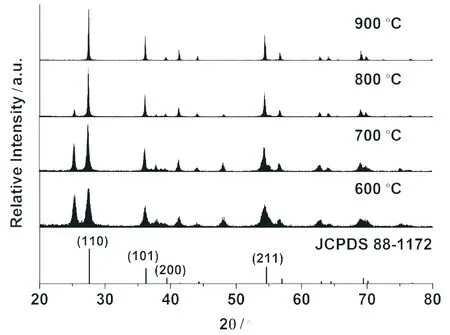
图3 在不同温度下灼烧前驱体2.5 h后得到的纳米TiO2的X-射线粉末衍射图
2.4 形貌分析
在不同温度下灼烧前驱体2.5 h所得的纳米TiO2的透射电镜扫描图见图4.图4a是在800 ℃灼烧前驱体TiO(OH)2得到的纳米TiO2TEM图像.从图中可以看到,样品的粒径约为40 nm左右,颗粒分布均匀,符合纳米粒子尺寸范围的要求.图4b是在900 ℃下灼烧前驱体制得的样品的TEM图像,平均粒径约为60 nm左右,同样符合纳米材料对粒径范围的界定.但是从图4b中可以清楚地看到,在该温度下制得的纳米颗粒粒径分布不均匀,且出现了团聚现象,这是由于灼烧温度过高,使物质的结晶过程受影响所致.在800 ℃灼烧所得TiO2颗粒大小比较均匀,呈不规则的球状和椭球状;当灼烧温度达900 ℃,由于发生高温团聚现象导致样品颗粒变大.图中观察结果与Scherrer公式计算结果相符.
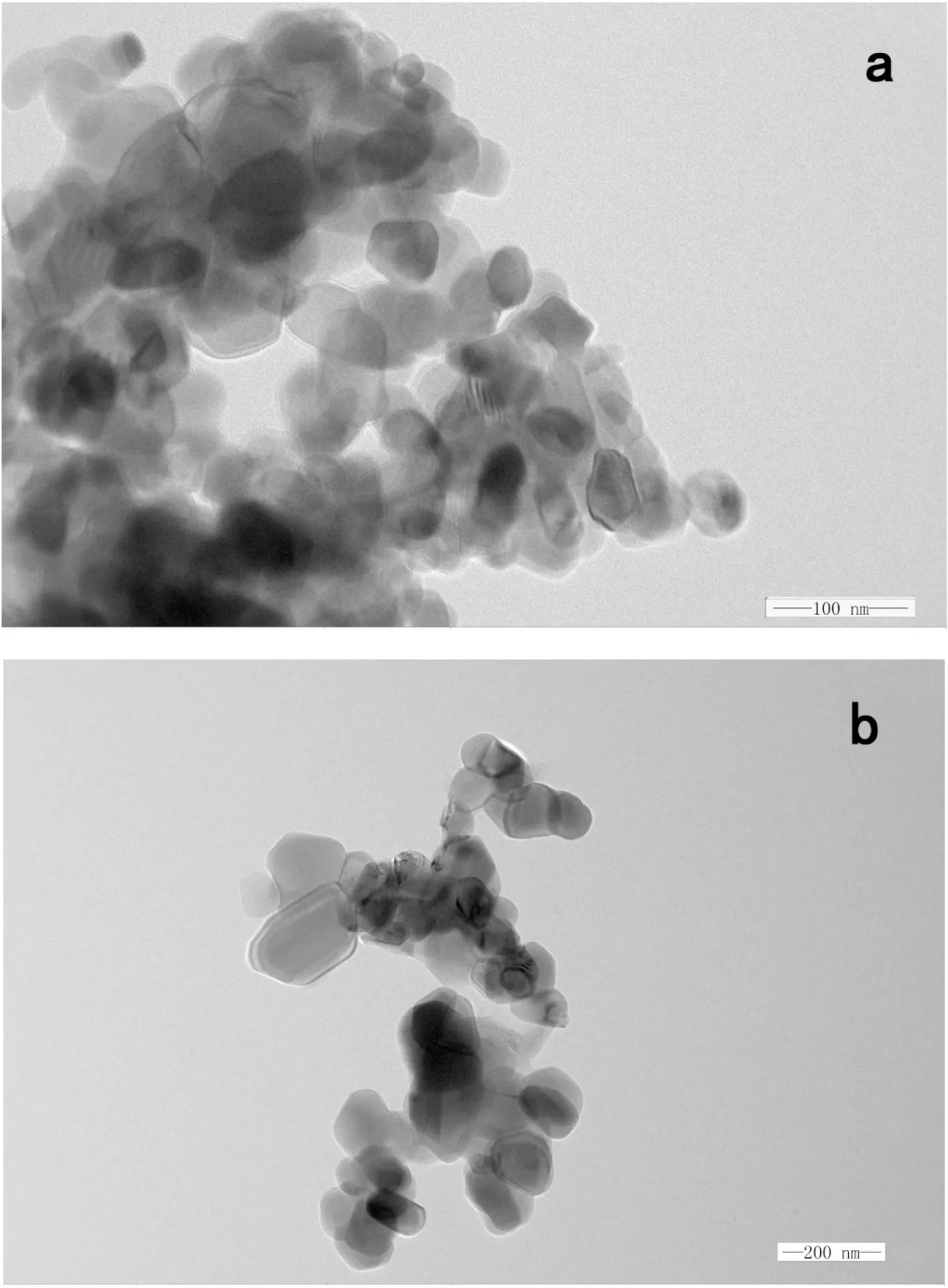
图4 在800 ℃(a)和900 ℃(b)灼烧前驱体得到纳米TiO2的透射电镜扫描图
3 结 论
采用液相直接沉淀法制备的纳米TiO2的晶型为四方晶系金红石结构.由于这种方法在制备过程中没有任何杂质被引入,可避免非均相反应的不均匀性,得到的纳米颗粒密度大、粒度均匀、纯度高.
前驱体TiO(OH)2的热失重结果表明:灼烧温度达到700 ℃,前驱体热失重趋于完全.采用该方法制得的纳米TiO2的晶型与其标准谱图JCPDS 88-1172一致,属金红石结构.研究纳米TiO2的紫外吸收特性得到:其最大吸收波长为340 nm,800 ℃下灼烧所得到的TiO2晶粒均匀,符合纳米材料要求.综上所述,将液相直接沉淀法制得的前驱体TiO(OH)2在800 ℃下灼烧2.5 h为制备纳米TiO2最佳的实验条件.
参 考 文 献:
[1] 张立德,牟秀美.纳米材料和纳米结构[M].北京:科学出版社,2001.
[2] 都有为.超微颗粒的物理特性[J].材料导报,1992 (5):1-5.
[3] 陈雨,孙肖燕,刘应开.二氧化锡纳米线的制备及表征[J].云南师范大学学报:自然科学版,2012,32(3):58-61.
[4] 包蕊,陈芮.纳米ZnO的制备及其紫外吸收特性[J].云南师范大学学报:自然科学版,2013,33(6):73-75.
[5] 李大成,周大利,刘恒,等.纳米TiO2的特性[J].四川有色金属,2002 (3):12-16.
[6] 李晓娥,樊安,王训,等.纳米TiO2紫外线屏蔽性能的研究[J].涂料工业,2000 (9):3-5.
[7] 李晓平,徐宝琨,刘国范,等.纳米TiO2光催化降解水中有机污染物的研究与发展[J].功能材料,1999,30(3):242-243.
[8] 张梅,杨绪杰,陆路德,等.纳米 TiO2——一种性能优良的光催化剂[J].化工新型材料,2000,28(4):11-13,34.
[9] 曾维勇,李秋珍.纳米TiO2的应用[J].矿冶工程,1996,20(2):52-53.
[10]曹珍元.纳米材料的化工应用与开发[J].化工新型材料,2000,28(11):3-5.
[11]于向阳,程继健,杜永娟.二氧化钛光催化材料[J].化学世界,2000 (11):567-570.
[12]王晓慧,王子忱,李熙,等.胶溶法合成TiO2超微粒子[J].材料科学进展,1992,6(6):533-537.
[13]CORRIU R J P,LECLERCQ D.Recent developments of molecular chemistry for sol-gel processes[J].Angewandte Chemie International Edition in English,1996,35(13-14):1420-1436.
[14]TERABE K,KATO K,MIYAZAKI H,et al.Microstructure and crystallization behaviour of TiO2 precursor prepared by the sol-gel method using metal alkoxide[J].Journal of materials science,1994,29(6):1617-1622.
[15]任莉,祖庸.均匀沉淀法制备纳米TiO2[C]//96中国材料研究会论文集.北京:化学工业出版社,1997.

