低温胁迫下黄花丁香的抗寒性研究
陈 荀,王春雷,彭宏梅,王 玲
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
低温胁迫下黄花丁香的抗寒性研究
陈 荀,王春雷,彭宏梅,王 玲
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
以嫁接到暴马丁香(Syringareticulatevar.mandshuricaHara)上的丁香属珍贵黄花品种黄花丁香(Syringapekinensis,Beijing Gold)为供试材料,暴马丁香作为对照,探讨了黄花丁香在东北高寒地区推广应用的可行性.对其一年生枝条进行人工处理,通过测定其相对电导率、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、可溶性蛋白含量等生理指标在0℃~-40℃低温胁迫下的生理响应,采用隶属函数分析方法,并结合黄花丁香自然越冬形态的观察,进行了抗寒性综合评价.结果表明:嫁接到暴马丁香上的黄花丁香植株在哈尔滨地区可自然越冬.黄花丁香开花时间比暴马丁香晚5 d左右,花期从6月末持续到7月下旬,长达20多天,比原产地嫁接在北京丁香上的黄花丁香花期晚一个月左右.随着低温胁迫的加深,黄花丁香和暴马丁香在生理响应和抗寒适应性上表现出相同的低温胁迫变化趋势,其中相对电导率、可溶性蛋白含量、POD活性和SOD活性总体都呈上升趋势;POD活性和可溶性蛋白变化在两者之间存在极显著差异,相对电导率变化存在显著差异,SOD活性变化差异不显著.黄花丁香和暴马丁香低温半致死温度(LT50)分别为-35.08℃,-39.11℃.结果为黄花丁香的推广应用奠定了基础.
黄花丁香;抗寒性;低温胁迫
黄花丁香(Syringapekinensis,Beijing Gold)是木犀科丁香属(SyringaL.) 黄花的新品种,是北京植物园育种专家通过北京丁香(Syringapekinensis)选育出的花期较晚、开花时间较长的观花小乔木,其植物体的气味芳香,是集绿化、美化、香化等多种功能于一体的不可多得的优选植物材料,在城市园林绿化中具有广阔的应用前景.目前对于黄花丁香的研究报道较少.我国东北地区,冬季漫长且寒冷干燥,黄花丁香耐寒性研究对于其在东北地区的引进、推广至关重要.
植物的抗寒性是指植物忍耐和抵抗低温的能力[1].相关研究表明,抗寒性与植物的细胞膜、酶保护系统、渗透调节物质等一系列生理生化活性密切相关[2-5].低温情况下,植物体内会发生一系列的生理生化反应以消除或者降低低温的伤害,所以通过对低温胁迫下植物生理生化反应关键生理指标的检测可以确定植物的抗寒性;而且生理指标检测与栽培实践相结合对植物耐寒性进行的评价更具说服力[6].本研究紧密结合高寒地区城市的生态环境状况和当前在新品种引进过程中存在的实际问题,以哈尔滨市为引种栽培基地对嫁接到暴马丁香上的黄花丁香进行了抗寒性研究;以乡土树种暴马丁香为对照,在越冬形态观察的基础上,结合人工低温胁迫处理生理指标测定,确定了黄花丁香在东北地区推广应用的可行性.研究结果对丰富黄花丁香的抗寒理论,指导黄花丁香的抗寒实践及推广均具有重要意义.
1 材料与方法
1.1 材料来源
本研究试验材料均采自哈尔滨市郊区园林苗圃基地,供试材料是嫁接到暴马丁香上的5~6 a的黄花丁香一年生枝条,对照材料为取自同一苗圃株龄相近的暴马丁香一年生枝条.
1.2 研究方法
1.2.1 黄花丁香的抗寒性等级评价
表1 植物抗寒性等级评价

等级抗寒性评价1无冻害或有部分一年生枝条出现冻害2一年生枝条受冻害程度<50%3一年生枝条受冻害程度>50%,部分老枝也受冻害4全部老枝受冻害,但能重新发芽5地上部分受冻害6地上部分死亡,地下部分能重新萌发7全部死亡
2010年11月至2011年11月对哈尔滨苗圃基地露地自然越冬的黄花丁香进行形态观察,记录其越冬表现.根据俄罗斯T·M·马拉赫维茨提出的抗寒性等级评定[7],将抗寒性分为7级(见表1),根据此评价标准对试验材料进行抗寒评价.
1.2.2 物候期观察
选择10株嫁接的黄花丁香作为实验对象并标记,观察记录的主要内容包括:越冬植株是否有冻害现象、发芽期、展叶期、现蕾期、花期、落叶期以及花叶的观赏特征等.
1.2.3 人工模拟低温条件下试材处理
在自然温度降到-20℃以下时取材.在苗圃实验基地按东、西、南、北、中选定5个取样点,然后在每个点上随机选取20株健康且长势基本一致的黄花丁香、暴马丁香植株,分别剪取适量无冻害的一年生枝条.带回实验室后,用自来水冲洗数遍,洗去杂物与灰尘,再用蒸馏水冲洗3~4次;自然晾干水分后,用石蜡液将枝条破口封好,再把试材用保鲜膜裹好贴上标签;以3℃/h 的速度逐渐降温至-25℃,-30℃,-35℃,-38℃和-40℃ 5个温度梯度,每个温度梯度处理时间为12 h,以0℃时的生理指标作为对照.将处理完毕的试材放在冰箱(4℃)内解冻12 h,之后进行各项生理生化指标的测定. 测定时每个处理进行3次重复.
1.3 测定方法
相对电导率、超氧物歧化酶(SOD)活性、过氧化物酶(POD)活性、可溶性蛋白含量的测定参照李合生的测定方法[8].相对电导率用电导仪测定;SOD 活性采用氮蓝四唑( NBT) 法测定;POD活性采用愈创木酚法测定;可溶性蛋白含量采用考马斯亮蓝G-250染色法测定.每个处理样品3个重复.
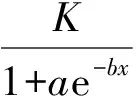
2 结果与分析
2.1 越冬形态特征观察
表2 黄花丁香和暴马丁香的抗寒性等级比较
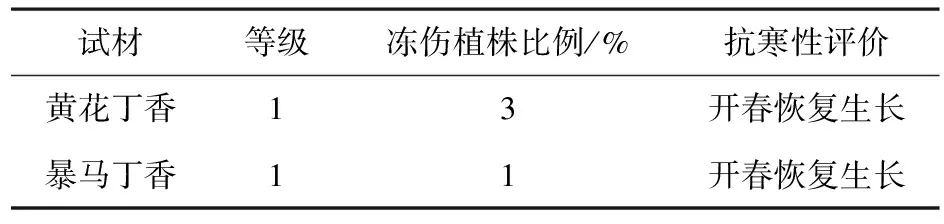
试材等级冻伤植株比例/%抗寒性评价黄花丁香13开春恢复生长暴马丁香11开春恢复生长
试验期间哈尔滨市的最低自然温度达到-27℃,通过观察植株自然越冬后的形态特征发现,黄花丁香和暴马丁香一年生枝条部分出现冻伤现象(见表2),主要表现为萎蔫干枯,受冻害的植株多在取样调查区域的外围迎风一侧;黄花丁香植株冻伤比例为3%,暴马丁香植株冻伤比例为1%,根据T·M·马拉赫维茨提出的抗寒性等级评定,两者都为1级.黄花丁香和暴马丁香植株萎蔫干枯部分均可在开春之后正常恢复生长,这表明黄花丁香与暴马丁香的越冬表现相近,具有较强抗寒性.
2.2 黄花丁香和暴马丁香物候期观察
表3 黄花丁香和暴马丁香的物候期对比

物候期黄花丁香暴马丁香发芽期4月下旬4月末展叶期5月上旬5月中旬现蕾期6月下旬6月下旬初花期6月末至7月初6月下旬至月末盛花期7月中旬7月上旬至中旬末花期7月下旬7月中旬至下旬落叶期10月下旬10月末
通过试验观察,在哈尔滨地区黄花丁香发芽期为4月下旬,展叶期为5月上旬,现蕾期为6月下旬,初花期为6月末至7月初,盛花期为 7月上旬至中旬,末花期为7月中旬至下旬(见表3).黄花丁香比暴马丁香发芽期、展叶期、落叶期早5 d左右,而现蕾期、初花期、盛花期、末花期却晚5 d左右.在原产地,黄花丁香是嫁接到北京丁香上的,其花期在5—6月,可能是因为哈尔滨的气候而影响了花芽分化的时间,使哈尔滨地区嫁接在暴马丁香上的黄花丁香花期推迟了一个月左右.
2.3 低温胁迫对黄花丁香相对电导率的影响及半致死温度的确定

图1 不同低温处理下相对电导率的变化
由图1可知,在人工低温胁迫过程中,前期的持续降温处理,导致黄花丁香和暴马丁香一年生枝条相对电导率直线上升.当温度降到-38℃时,暴马丁香相对电导率为48.48%,而黄花丁香的相对电导率为47.57%,与对照间差异极显著(P<0.01);当温度继续降低到-40℃,暴马丁香和黄花丁香的相对电导率均超过50%,达到最大值,分别为53.29%,51.28%,这表明低温对细胞膜的伤害加重,膜透性增大从而使相对电导率迅速升高.
方差分析结果(见表4)显示,不同低温处理条件下,黄花丁香和暴马丁香一年生枝条的相对电导率变化存在显著差异(F=4.473,P<0.05),温度对相对电导率有极显著影响(F=70.680,P<0.01).

表4 不同低温处理下相对电导率的方差分析
植物材料受到低温伤害后,质膜透性增大,失去对物质的控制能力,细胞内含物大量外渗,外渗液电导率增大,通过对外渗液电导率的测定,可间接反映植物材料受伤害的程度.应用电导法测定经过不同低温处理的植物组织,可以得到一条不同温度下植物组织电解质相对外渗率的变化曲线,该曲线普遍呈“S”形.整个过程中,降温对植物组织膜系统破坏程度最大的位置对应的是曲线的拐点处,拐点之前植物组织的膜透性变化是可逆的,拐点之后的膜透性变化不可逆,因此把曲线的拐点温度作为植物组织膜透性的临界点,用来确定植物组织的低温半致死温度LT50[9].
R2是方程拟合度的度量指标,其取值在(0,1)之间,数值越接近1,说明方程的拟合度越好.黄花丁香和暴马丁香拟合方程的R2分别为0.897 7,0.910 3,说明方程的拟合度较好.利用相对电导率模拟Logistic方程的结果见表5.由表5可以看出,对照(暴马丁香)的半致死温度为-39.11℃,黄花丁香的半致死温度为-35.08℃.暴马丁香可在-40℃以下的大兴安岭地区正常生长,而康富军等在长春地区暴马丁香的抗寒性研究中[10],测得暴马丁香的半致死温度为-29.56℃,与本研究结果相差近10℃,推测与试验材料生长环境或苗龄不同有关.本研究的试验材料生长于黑龙江省哈尔滨市,哈尔滨的年平均气温为3.6℃,吉林省年平均气温为4.8℃,常年的低温锻炼有助于提高植物的抗寒性,且植物抗寒性受多因素影响,生长年限、土壤质量、温度、光照等都能够影响暴马丁香的抗寒性;而黄花丁香半致死温度与暴马丁香接近.本研究的试材黄花丁香是由华北地区的北京丁香培育出的,之所以能够忍耐-30℃以下的低温严寒,可能与选择的乡土暴马丁香作砧木有关;此外,经过多年对当地气候环境的适应与低温锻炼,一定程度上也提高了黄花丁香的抗寒性.

表5 黄花丁香的半致死温度(LT50)
R为相关系数,Y为电解质渗出率的理论值,x为处理温度.
2.4 低温胁迫对黄花丁香超氧化物歧化酶(SOD)活性的影响

图2 不同低温处理下SOD活性的变化
由图2可知,在人工低温胁迫下,随着低温胁迫的加深黄花丁香和暴马丁香SOD活性呈先上升后下降的趋势.-25℃时,暴马丁香和黄花丁香SOD活性分别为34.43,39.44 U/g,与对照相比,暴马丁香呈极显著差异(P<0.01),而黄花丁香呈显著差异(P<0.05).两者的SOD活性在温度降到-38℃时达到峰值,分别为67.06,76.68 U/g,分别增加了167.59%和117.47%,与对照相比二者均呈极显著差异(P<0.01).然而在-40℃时,黄花丁香和暴马丁香SOD活性均出现了降低的趋势,但仍然维持在高于对照的水平上,说明低温处理可以在一定程度上提高植物的耐寒性.
方差分析结果(见表6)可知,不同低温处理条件下,黄花丁香和暴马丁香枝条超氧物歧化酶活性差异不显著(F=9.730,P<0.01),温度对黄花丁香和暴马丁香枝条超氧物歧化酶活性变化存在极显著影响(F=59.805,P<0.01).

表6 不同低温处理下SOD活性的方差分析
2.5 低温胁迫对黄花丁香过氧化物酶(POD)活性的影响

图3 不同低温处理下POD活性的变化
由图3可知,在人工低温胁迫条件下,随着温度的不断降低,黄花丁香的POD活性呈直线上升的趋势;而暴马丁香的变化趋势虽然没有黄花丁香的明显,但也是呈上升趋势.0℃时,黄花丁香和暴马丁香POD活性分别为36.33,31.67 U/(g·min);当温度达到-40℃时,二者POD的活性分别为172.167,67.056 U/(g·min),分别升高了373.9%和111.7%,与对照相比均呈极显著上升(P<0.01).
方差分析结果(见表7)可知,不同低温处理条件下,黄花丁香和暴马丁香一年生枝条的过氧化物酶活性存在极显著差异(F=48.672,P<0.01),温度对黄花丁香和暴马丁香一年生枝条过氧化物酶活性变化有极显著影响(F=14.360,P<0.01).

表7 不同低温处理下POD活性的方差分析
在低温胁迫下,植物的许多代谢过程都会产生超氧化物自由基,它不但会破坏细胞膜的脂双层结构,而且还能与膜蛋白以及酶发生作用,使其产生链式聚合作用,造成蛋白的破坏,从而使得细胞膜系统产生不可逆变性,导致植物的损害、死亡[14].从黄花丁香和暴马丁香在受到低温处理时枝条中POD酶活性的变化可以看出,植物通过提高POD酶活性来减少低温胁迫产生的超氧化物自由基的伤害,这与李小安等对扁蓿豆(Melilotusruthenicus)的研究结果基本相同[15].同时黄花丁香POD酶的变化趋势与暴马丁香的变化趋势基本相同,这也表明保护酶活性的增强有利于提高黄花丁香的抗寒性.
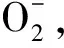
2.6 低温胁迫对黄花丁香可溶性蛋白含量的影响

图4 不同低温处理下可溶性蛋白含量的变化
由图4可知,随着人工低温胁迫的增强,黄花丁香和暴马丁香一年生枝条可溶性蛋白含量总体呈上升的趋势,这可能是由于温度的降低导致了植物为提高抗寒能力,枝条组织内复合蛋白分解、膜蛋白不断从膜上游离下来,引起蛋白质含量持续升高的结果.0℃~-25℃时,黄花丁香和暴马丁香可溶性蛋白含量上升幅度不明显,分别为2.607 8,2.088 5 μg/g,与对照相比二者呈不显著差异(P>0.05);-25℃~-30℃时,可溶性蛋白含量急速上升,说明此时反应比较强烈;-30℃~-38℃时,变化则相对平缓;峰值均出现在-40℃,分别为3.55,4.67 μg/g,均极显著高于对照(P<0.01).从可溶性蛋白含量的峰值变化幅度来看,黄花丁香大于暴马丁香,表明在低温胁迫条件下,黄花丁香的调节能力不如暴马丁香稳定.
方差分析结果(见表8)显示,不同低温处理条件下,黄花丁香和暴马丁香枝条可溶性蛋白含量存在极显著差异(F=100.906,P<0.01),温度对黄花丁香和暴马丁香枝条可溶性蛋白含量变化有极显著影响(F=36.658,P<0.01).

表8 不同低温处理下可溶性蛋白含量的方差分析
人工低温处理条件下,以0℃指标为对照,随着低温胁迫的加深,可溶性蛋白含量呈上升趋势.植物细胞可溶性蛋白具有保水、降低冰点的作用,是重要的渗透调节物质之一.大量的研究表明,在低温胁迫条件下,植物体内可溶性蛋白含量增加有助于提高其抗寒性.
2.7 人工低温条件下黄花丁香抗寒性综合分析
逆境下植物的抗性反应是一个复杂的生理、生化过程,各种反应之间相互影响、相互作用,单一指标很难准确地评价抗寒性的强弱[16].为综合评定黄花丁香抗寒性,本文采用隶属函数分析法对人工低温处理条件下的相对电导率、可溶性蛋白含量、SOD活性、POD活性这些生理指标进行综合评定.
隶属函数的分析结果(见表9)表明:在人工低温处理条件下,黄花丁香各项生理指标综合评分为0.492 5,暴马丁香综合评分为0.498 5,二者基本接近.因此,可以说黄花丁香的抗寒性与暴马丁香相接近.

表9 黄花丁香抗寒性的隶属函数综合分析
在人工低温处理条件下,对黄花丁香和暴马丁香的4个抗寒性生理指标进行相关性分析,结果见表10.由表10可见,温度与可溶性蛋白含量、SOD活性、POD活性、电导率呈极显著正相关,可溶性蛋白含量与POD活性、SOD活性、电导率也呈极显著正相关,说明黄花丁香一年生枝条在受到低温胁迫时蛋白与植物酶共同积累,以提高细胞在低温胁迫下的渗透调节能力,降低细胞的过氧化作用,增强植物在低温环境下的耐受性.电导率通常可作为表证抗寒性的单因素指标,温度的降低使膜系统遭到破坏,导致膜脂过氧化、电解质渗出率增加、相对电导率变大,而电导率与POD,SOD酶活性呈正相关,说明POD,SOD酶活性增强能有效地清除活性氧,对膜系统起到一定的保护作用.

表10 各项抗寒性指标的相关性分析
3 结论
在人工低温胁迫条件下,本文对暴马丁香和黄花丁香一年生枝条的相对电导率、SOD活性、POD活性以及可溶性蛋白含量等生理指标进行了测定,得出黄花丁香和暴马丁香的半致死温度分别为-35.08℃和-39.11℃;对生理指标隶属函数的分析得出,黄花丁香各项生理指标的综合评分为0.492 5,暴马丁香的综合评分为0.498 5.黄花丁香在低温胁迫过程中表现出相应的生理变化和调整,其各项生理指标变化趋势与结果均与暴马丁香相近,在一定程度说明黄花丁香的抗寒性与暴马丁香相近,这与室外越冬的观察结果一致.
通过对抗寒性相关指标的测定,得出温度与可溶性蛋白含量、SOD活性、POD活性、电导率呈极显著正相关;可溶性蛋白含量与POD活性、电导率也呈极显著正相关.因此,相对电导率、可溶性蛋白含量、POD活性、SOD活性可作为评定黄花丁香和暴马丁香抗寒性的主要生理指标.
试验期间哈尔滨地区自然低温达到-27℃,嫁接到暴马丁香上的黄花丁香自然越冬基本无冻害现象发生,抗寒等级评价为1级,在哈尔滨地区表现出较好的抗寒能力,可以在哈尔滨地区推广应用.黄花丁香在哈尔滨展叶期为5月中旬,花期为6月末至7月初,比原产地嫁接在北京丁香上的黄花丁香花期推迟了1个月左右;与暴马丁香相比,发芽期、展叶期、落叶期早5 d左右,而现蕾期、初花期、盛花期、末花期却晚5 d左右.哈尔滨市作为“丁香城”,黄花丁香的引进,不仅可提高城市绿化物种的多样性,优化园林植物结构,丰富绿化植物色彩,还可突出城市的区域特色,充分发挥城市园林绿地的生态和经济效益.
植物的抗寒性除了与遗传基因有关,还与生境有关.植物遇到低温胁迫后,其机体会发生一系列复杂的生理变化,不能凭借单一因素进行判断,需要通过多种生理生化指标的多重分析评价来决定.本研究通过自然越冬形态观察、生理指标测定,并结合人工模拟低温条件下生理指标的变化综合分析了黄花丁香的抗寒性,具有一定的实践指导意义.但植物的抗寒性会随着株龄、年低温、土壤、水分、养护管理质量、抗寒锻炼、病虫害情况等多因素的变化而变化,因此高寒地区引种栽培的成活情况不仅与温度有关,还要综合考虑各因素的影响.
[1] 潘瑞炽.植物生理学[M].北京:高等教育出版社,2004:282-293.
[2] PETER L S.Role of the plasma membrane in freezing injury and cold acclimation [J]. Annual Review of Plant Physiology,1984,35:543-584.
[3] ANDRZEJ B,SHAMSUL H. Effects of brassinosteroids on the plant responses to environmental stresses [J]. Plant Physiology and Biochemistry,2009,47(1):1-8.
[4] MANSOUR A M,ZAHRA K L,REZA H S. Quantitative and qualitative comparison of antioxidant activity in the flavedo tissue of three cultivars of citrus fruit under cold stress [J]. Australian Journal of Crop Science,2012,6(3):402-406.
[5] 何若韫.植物低温逆境生理[M].北京:中国农业出版社,1995:12-15.
[6] 张捷,杨淑梅,王玲,等.低温胁迫下2个竹柳品系的抗寒性[J].林业科学,2013,49(9):158-164.
[7] 马拉赫维茨T M.俄罗斯北部地区引种树木抗寒[J]. ДРЕВЕСНВIЕ РАСТЕНИЯ,1975(3):12-13.
[8] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[9] 朱根海,刘祖棋,朱培仁.应用Logistic方程确定植物组织低温半致死温度的研究[J].南京农业大学学报,1986(3):11-15.
[10] 康富军,李金鹏,陈帅,等.长白山五种特色树种的耐寒力测定[J].北方园艺,2012(1):99-101.
[11] 徐燕,薛立,屈明.植物抗寒性的生理生态学机制研究进展[J].林业科学,2007,43(4):88-92.
[12] 冯献宾,董倩,王洁,等.低温胁迫对黄连木抗寒生理指标的影响[J].中国农学通报,2011,27( 8):23-26.
[13] 方小平,李昌艳,胡光平.贵州4种木兰科植物幼苗的抗寒性研究[J].林业科学研究,2010,23(6):862-865.
[14] 李亚,谢晓金,宣继萍,等.中国结缕草植物抗寒性评价[J].草地学报,2003,11(3):240-245.
[15] 李小安,周青平.低温胁迫对扁蓿豆的脯氨酸含量和POD、SOD酶活性的影响[J].青海大学学报:自然科学版,2009,27(1):60-63.
[16] 黄月华.五种桉树苗期耐寒性能的初步研究[D].广州:华南农业大学,2003.
(责任编辑:方 林)
Research on cold resistance ofSyringapekinensis“Beijing Gold” under temperature stress
CHEN Xun,WANG Chun-lei,PENG Hong-mei,WANG Ling
(School of Landscape Architecture,Northeast Forestry University,Haerbin 150040,China)
Syringapekinensis“Beijing Gold” is a precious cultivar with yellow flower inSyringa. So this research studied the cold tolerance ofSyringapekinensis“Beijing Gold” in order to determine the feasibility ofSyringapekinensis“Beijing Gold” used in cold area in Heilongjiang Province. The annual branches ofSyringapekinensis“Beijing Gold”,as contrast ofSyringareticulatevar.mandshuricaHara,were used to measure their physiological response to low temperatures from 0℃ to -40℃ using four indices,such as relative electric conductivity,SOD activity,POD activity,and soluble protein,through an artificially-simulated cooling process. Based on correlation analysis among the indices and its wintering performance under natural conditions,to comprehensive evaluate its cold resistance. It was shown thatSyringapekinensis“Beijing Gold” grafed onSyringareticulatevar.mandshuricaHara can live through the winter naturally in Harbin.The blooming time ofSyringapekinensis“Beijing Gold” was later about five days thanSyringareticulatevar.mandshuricaHara,the flowering lasted from early July to late July,for more than 20 days. The blooming ofSyringapekinensis“Beijing Gold” grafed onSyringareticulatevar.mandshuricaHara in Harbin than those of grafed onSyringapekinensisplace of origin postponed for a month or so.With the deepening of low temperature stress,the relative electric conductivity,POD activity,SOD activity and soluble protein ofSyringapekinensis“Beijing Gold” andSyingareticulatevar.mandshuricaHara presented the upward tendency. There is highly significant difference between the change of POD activity and soluble protein. The change of relative electric conductivity was in very significant difference,and the change of SOD activity had not significant difference. The LT50ofSyringapekinensis“Beijing Gold” andSyringareticulatevar.mandshuricaHara were -35.08℃,-39.11℃. This study establishes the foundation for the application ofSyringapekinensis“Beijing Gold”.
Syringapekinensis“Beijing Gold”;cold resistance;artificial low temperature
1000-1832(2014)04-0122-08
10.11672/dbsdzk2014-04-023
2014-08-27
中央高校基本科研业务费专项资金资助项目(DL13EA07);国家林业局‘948’项目(2013-4-43);黑龙江省博士后启动金资助项目(LBH-Q12168);哈尔滨市科技创新人才专项资金留学回国人员项目(RC2013LX002002);国家林业局留学基金资助项目.
陈荀(1991—),女,硕士研究生;通讯作者:王玲(1972—),女,博士,教授,主要从事园林植物种质资源研究.
S 685.26 [学科代码] 210·4060
A

