7个柽柳ThMYB基因的鉴定及表达1)
张凤娇 王玉成 高彩球
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040))
7个柽柳ThMYB基因的鉴定及表达1)
张凤娇 王玉成 高彩球
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040))
通过对盐胁迫不同时间点柽柳根和叶组织的7个转录组数据进行分析,鉴定了7条MYB基因(命名为ThMYB1~ThMYB7),这些基因编码蛋白氨基酸残基数为206~918 aa,编码蛋白的相对分子质量为22.9~75.9,理论等电点为5.06~9.71。进一步分析了7个ThMYB基因在盐碱胁迫(0.3 mol·L-1NaHCO3)不同时间点柽柳不同组织中的表达谱,结果表明:尽管这7个ThMYB蛋白长度差异较大、同源性较低,但除ThMYB7外的其他7个ThMYB基因的表达均受盐碱胁迫调控,能对盐碱胁迫作出应答。
柽柳;盐胁迫;表达谱;MYB转录因子
MYB转录因子指含有MYB结构域的一类转录因子,是目前植物中最大的一类转录因子。 MYB结构域是由52个氨基酸残基采用螺旋-转角-螺旋的形式与DNA结合组成,一般都含有3个保守的色氨酸残基且相邻的两个色氨酸间一般相隔18或19个氨基酸,这些色氨酸起着疏水核心的作用[1]。MYB结构域的C端常是由富含酸性氨基酸的转录激活区组成并折叠成具有双亲性的螺旋状,因而具有一定的可塑性[2]。植物MYB蛋白中首先发现MYB结构域重复3次且不完全重复的R1R2R3结构,后又发现MYB结构域二次重复的R2R3结构,单一MYB结构域R1也存在于植物中[3]。玉米C1基因是第一个测序分离得到的MYB基因(C-MYB)[4],而拟南芥中的MYB基因是第一个被详细描述并分类的[5]。此外,烟草(NicotianatabacumL.)、马铃薯(Solanumtuberosum)、大豆(Glycinemax(L.) Merrill)、苹果(Malusxdomestica)、甘蔗(Saccharumofficinarum)和番茄(Solanumlycopersicum)等多种植物中都发现存在MYB转录因子[6-11]。
研究表明MYB转录因子在植物的生长发育过程中具有多种不同的生理调节功能,如调控细胞的生长发育、应答外界环境刺激、作为信号传导植物激素调节和参与植物次生代谢物的合成调节等[3]。如番茄中存在与拟南芥部分MYB基因相似的一类R3-MYB,其具有调节植物根毛发育功能[11];大豆中PsMYB1具有调节下游MAP激酶及影响大豆疫酶形成的功能[8];菊花CmMYB2基因在抗旱耐盐以及调节开花时间方面都起到一定的作用[12];马铃薯中MYB转录因子与植物响应干旱胁迫相关,其中过表达StMYB1R-1可以提高马铃薯的抗干旱水平[7];Rahaie[13]等人研究发现小麦TaMYB基因受盐和干旱胁迫影响,10个TaMYB转录因子在盐胁迫下均表现为上调表达;拟南芥AtMYB20基因可以通过抑制丝氨酸/苏氨酸蛋白磷酸酶的表达从而影响ABA信号途径以达到提高植物耐盐性的作用[14]。
目前关于MYB转录因子对非生物胁迫响应的研究主要集中在草本植物中,而木本植物中MYB转录因子调节抗旱耐盐功能的研究较少。柽柳是一种抗旱耐盐能力非常强的木本盐生植物,克隆柽柳MYB基因,并分析其耐盐碱能力具有重要意义。本研究中,笔者通过对已建立的盐碱胁迫不同时间点柽柳根和叶部组织的7个转录组文库序列进行比对分析,从而获得了7个全长ThMYB基因,通过生物信息学工具对这7个基因进行了序列分析,并进一步通过对文库基因表达查找获得了ThMYB基因在不同组织和盐碱胁迫不同时间的表达模式。为系统研究柽柳ThMYB基因的功能和通过基因工程手段将该基因用于林木抗性育种奠定了理论基础和提供基因序列材料。
1 材料与方法
1.1 试验材料的处理
刚毛柽柳种子播种于人工土(V(泥炭土)∶V(沙)=2∶1)中,置于相对湿度为65%~75%,光强为400 μmol·m-2·s-1,平均温度为(22±2)℃温室中生长。待生长2个月后,用0.3 mol·L-1NaHCO3溶液浇灌根部,进行胁迫处理,分别在处理0(胁迫处理前)、12 、24和48 h后,取其叶和根放入液氮中速冻用于RNA的提取。
1.2ThMYB基因的克隆与序列分析
CTAB法提取各处理时期的RNA,将提取的RNA样品送至深圳华大基因科技有限公司进行转录组文库的构建和测序[15]。对测序比对拼接后的结果用“MYB transcription factor”作为关键词进行查找,对查找后的序列进一步利用BLASTX软件进行比对确认,结合ORF founder ( http: / /www. ncbi. nlm. nih.gov/gorf. html)程序确定是否具有完整的开放读码框。选择具有完整ORF的MYB基因,进一步设计引物,以柽柳cDNA为模板,PCR测序后证实获得了7个ThMYB基因序列。用ProtParam (http://www.expasy.org/tools/ protparam. html) 软件计算推导的ThMYB蛋白质的相对分子质量及理论等电点。运用Pfam(蛋白家族数据库,http://pfam.sanger.ac.uk/)对7个ThMYB基因推导的蛋白序列进行验证是否含有MYB结构域。通过TAIR(http://www.arabidopsis.org/)查找出159个拟南芥MYB基因,利用ClustalX软件将这159个拟南芥MYB基因与ThMYB基因进行多序列比对,利用MEGA4.1软件绘制系统进化树。
1.3 盐胁迫柽柳ThMYB基因表达谱分析
通过对实验室以往测定的7个柽柳转录组测序结果的查找,获得每个ThMYB基因在7个转录组中的RPKM(Reads Per kb per Million reads)值,利用RPKM倍数计算分析这7个ThMYB基因在不同测序文中的表达差异倍数,从而获得基因表达谱[16],并运用Cluster 3.0软件,采用Average linkage聚类方法对基因表达数据进行聚类分析。
2 结果与分析
2.1 编码ThMYB蛋白基因的获得及序列分析
通过对柽柳7个转录组(NaHCO3胁迫0,12,24 h叶转录组和NaHCO3胁迫0,12,24,48 h根部转录组)基因序列的比对查找,共获得7个ThMYB单一基因。进一步的序列分析发现这7个ThMYB基因具有完整的开放读码框(ORFs),因此推测为全长基因,命名为ThMYB1~ThMYB7。这7个ThMYB基因的ORFs编码蛋白推测的氨基酸残基数为206~918 aa,预测的相对分子质量为22.9~75.9,理论等电点为5.06~9.71(表1)。Pfam分析结果表明,这7个ThMYB蛋白都至少具有一个典型的MYB结构域。利用ClustalX软件对这7个ThMYB蛋白的氨基酸序列进行多序列比对,结果表明,这7个MYB蛋白的同源性为9.09%~50%(表2),每个MYB蛋白都含有MYB家族特有的色氨酸且一般相隔18或19个氨基酸出现一个色氨酸(图1)。
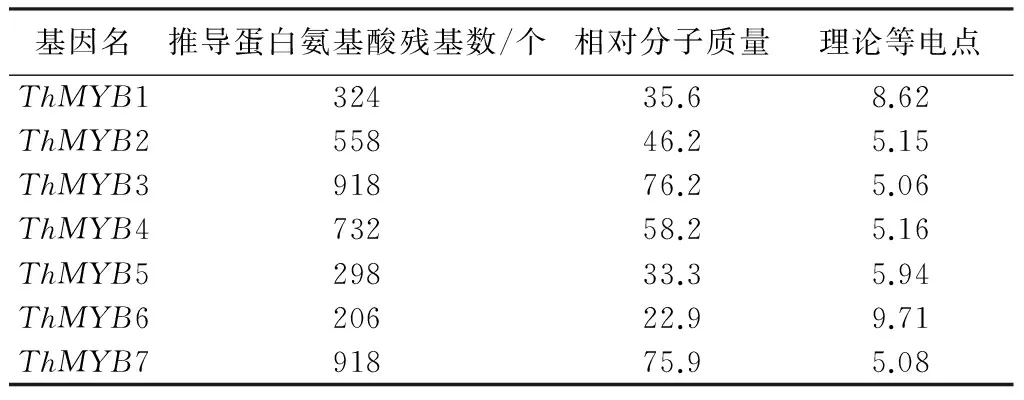
表1 刚毛柽柳7个ThMYB基因序列特征
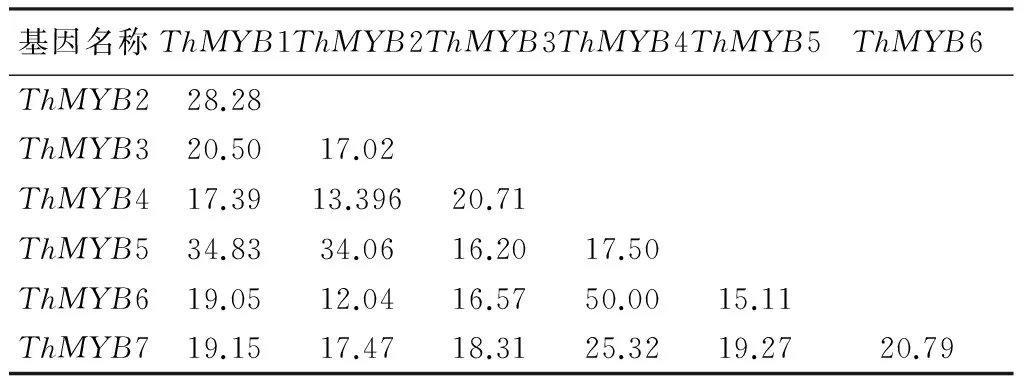
表2 7个ThMYBs基因间的序列一致性 %
Chen[17]等通过对拟南芥全基因组序列查找确定了4种主要类型MYB基因:包括R2R3-MYB基因;R1R2R3-MYB基因;4R-MYB基因;MYB-related基因,其中MYB-related基因又分为5个亚家族分别是CCA1-like,CPC-like,TBP-like,I-box-binding-like和R-R-type。通过BlastX比对分析发现7个柽柳ThMYB基因和拟南芥的MYB-related、R2R3-MYB的同源性较高,因此选择拟南芥MYB-related和R2R3-MYB两种类型MYB基因蛋白序列和7个柽柳ThMYB基因蛋白序列进行系统进化分析(图2)。结果表明,除了ThMYB4属于MYB-related类外,其他6个ThMYB均归为R2R3-MYB类。
2.2 柽柳ThMYB家族基因应答高盐胁迫的表达模式分析
为了进一步分析ThMYB基因在盐碱胁迫下的表达特征,对我们前期获得的柽柳NaHCO3胁迫不同时间点的柽柳转录组数据进行了分析,获得了7个ThMYB基因在NaHCO3胁迫后不同时间点的组织(根和叶)表达谱(表3,表4),并利用Cluster 3.0对基因表达数据进行聚类分析(图3)。结果表明,7个ThMYB基因表达具有不同的组织特性,其中ThMYB1-5主要是在根中表达,尤其是ThMYB1,非胁迫处理时,根中的表达量是叶中的9.5倍,NaHCO3胁迫24 h后, 根中的表达量为叶中的330.8倍。而ThMYB6和7在根中的表达量明显低于叶中的表达量。如ThMYB6在胁迫 24 h根中的表达量仅为叶中的3.1%。

图1 7个ThMYB基因多序列比对分析(下划线表示MYB结构域)

基因名称基因编号log2(根中基因表达量/叶中基因表达量)0h12h24hThMYB1Unigene144903.256.828.37ThMYB2Unigene362641.39-1.054.76ThMYB3Unigene483323.872.631.84ThMYB4Unigene459900.430.624.40ThMYB5Unigene463932.450.811.38ThMYB6Unigene48749-3.54-1.89-4.99ThMYB7Unigene45992-0.72-0.64-1.40
表4 NaHCO3胁迫不同时间点柽柳ThMYB家族基因相对表达水平

基因名称基因编号叶log2(A)log2(B)根log2(A)log2(B)log2(C)ThMYB1Unigene144901.831.145.396.252.63ThMYB2Unigene362641.30-2.16-1.131.22-0.51ThMYB3Unigene483321.102.14-0.130.11-1.46ThMYB4Unigene459900.81-3.110.990.860.14ThMYB5Unigene463930.85-3.13-0.79-4.20-0.10ThMYB6Unigene48749-1.231.410.41-0.05-0.96ThMYB7Unigene45992-0.020.110.05-0.58-0.06
注:A、B、C为处理12、24、48 h后基因表达量与未处理的比值。

图3 7个ThMYB基因的聚类分析
对NaHCO3胁迫后7个ThMYB基因的表达模式分析结果表明,除ThMYB7基因的表达在盐碱胁迫后变化不明显外,其他的6个ThMYB基因的表达都至少在一个组织的一个时间点表达量发生明显变化。其中ThMYB1在柽柳根和叶中均受NaHCO3胁迫强烈诱导,最高被诱导76.1倍。ThMYB5则主要表现为受NaHCO3胁迫抑制,在胁迫24 h根中表达量达最低,仅为对照的5.4%。ThMYB4在叶中表达也明显受NaHCO3胁迫的抑制,胁迫24 h表达量为对照的11.6%。表明这些基因能对NaHCO3胁迫作出应答,但具有不同的组织特异性。利用Clustal软件对这7个ThMYB基因的表达趋势进行聚类分析,结果表明,这7个ThMYB基因的表达模式可大致分为三类:第一类包括ThMYB1、ThMYB2和ThMYB4,第二类包括ThMYB3和ThMYB6,第三类包括ThMYB5和ThMYB7。
3 结果与讨论
柽柳生态适应性很强,能够抗干旱、耐盐碱和耐高温,这些特点使得对柽柳的应激相关基因的克隆和抗逆性机制的研究具有重要意义[18]。尽管这样,目前只有少数关于柽柳耐盐、抗干旱的相关基因的研究。MYB家族蛋白是目前植物中研究较为热点的一类蛋白,MYB转录因子参与调控多种植物应激反应,其中MYB转录因子在植物抗盐耐旱方面也存在一定作用[19]。
本研究通过对柽柳盐碱胁迫不同组织不同时间点的7个转录组数据分析从而克隆获得了7个ThMYB基因,对这7个ThMYB基因的保守序列、系统进化和盐碱胁迫下的时间和组织表达谱等信息进行分析。7个柽柳ThMYB基因的推导蛋白长度为206~918 aa,虽然变化较大但这7个ThMYB基因都具有保守的MYB结构域。参照Chen[17]等的拟南芥MYB基因分类,柽柳ThMYB基因主要归为R2R3-MYB亚家族(包括ThMYB1、ThMYB2、ThMYB3、ThMYB5、ThMYB6、ThMYB7)和MYB-related亚家族(ThMYB4)。然而,归于同一亚家族的ThMYB基因在盐碱胁迫后的表达趋势并不一致,如R2R3-MYB亚家族的ThMYB1表达明显上调,而ThMYB5表达强烈一致。表明不同的ThMYB基因可能受不同的信号调控,参与不同的胁迫通路应答途径。
已有研究表明土豆中的单一MYB蛋白具有非生物胁迫响应并且可以提高植物的耐盐性[7]。小麦TaMYB基因具有增强植物耐盐抗旱能力,在NaCl、PEG和ABA胁迫下TaMYB33可以通过保持渗透压平衡和清除活性氧(ROS)从而增强小麦的抗盐抗旱能力[20]。水稻OsMYB基因对干旱、盐碱环境具有一定的耐受性,OsMYB2属于R2R3-MYB其过表达植物的耐盐抗旱能力力比野生型更敏感,Yang[21]等人研究发现过表达OsMYB2植物积累了大量可溶性糖、过氧化氢(H2O2)和丙二醛从而使植物具有一定的耐盐抗旱能力。然而木本植物的MYB基因的功能研究较少,柽柳ThMYB还未开展抗旱耐盐功能方面的研究,还需要进一步完善。至于ThMYB基因如何调控柽柳耐盐碱生理功能以及参与柽柳的耐盐碱应答调控途径更有待进一步研究。
[1] Jin H L, Martin C. Multifunctionality and diversity within the plant MYB-gene family[J]. Plant Molecular Biology,1999,41(5):577-585.
[2] 陈清,汤浩茹,董晓莉,等.植物MYB转录因子的研究进展[J].基因组学与应用生物学,2009,28(2):365-372.
[3] 刘蕾,杜海,唐晓凤,等.MYB转录因子在植物抗逆胁迫中的作用及其分子机理[J].遗传,2008,30(10):1265-1271.
[4] Paz-Ares J, Ghosal D, Wienand U, et al. The regulatory c1 locus of Zea mays encodes a protein with homology to myb oncogene products and with structural similarities to transcriptional activators[J]. EMBO Joural,1987,6(12):3553-3558.
[5] Stracke R, Werber M, Weisshaar B. The R2R3-MYB gene family in Arabidopsis thaliana[J]. Current Opinion in Plant Biology,2001,4(5):447-456.
[6] Pattanaik S, Kong Q, Zaitlin D, et al. Isolation and functional characterization of a floral tissue-specific R2R3 MYB regulator from tobacco[J]. Planta,2010,231(5):1061-1076.
[7] Shin D J, Moon S, Han S, et al. Expression of StMYB1R-1, a Novel Potato Single MYB-Like domain transcription factor, increases drought tolerance[J]. Plant Physiology,2011,155(1):421-432.
[8] Jun S S, Hwang B S, kaeyoung N, et al. Expression of the Arabidopsis AtMYB44gene confers drought/salt-stress tolerance in transgenic soybean[J]. Molecular Breeding,2012,29(3):601-608.
[9] Ban Y, Honda C, Hatsuyama Y, et al. Isolation and functional analysis of a MYB transcription factor gene that is a key regulator for the development of red coloration in apple skin[J]. Plant Cell Physiol,2007,48(7):958-970.
[10] Prabu G, Prasad G. Functional characterization of sugarcane MYB transcription factor gene promoter (PScMYBAS1) in response to abiotic stresses and hormones[J]. Plant Cell Reports,2012,31(4):661-669.
[11] Tominaga Wada R, Nukumizu Y, Sato S, et al. Control of plant trichome and root-hair development by a tomato (Solanum lycopersicum) R3 MYB transcription factor[J]. PloS One,2013,8(1):504-516.
[12] Cui M H, Kyoung S Y, Hyoung S J. An Arabidopsis R2R3-MYB transcription factor, AtMYB20, negatively regulates type 2C serine/threonine protein phosphatases to enhance salt tolerance[J]. Febs Letters,2013,587(12):1773-1778.
[13] Rahaie M, Xue G P, Naghavi M, et al. A MYB gene from wheat (TriticumaestivumL.) is up-regulated during salt and drought stresses and differentially regulated between salt-tolerant and sensitive genotypes[J]. Plant Cell,2010,29(8):835-844.
[14] Hong S, Su M C, Jia F J, et al. Heterologous expression of the chrysanthemum R2R3-MYB transcription factor CmMYB2 enhances drought and salinity tolerance, increases hypersensitivity to ABA and delays flowering in arabidopsis thaliana[J]. Molecular Biotechnology,2012,51(2):160-173.
[15] Wang C, Gao C Q, Wang L Q, et al. Comprehensive transcriptional profiling of NaHCO3-stressed Tamarix hispida roots reveals networks of responsive genes[J]. Plant Mol Biol,2014,84(1):145-157.
[16] 杨桂燕,王玉成,王超,等.刚毛柽柳Dof基因的克隆及盐胁迫表达谱[J].东北林业大学学报,2011,39(12):1-3.
[17] Chen Y H, Yang X Y, He K, et al. The MYB transcription factor superfamily of Arabidopsis: expression analysis and phylogenetic comparison with the rice MYB family[J]. Plant Molecular Biology,2006,60(1):107-124.
[18] Li H Y, Wang Y C, Jiang J, et al. Identification of genes responsive to salt stress on Tamarix hispida roots[J]. Gene,2009,433(1/2):65-71.
[19] Cai H S, Tian S, Liu C L, et al. Identification of a MYB3R gene involved in drought, salt and cold stress in wheat (TriticumaestivumL.)[J]. Gene,2011,485(2):146-152.
[20] Qin Y X, Wang M C, Tian Y C, et al. Over-expression of TaMYB33 encoding a novel wheat MYB transcription factor increases salt and drought tolerance in Arabidopsis[J]. Molecular Biology Reports,2012,39(6):7183-7192.
[21] Yang A, Dai X Y, Zhang W H. A R2R3-type MYB gene, OsMYB2, is involved in salt, cold and dehydration tolerance in rice[J]. Journal of Experiment Biology,2012,63(7):2541-2556.
Identification and Salinity-alkali Stress Expression Analysis of SevenThMYBGene fromTamarixhispida/
Zhang Fengjiao, Wang Yucheng, Gao Caiqiu
(State Key Laboratory of Forest Genetics and Tree Breeding, Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University.-2014,42(8).-1~5
Seven full length cDNAs ofThMYB(named as ThMYB1-7) were cloned from seven transcriptome cDNA libraries ofTamarixhispida. TheseThMYBgenes encode proteins of 206-918 amino acid residues with the molecular mass of 22.9-75.9 kDa and theoretical isoelectric point of 5.06-9.71. The gene expression profiles inT.hispidaresponding to NaHCO3were further investigated by analyzing seven transcriptome data. AllThMYB(exceptedThMYB7) expression were regulated by saline-alkali stress, although theseThMYBproteins shared different length and low homology. It suggested that theThMYBs may involved in the saline-alkali stress tolerance ofT.hispida.
Tamarixhispida; Salt stress; Expression profile; MYB transcription factor
1) 黑龙江省教育厅科学技术研究项目(12523017)和国家自然科学基金资助(31270708)。
张凤娇,女,1989年10月生,林木遗传育种国家重点实验室(东北林业大学),硕士研究生。
高彩球,林木遗传育种国家重点实验室(东北林业大学),副教授。E-mail:gaocaiqiu@nefu.edu.cn。
2013年8月22日。
S718.46
责任编辑:潘 华。

