GSTT 1基因多态性及吸烟与胃癌的关系
史剑权 骆宝建 刘荣英 陈言东
1.首都医科大学附属北京胸科医院重症医学科,北京 101149;2.包头医学院第二附属医院,内蒙古 包头 014030
胃癌(gastric cancer,GC)的发生是一个多因素、多阶段的过程,它与环境致癌物、个体的遗传易感性等因素密切相关,因此,与环境致癌物代谢有关的代谢酶(包括GST家族、CYP家族等)基因多态性的问题成了当前肿瘤研究的一个重要方向。GSTT1作为谷胱甘肽 S-转移酶 (glutathione-s-transferase,GSTs,EC2.5.1.18)家族的重要成员,其基因多态性(包括存在型和缺失型)与肿瘤的关系,也就引起了国内外学者的关注。近年来,国内外的研究报道表明GSTT1基因缺失型与肺癌[1]、肝癌[2]、胰腺癌[3]等多种肿瘤的易感性有关。关于GSTT1基因多态性与胃癌遗传易感性方面的研究,结论尚不统一[4]。本研究中,通过研究吸烟(环境因素)和GSTT1基因多态性(遗传因素)对胃癌发生的影响,为胃癌的病因研究以及一级预防提供依据。
1 材料与方法
1.1 标本来源
所有胃癌病例均来源于内蒙古消化病研究所(设于包头医学院第二附属医院)和包头市肿瘤医院。所有胃癌病例均由组织病理学检查确诊为胃癌。对照组的个体均来自于当地排除肿瘤病史的一般人群。所有标本收集的起止时间为2005年5月~2006年3月。胃癌组患者60例,男43例,女17例,年龄(55.60±8.14)岁;对照组83例,男53例,女30例,年龄(56.33±7.90)岁。胃癌组和对照组的年龄和性别比较,差异无统计学意义(P>0.05),具有可比性。
1.2 流行病学调查
由经过培训的医护人员,对所有研究对象(胃癌组和对照组)进行包括性别、年龄、吸烟情况的流行病学调查。对吸烟情况分为“不吸烟”和“吸烟”两种。其中,“吸烟”规定为每天至少吸1支烟,持续1年以上者,达不到这一标准者规定为“不吸烟”。
1.3 主要试剂
①Taq DNA 聚和酶,dNTPs,DNA Marker,无菌去离子水均购于加拿大上海Songon生物工程技术服务有限公司。②琼脂糖、EB、Tris、EDTA、硼酸、溴酚兰均购于北京鼎国生物技术有限公司。③DNA提取液:由内蒙古基因诊断研究所提供。
1.4 GSTT1基因型的检测
1.4.1 DNA的提取 取胃癌组患者及对照组的人外周血2 mL,置入加有EDTA的抗凝试管中,于半小时内置于-20℃低温冰箱中冷冻保存或立即进行基因组DNA的提取(提取方法由内蒙古基因诊断中心提供)。
1.4.2 PCR扩增 应用聚合酶链反应PCR方法扩增基因组DNA,参照文献[5],构建GSTT1和β-珠蛋白基因的引物(表 1),其中,β-珠蛋白(268 bp)作为内对照。所有的引物序列均经美国生物信息中心(national center for biotechnology information,NCBI) 的序列比对工具 (basic local alignment search tool,BLAST) 的验证,并由加拿大上海Songon生物技术有限公司合成(PAGE纯化)。GSTT1基因引物序列为正义链5'-TTCCTTACTGGTCCTCACATCTC-3', 反 义链 5'-TCACCGGATCATGGCCAGCA-3'。β-珠蛋白基因引物序列为正义链5'-GAAGAGCCAAGGACAGGTAC-3',反义链5'-CAACTTCATCCACGTTCACC-3'。PCR反应体系 15 μL,其中包括模板 DNA 3 μL,GSTT1 和β-珠蛋白的上下游引物(浓度为 25 μmol/L)各 0.3 μL、dNTP (浓度为 25 mM)0.3 μL、10×buffer 1.5 μL、Tag酶(浓度 5 U/μL)为 0.35 μL、MgCl2(浓度为 25 mM)1.3 μL、无菌去离子水 7.35 μL。上 PCR 仪,PCR 反应循环参数:95℃预变性 5 min,94℃变性 45 s,60e退火45 s,73℃延伸 45 s,共 36 个循环,最后再 73℃延伸10 min后终止扩增。
1.4.3 电泳 取PCR产物15 μL,加2 μL TEB缓冲液,3%琼脂糖凝胶电泳,EB染色,紫外灯下观察结果。
1.5 统计学方法
所有的统计分析以及统计图的绘制均采用SPSS 13.0软件包。①计量资料的组间比较采用t检验,计数资料的组间比较采用χ2检验,双侧检验,以P<0.05为差异有统计学意义。②吸烟、GSTT1基因型的联合作用与胃癌的关系采用分层分析,以比值比OR及其95%的可信区间(confidence interval,CI)表示相对危险度。
2 结果
2.1 GSTT1基因型的检测结果
GSTT1扩增产物的大小为480 bp,内对照β-珠蛋白产物的大小为268 bp,同时出现480 bp及268 bp两条带者即为GSTT1基因存在型,用GSTT1(+)表示;只出现268 bp一条带(β-珠蛋白基因)者为GSTT1基因缺失型,用 GSTT1(-)表示,见图 1。其中,1、3、4 泳道为 GSTT1基因存在型,2、5、6泳道为 GSTT1基因缺失型,M为marker。
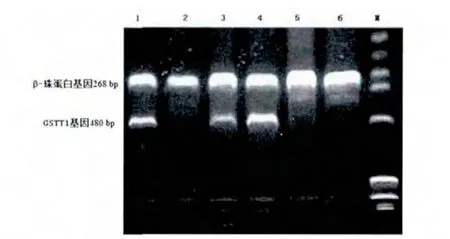
图1 GSTT1和β珠蛋白基因PCR产物电泳结果
2.2 胃癌组及对照组GSTT1基因型分布的比较
分别对胃癌组60例和对照组83例进行了GSTT1基因检测,结果表明,胃癌组GSTT1(-)例数为34 例,GSTT1(+)例数为 26 例;同时,对照组中,GSTT1(-)例数为 33 例,GSTT1(+)例数为 50 例。GSTT1 基因缺失率为56.7%(34/60),明显高于对照组的39.8%(33/83),差异有统计学意义(χ2=3.998,P<0.05)。携带GSTT1(-)基因型者发生胃癌的危险性是携带GSTT1(+)基因型者的 1.98 倍(OR=1.98,95%CI:1.01~3.89)。
2.3 胃癌组及对照组吸烟情况的比较
分别调查胃癌组和对照组的吸烟情况,结果发现,胃癌组中吸烟者的例数为39例,不吸烟的例数为21例;对照组中,吸烟者的例数为29例,不吸烟的例数为54例。胃癌组中吸烟者的比例为65.0%(39/60),高于对照组34.9%(29/83),组间比较差异有统计学意义(P<0.05)。吸烟者发生胃癌的危险性是非吸烟者的 3.458 倍(OR=3.458,95%CI:1.723~6.939)。
2.4 GSTT1基因型及吸烟与胃癌的关系
2.4.1 根据是否吸烟分层分析GSTT1基因型与胃癌的关系 不吸烟人群中,胃癌组和对照组的GSTT1基因型分布差异无统计学意义(P > 0.05),GSTT1(-)基因型未显著增加不吸烟者患胃癌的风险。吸烟人群中,胃癌组和对照组的GSTT1基因型分布差异有统计学意义(P<0.05);并且,吸烟人群中,GSTT1缺失型的人患胃癌的风险性是GSTT1存在型的4.75倍(P=0.003,OR=4.75,95%CI:1.68~13.41),即 GSTT1(-)基因型显著增加吸烟者患胃癌的风险。见表1。
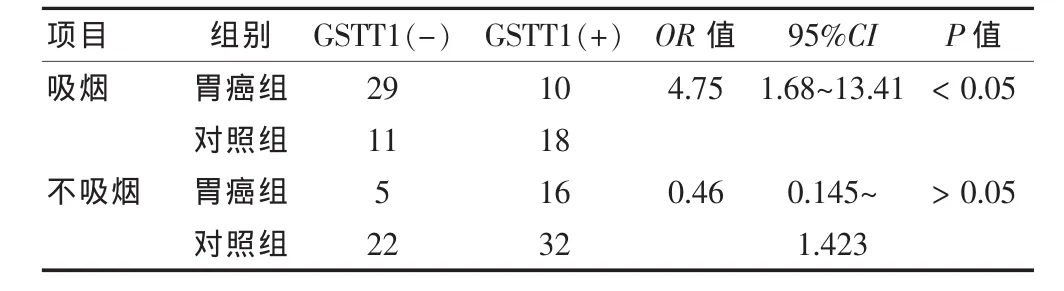
表1 根据吸烟情况分层分析GSTT1基因型与胃癌的关系(例)
2.4.2 根据GSTT1基因型分层分析吸烟与胃癌的关系 GSTT1(+)人群中,吸烟者在胃癌组和对照组中的分布无显著性差异(P>0.05),吸烟未明显增加GSTT1(+)人群患胃癌的风险。GSTT1(-)人群中,吸烟者在胃癌组和对照组中的分布差异有统计学意义(P<0.05);并且,GSTT1(-)人群中,吸烟者患胃癌的风险性是不吸烟者的 11.6 倍(OR=11.6,95%CI:3.516~28.266),即吸烟显著增加GSTT1(-)人群患胃癌的风险。见表2。
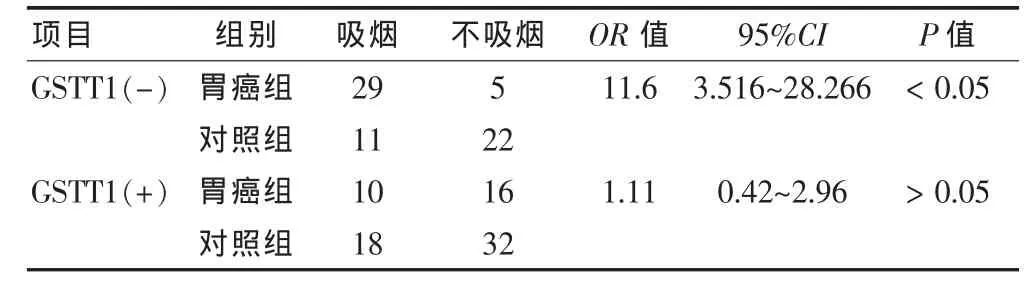
表2 根据GSTT1基因型分层分析,吸烟与胃癌的关系(例)
3 讨论
胃癌目前依然是导致恶性肿瘤相关死亡的第2位疾病[6],具有发病率高、转移率高、病死率高、早期诊断率低、5年生存率低等特点[7],给家庭和社会带来极大危害,因此,进行胃癌的病因学研究,筛选胃癌的易感基因和高危人群,对胃癌进行有效的一级预防(病因预防),就具有十分重要的意义。
谷胱甘肽转硫酶是人体内一组具有重要解毒作用的多基因酶家族,属Ⅱ相代谢酶;它参与致癌物的代谢,是体内重要的解毒机制[8]。目前,将人的胞浆型GSTs同工酶分为四种,即α、μ、π和θ,分别由不同的基因编码。编码GST-θ同功酶的GSTT1基因定位于人类22号染色体q11.23。GSTT1基因在人群中具有基因缺失多态性,可分为存在型GSTT1(+)和缺失型GSTT1(-),亦即一些人不具有GSTT1基因。大量研究表明,不同种族、不同地域的群体,GSTT1基因缺失型的频率差异很大,GSTTl基因缺失型在非洲、亚洲、欧洲人群中分布频率分别为 15%~26%、16%~64%和10%~21%[9]。本研究中,通过分析对照组,提示内蒙古地区一般人群GSTT1基因缺失频率为39.8%。
不具有GSTT1基因的个体,由于体内GSTT1基因的缺失,导致机体不能产生有活性的GST-θ同功酶,进而不能有效去除体内亲电子致癌物,这可能增加了体细胞突变的风险并最终导致肿瘤的形成[10],所以,GSTT1基因多态性可能与癌症易感性有关。本实验中,胃癌组GSTT1基因缺失率为56.7%,显著高于对照组的39.8%,差异有统计学意义(P<0.05)。携带GSTT1(-)基因型者发生胃癌的危险性比 GSTT1(+)者明显升高(OR=1.98,95%CI:1.01~3.89),提示GSTT1基因缺失型是胃癌的易感基因型。这与Palli等[11]、Zhao 等[12]学者的结论一致;但同时 Nguyen 等[13]、García-González等[14]报道胃癌组和对照组GSTT1基因型频度分布的差异无显著性。国外另一项Meta分析的结果显示[15],GSTT1基因多态性对不同种族人群胃癌易感性的作用不同:在白种人中GSTT1缺失增加患胃癌风险,在黄种人中GSTT1缺失未增加患胃癌风险。不同作者报道不同种族、不同地区GSTT1基因多态性与胃癌易感性关系的研究结果的不一致,其原因是多方面的:不同地区、不同种族人群中环境因素、生活习惯、遗传特征的差异;胃癌是多种基因、多种环境因素长期相互作用的结果,某种致癌的环境因素可能会掩盖个体GSTT1基因缺失在胃癌发病过程中所起的作用;不同研究中样本选择、样本量大小、研究方法的差异。
烟草燃烧所产生的烟雾中,至少有43种为已知的致癌物[16],吸烟是一种公认的致癌因素。本研究中,胃癌组的吸烟率明显高于对照组(P<0.05),吸烟者相对非吸烟者,患胃癌的风险显著上升(OR=4.75),吸烟是胃癌的危险因素之一,这与Nomura等[17]的观点一致。同时,GSTT1编码的GST-θ同工酶在烟草中的致癌物:乙烯氧化物、环氧丁烷、烃类氧化物的解毒第二时相发挥作用,所以,GSTT1编码的酶的缺失将可能导致烟草中的有害致癌物的解毒障碍,增加相应人群致癌的危险性。近年来,代谢酶系基因多态性、吸烟与肿瘤易感性相互关系的研究备受关注。本研究中,通过两组分层分析(见表1、2)可看出:①GSTT1(-)基因型未明显增加不吸烟人群患胃癌的风险(P>0.05);但GSTT1(-)基因型会显著增加吸烟人群患胃癌的风险(OR=4.75,95%CI:1.68~13.41)。②吸烟未明显增加GSTT1(+)人群患胃癌的风险性(P>0.05);但吸烟会显著增加GSTT1(-)人群发生胃癌的风险(OR=11.6,95%CI:3.516~28.266)。GSTT1(-)基因型且吸烟的人,患胃癌的风险明显提高。GSTT1缺失基因型和吸烟协同作用,共同增加发生胃癌的风险。
总之,本研究认为,胃癌的发生涉及到多种环境因素及遗传因素长期的相互作用。在内蒙古地区,GSTT1缺失基因型是胃癌的易感基因型,吸烟是胃癌的危险因素之一,吸烟和GSTT1(-)基因在胃癌的发生中有协同作用。对于GSTT1基因缺失的这类胃癌的高危人群,应特别加强教育,使其改善生活习惯,尽量杜绝主动吸烟和被动吸烟,定期体检,预防胃癌的发生。
[1]Dzian A,Halasova E,Matakova T,et al.Lung adenocarcinoma and squamous cell carcinoma in association with genetic polymorphisms of GSTs in Slovak population[J].Neoplasma,2012,59(2):160-167.
[2]Chen J,Ma L,Peng NF,et al.Relationship between GSTT1 gene polymorphism and hepatocellular carcinoma in patients from China[J].Asian Pac J Cancer Prev,2012,13(9):4417-4421.
[3]Bu X,Zhao C.Significant association between GSTT1 null genotype and susceptibility to pancreatic cancer[J].Mol Biol Rep,2013,40(7):4295-4299.
[4]曹亚.肿瘤学[M].2版.北京:人民卫生出版社,2003:24.
[5]Srivastava DS,Mandhani A,Mittal B,et al.Genetic polymorphism of glutathione S-transferase genes (GSTM1,GSTT1 and GSTP1)and susceptibility to prostate cancer in Northern India[J].BJU Int,2005,95(1):170-173.
[6]闻旭阳,戴广海.hMLH1基因启动子CpG岛甲基化,微卫星不稳定与胃癌[J].中国医药导报,2011,8(7):9-11.
[7]陈玉敏,王金林,师锁江,等.胃癌患者外周血中CK-19的表达及其临床意义[J].中国医药导报,2013,10(14):4-6.
[8]张力为,伊力亚尔·夏合丁,吴明拜,等.致癌物代谢酶基因(CYP2C19、GSTT1)多态性与哈萨克族人群食管癌发病风险关系的研究[J].实用肿瘤杂志,2009,24(3):232-236.
[9]Cotton SC,Sharp L,Little J,et al.Glutathione S-transferase polymorphisms and colorectal cancer a HuGE review[J].Am J Epidemiol,2000,151(1):7-32.
[10]王雪峰,戴路明,张继先.Ⅰ、Ⅱ相代谢酶基因多态性与肺癌遗传易感性研究进展[J].临床肺科杂志,2008,13(9):1162-1164.
[11]Palli D,Saieva C,Gemma S,et al.GSTT1 and GSTM1 gene polymorphisms and gastric cancer in a high-risk italian population[J].Int J Cancer,2005,115(2):284-289.
[12]Zhao Y,Luo Y,Huang B,et al.GSTT1 null genotype contributes to increased risk of gastric cancer in Chinese population:evidence from a meta-analysis[J].Tumour Biol,2013,34(3):1691-1697.
[13]Nguyen TV,Janssen MJ,van Oijen MG,et al.Genetic polymorphisms in GSTA1,GSTP1,GSTT1,and GSTM1 and gastric cancer risk in a Vietnamese population[J].Oncol Res,2010,18(7):349-355.
[14]García-González MA,Quintero E,Bujanda L,et al.Relevance of GSTM1,GSTT1,and GSTP1 gene polymorphisms to gastric cancer susceptibility and phenotype[J].Mutagenesis,2012,27(6):771-777.
[15]Saadat M.Genetic polymorphisms of glutathione S-transferase T1 (GSTT1)and susceptibility to gastric cancer:a meta-analysis[J].Cancer Sci,2006,97(6):505-509.
[16]王辰,肖丹,孙永昌,等.中国临床戒烟指南(2007年版,试行本)[J].国际呼吸杂志,2008,28(16):961-970.
[17]Nomura AM,Wilkens LR,Henderson BE,et al.The association of cigarette smoking with gastric cancer:the multiethnic cohort study[J].Cancer Causes Control,2012,23(1):51-58.

