人参皂苷Rd酸水解产物的RRLC-Q-TOFMS研究
郭迎迎,吴 巍,秦秋杰,孙靖辉,刘淑莹,2
(1.长春中医药大学,吉林省人参科学研究院,吉林 长春 130117;2.中国科学院长春应用化学研究所,长春质谱中心,吉林 长春 130022)
人参皂苷Rd酸水解产物的RRLC-Q-TOFMS研究
郭迎迎1,吴 巍1,秦秋杰1,孙靖辉1,刘淑莹1,2
(1.长春中医药大学,吉林省人参科学研究院,吉林 长春 130117;2.中国科学院长春应用化学研究所,长春质谱中心,吉林 长春 130022)
利用高分离快速液相色谱-四极杆-飞行时间质谱(RRLC-Q-TOF MS)联用技术对人参皂苷Rd酸水解产物进行了分析研究。通过化合物的保留时间、精确分子质量信息、串联质谱碎片信息,分析鉴定了7种Rd酸水解产物,分别为C-Y1、C-Y2、F2、20(S)-Rg3、20(R)-Rg3、Rk1和Rg5。串联质谱分析水解产物获得了原人参二醇苷元特征离子m/z459(20(S)-Rg3,20(R)-Rg3,F2),Δ20(21)或Δ20(22)位脱水原人参二醇型苷元特征离子m/z441(Rk1,Rg5),C-24、C-25位水合原人参二醇苷元特征离子m/z477(C-Y1和C-Y2)。研究表明,人参皂苷Rd在酸性条件下发生化学转化,包括取代糖基的水解反应,Δ20(21)或Δ20(22)位脱水反应和C-24,C-25位水合加成反应。本实验可为研究人参在配位方面的化学物质基础提供方法参考。
人参皂苷Rd;高分离快速液相色谱-四极杆-飞行时间-质谱(RRLC-Q-TOF MS);水解
人参为五加科植物人参(panaxginseng C. A. Meyer)的干燥根,其主要有效成分为人参皂苷类化合物,具有广泛的药理活性[1],包括抗氧化、抗炎、抗凋亡、免疫兴奋等[2-3]。目前,液相色谱-质谱联用技术已成为分析人参皂苷的有效方法,可通过获取分子质量和结构信息快速分析混合物中的化合物[4-6]。近年来,迅速发展的超高效液相色谱(UPLC)和高分离度液相色谱(RRLC)与四极杆飞行时间质谱(Q-TOF MS)联用技术在中药复杂体系分析中有不可比拟的优势,可提供高分离度、高分辨率、高灵敏度和快速的人参检测方法[7-8]。
人参与不同中药配伍,煎煮液的pH值会随着配伍中药的不同而改变,从而影响人参皂苷的溶出和种类的变化[9]。口服人参及相关产品后,在胃肠道的酸性环境中会产生多种代谢物[10],文献[11]报道了在体外胃酸条件下的人参皂苷水解研究。也有文献报道了20(S)-原人参三醇型皂苷Re、Rg2、Rf在酸性条件下的化学转化研究,鉴定了水解产物[12],并进行了人参皂苷混合物在不同pH值条件下的水解研究[13]。人参皂苷Rd在人参中的含量较低,但由于其对神经系统、心脑血管以及肾功能的良好药理作用,引起学者们的关注[14-15]。本实验利用高分离快速液相色谱-四极杆-飞行时间质谱(RRLC-Q-TOF MS)及串联质谱(MS/MS)技术,对人参皂苷Rd在酸性条件下的水解产物进行分析,旨在为研究人参在配位方面的化学物质基础提供方法参考。
1 实验部分
1.1仪器与试剂
RRLC-Q-TOF MS/6520:美国Agilent公司产品,其中RRLC色谱仪配备1200SL二元梯度泵、在线真空脱气机、SLplus标准自动进样器、自动进样器控温模块、智能柱温箱,Q-TOF质谱仪配备双喷雾ESI源、自动校准系统。
人参皂苷Rd、20(S)-Rg3、20(R)-Rg3、F2、Rk1、Rg5对照品:购自吉林大学;乙腈(色谱纯):购自美国Fisher公司;甲酸(96%):购自美国Tedia公司;Milli-Q超纯水:电阻率为18 MΩ·cm;其它试剂:均为分析纯,购自北京化工厂。
1.2样品制备方法
精密称取1 mg人参皂苷Rd对照品,溶解于甲酸调节的pH值为2.0的溶液中,60 ℃水浴加热5 h后,用50%甲醇定容至1 mL,待RRLC-Q-TOF MS分析。
1.3实验条件
1.3.1色谱条件 Agilent SB-C18色谱柱(3.0 mm×100 mm×1.8 μm),柱温35 ℃;二元线性梯度洗脱:流动相为0.1%甲酸水溶液(A)和乙腈(B);梯度洗脱如下:0~13 min(18%~46%B),13~20 min(46%~50%B),20~23 min(50%~90%B),23~25 min(90%B);流速0.3 mL/min;进样量5 μL。
1.3.2质谱条件 电喷雾负离子模式,质量扫描范围m/z100~2 200,干燥气(N2)流量10.0 L/min,干燥气温度350 ℃,雾化气压力255 kPa,毛细管电压3.5 kV,碎裂电压200 V,锥孔电压65 V,八极杆射频电压250 V。实验数据采用Masshunter Qualitative Analysis(B.03.01)分析软件处理。
2 结果与讨论
实验表明,人参皂苷Rd在pH值为2.0的条件下进行酸水解,能够促进皂苷的化学转化反应,有助于皂苷的分析与检测。利用RRLC-Q-TOF MS分析人参皂苷Rd酸水解产物,在1.3.1条件下混合物得到很好的分离。人参皂苷Rd酸水解产物的RRLC-Q-TOF MS提取离子流图示于图1。通过化合物的保留时间、精确分子质量和串联质谱分析,确定了7种水解产物(峰1~7),数据列于表1。以0.1%甲酸溶液作为流动相,在负离子模式全扫描质谱图中,化合物均给出[M-H]-准分子离子和[M+HCOO]-加合离子峰,这为确定水解产物的分子质量提供了有用的信息。峰1和峰2为同分异构体生成[M+HCOO]-离子(m/z847.50);峰3、峰4、峰5为同分异构体,产生[M+HCOO]-离子(m/z829.49);峰6和峰7为同分异构体,产生[M+HCOO]-离子(m/z811.48)。为进一步确定水解产物的结构,分别对峰1~7进行串联质谱研究,通过MS/MS特征碎片离子分析和精确质量测定,分析了化合物苷元类型和取代糖链序列,质量精确度为2×10-6~1×10-5。碎片离子采用Costello命名法[16-17],在下面的讨论中,离子的m/z值用整数表示。选择峰1和峰2的[M+HCOO]-离子(m/z847)进行串联质谱研究,均产生碎片离子m/z801、639、477、161、101。分析数据可得,离子m/z801为母离子[M+HCOO]-丢失甲酸根产生的[M-H]-,母离子丢失HCOOH和Glc残基(46 u+162 u)产生离子m/z639 (Y0α),表明Glc为末端取代糖,进一步丢失Glc残基(162 u)产生离子m/z477 (Y’0β),说明有2个Glc取代;而m/z221离子(1,3A2β)则说明取代糖链为Glc-Glc。 Glc残基离子m/z161及Glc键2与键5断裂后生成的离子m/z101(2,5A1α/2,5A1β)也在谱图中出现。m/z477离子与二醇型苷元离子m/z459对比加合了一分子水(18 u)。结合文献[13],推断峰1和峰2为Rd的C-20位葡萄糖水解后C-24、C-25位再加合一分子水,生成分子质量为802 u的水解产物C-Y1和C-Y2,C-Y1的MS/MS谱图示于图2a。峰3、峰4、峰5的分子质量均为784 u,为人参皂苷Rd水解掉一分子葡萄糖的产物。进一步对峰3、峰4、峰5的 [M+HCOO]-离子(m/z829)进行MS/MS研究,均得到离子m/z459,为二醇型苷元的特征离子,表明这3个水解产物苷元没有发生变化。m/z621是丢掉一分子Glc残基产生的离子。在峰4和峰5的MS/MS谱图中得到m/z221离子(1,3A2β),说明取代糖链为Glc-Glc,未在峰3的MS/MS谱图中发现该离子。与标准品F2对比发现,保留时间与串联质谱数据完全一致,因此确定峰3为人参皂苷Rd的C-3位末端葡萄糖水解后生成的F2。根据文献[18]报道,并与标准品20(S)-Rg3和20(R)-Rg3对照,确定峰4和峰5分别为Rd的C-20位葡萄糖水解后生成的20(S)-Rg3和20(R)-Rg3。F2的MS/MS谱图示于图2b,20(S)-Rg3的MS/MS谱图示于图2c。峰6和峰7的MS/MS谱图中给出的m/z603离子是母离子[M+HCOO]-(m/z811)丢失HCOOH和Glc残基(46 u+162 u)产生的碎片离子,m/z441是丢失HCOOH和二分子Glc残基(46 u+162 u+162 u)产生的离子,离子m/z221(1,3A2β)进一步证明存在Glc-Glc取代,推断峰6和峰7为人参皂苷Rd水解掉C-20位葡萄糖的产物。离子m/z441与二醇型苷元离子m/z459对比,脱掉一分子水(-18 u),结合文献[13,19]推断,m/z457离子为Δ20(21)-或Δ20(22)-原人参二醇皂苷元的特征离子。进一步与Rk1和Rg5的标准品比较,其保留时间和串联质谱数据完全一致。因此,推断峰6和峰7为Rd的C-20位葡萄糖水解后,20(21)位和20(22)位脱水后形成的衍生物Rk1和Rg5。峰6衍生物Rk1的MS/MS质谱图示于图2d。综上所述,人参皂苷Rd在pH 2.0的酸性环境中发生了一系列的化学反应,生成了C-Y1、C-Y2、F2、20(S)-Rg3、20(R)-Rg3、Rk1、Rg5,共7种水解产物,转化途径示于图3。

图1 人参皂苷Rd酸水解产物的RRLC-Q-TOF MS负离子模式提取离子流图Fig.1 RRLC-Q-TOF MS extracted ion chromatograms of ginsenoside Rd acid hydrolysis products in negative ion mode

注:a. C-Y1; b. F2; c. 20(S)-Rg3; d. Rk1图2 人参皂苷Rd酸水解产物二级串联质谱图Fig.2 MS/MS spectra of ginsenoside Rd acid hydrolysis products
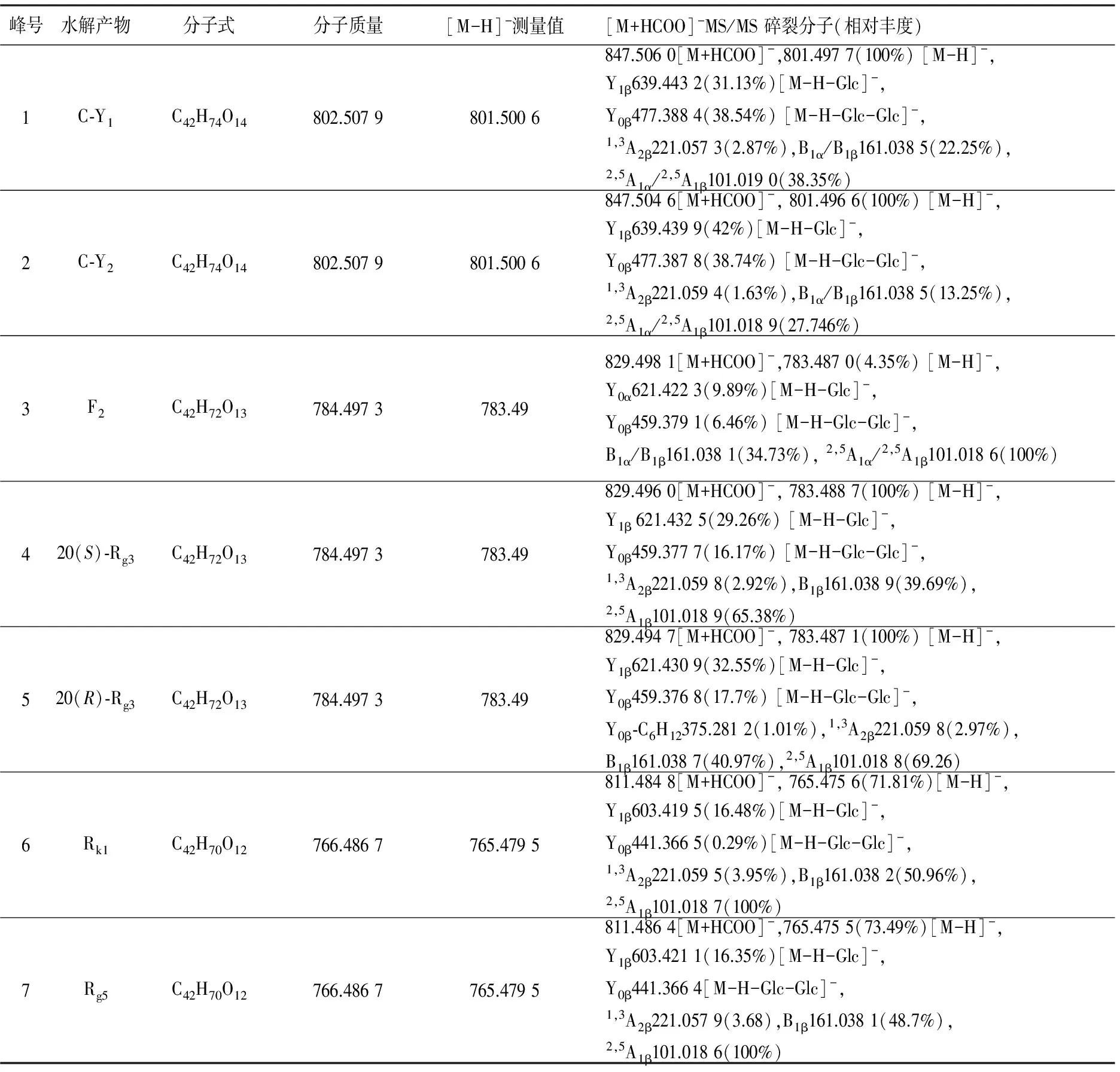
表1 人参皂苷Rd水解产物的质谱数据
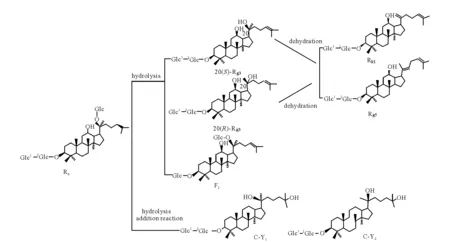
图3 人参皂苷Rd酸水解产物的转化途径Fig.3 The hydrolysis transformation pathway of ginsenoside Rd
3 结论
利用RRLC-Q-TOF MS和MS/MS分析技术对人参皂苷Rd酸水解产物进行了分析鉴定,快速测定了人参皂苷Rd酸水解后产生的水解产物C-Y1、C-Y2、F2、20(S)-Rg3、20(R)-Rg3、Rk1、Rg5。通过水解产物的鉴定推断了人参皂苷Rd的化学转化方式,包括水解、脱水和加成反应,为研究人参在配伍方面的化学物质基础提供快速、直观、准确的方法。
[1] 黎 阳,张铁军,刘素香,等.人参化学成分和药理研究进展[J].中草药,2009,40(1):164. LI Yang, ZHANG Tiejun, LIU Suxiang,et al. Research progress on chemical constituents and pharmacological activities ofPanaxginseng[J].Chinese Herbal Medicine, 2009,40(1):164(in Chinese).
[2] LU J, YAO Q, CHEN C. Ginseng compounds: An update on their molecular mechanisms and medical applications[J]. Curr Vasc Pharmaco, 2009, 7(3): 293-302.
[3] JIA L, ZHAO Y, LIANG X. Current evaluation of the millennium phytomedicine-ginseng (II):Collected chemical entities, modern pharmacology, and clinical applications emanated from traditional Chinese medicine[J]. Curr Med Chem, 2009, 16(22): 2 924-2 942.
[4] CUI M, SONG F R, ZHOU Y, et al. Rapid identification of saponins in plant extracts by electrospray ionization multi-stage tandem mass spectrometry and liquid chromatography/tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2000, 14(14): 1 280-1 286.
[5] FUZZATI N, GABETTA B, JAYAKAR K, et al. Liquid chromatography-electrospray mass spectrometric identification of ginsenosides inPanaxginsengroots[J]. Chromatogr A, 1999, 854(1/2): 69-79.
[6] WANG X, SAKUMA T, ASAFU-ADJAYE E, et al. Determination of ginsenosides in plant extracts fromPanaxginsengandPanaxquinquefoliusL. by LC/MS/MS[J]. Anal Chem, 1999, 71(8):1 579-1 584.
[7] CHAN E C Y, YAP S, LAU A, et al. Ultra-performance liquid chromatography/time-of-flight mass spectrometry based metabolomics of raw and steamedPanaxnotoginseng[J]. Rapid Commun Mass Spectrom, 2007, 21(4): 519-528.
[8] XIE G X, NI Y, SU M M, et al. Application of ultra-performance LC-TOF MS metabolite profiling techniques to the analysis of medicinalPanaxherbs[J]. Metabolomics, 2008, 4(3): 248-260.
[9] ZHANG X, WANG L N, SONG F R, et al. St- udy on the variation of chemical constituents during combination of ginseng with trogopteroum feces and semen raphani by high performance liquid chromatography mass spectrometry[J]. Chinese J Anal Chem, 2007, 35: 559-563.
[10] BAE E A, CHOO M K, PARK E K, et al. Metabolism of ginsenoside Rcby human intestinal bacteria and its related antiallergic activity[J]. Biol Pharm Bull, 2002,25(6): 743-747.
[11] PIETTA P, MAURI P, RAVA A. Hydrolysis of ginsenosides in artificial gastric fluid monitored by high-performance of liquid chromatography[J]. Chromatogr, 1986, 362(2): 291-297.
[12] WU W, QIN Q J, GUO Y Y, et al. Studies on the chemical transformation of 20(S)-protopanaxatriol (PPT)-type ginsenosides Re, Rg2, and Rfusing rapid resolution liquid chromatography coupled with quadruple-time-of-flight mass spectrometry (RRLC-Q-TOF-MS)[J]. Journal of Agricultural and Food Chemistry, 2012, 60: 10 007.
[13] ZHANG X, SONG F, CUI M, et al. Investigation of the hydrolysis of ginsenosides by high performance liquid chromatography-electrospray ionization mass spectrometry[J]. Planta Med, 2007, 73(11): 1 225-1 229.
[14] 张 琛,赵 钢.人参皂苷Rd的药理作用研究进展[J].中国新药杂志,2011, 20(11):953-958. ZHANG Chen, ZHAO Gang. Research progress of the pharmacological effects of ginsenoside Rd[J].Chinese Journal of New Drugs, 2011,20(11):953-958(in Chinese).
[15] 周超群,周 珮.人参皂苷Rd的研究进展[J].中草药,2009,40(5):832-836. ZHOU Chaoqun, ZHOU Pei. Research progress of ginsenoside Rd[J].Chinese Traditional and Herbal Drugs, 2009,40(5):832-836(in Chinese).
[16] DOMON B, COSTELLO C E. A systematic nomenclature for carbohydrate ragmentations in FAB-MS/MS spectra of glycoconjugates [J]. Glycoconj J, 1988, 5(4): 397-409.
[17] PERREAULT H, COSTELLO C E. Liquid secondary ionization tandem and matrix-assisted laser desorption/ionization time-of-flight mass spectrometric characterization of glycosphingolipid derivatives [J]. Org Mass Spectrom, 1994, 29(12): 720-735.
[18] 杨 柳,许舜军,曾 星,等. 大鼠尿中人参皂苷Rd及其代谢物的LC-MS研究[J].药学学报, 2006, 41(8): 742-746. YANG Liu, XU Shunjun, ZENG Xing, et al.Study of ginsenoside Rdand its metabolites in rat urine by LC-MS[J]. Acta Pharmaceutica Sinica, 2006, 41(8): 742-746(in Chinese).
[19] KWON S W, HAN S B, PARK I H, et al. Liquid chromatographic determination of less polar ginsenosides in processed ginseng[J]. Chromatogr A, 2001, 921(2):335-339.
StudyontheHydrolysisofGinsenosideRdbyRRLC-Q-TOFMS
GUO Ying-ying1, WU Wei1, QIN Qiu-jie1, SUN Jing-hui1, LIU Shu-ying1,2
(1.JilinGinsengAcademy,ChangchunUniversityofChineseMedicine,Changchun130117,China; 2.ChangchunCenterofMassSpectrometry,ChangchunInstituteofAppliedChemistry,ChineseAcademyofSciences,Changchun130022,China)
Rapid resolution liquid chromatography coupled with quadrupole-time-of-flight mass spectrometry (RRLC-Q-TOF MS) method was developed for analyzing the hydrolysis ofginsenosideRdin acidic condition. The hydrolysis products were identified by comparison with the retention time of the standard compounds, the accurate mass and the characteristic fragment ions obtained from RRLC-Q-TOF-MS/MS analysis, including C-Y1, C-Y2, F2, 20(S)-Rg3, 20(R)-Rg3, Rk1and Rg5. The specific product ions of aglycone PPD (m/z459), Δ20 (21)-or Δ20 (22)-dehydration-PPD (m/z441) and C-24, C-25 hydrated-PPD (m/z477) by MS/MS were discussed for structural characterization. The chemical transformation mechanisms ofginsenosideRdwere demonstrated in acidic condition, include saccharide hydrolysis, Δ20(21)- or Δ20(22)-dehydration and hydration addition reactions at C-24, C-25. The hydrolysis transformation pathway ofginsenosideRdwas summarized. The developed RRLC-Q-TOF-MS/MS method was applied for comparative analysis of ginsenoside Rdand related hydrolysis transformation products.
ginsensideRd; rapid resolution liquid chromatography coupled with quadrupole-time-of-flight mass spectrometry (RRLC-Q-TOF MS); hydrolysis
2013-03-26;
:2013-05-15
吉林省科技发展重大项目(20096043);吉林省高校创新团队发展计划(JTD201213)资助
郭迎迎(1987~),女(汉族),吉林人,硕士研究生,从事中药化学研究。E-mail: guoyingying871108@126.com
刘淑莹(1943~),女(汉族),黑龙江人,研究员,从事中药化学和有机质谱学研究。E-mail: syliu19@yahoo.com.cn
O 657.63
:A
:1004-2997(2014)01-0079-06
10.7538/zpxb.2014.35.01.0079

