SPME和P&T对西瓜汁香气成分萃取条件优化及二者的比较分析
何聪聪,苏柯冉,苏 杭,刘 野,宋焕禄
(北京工商大学食品学院,北京市食品风味化学重点实验室/食品添加剂与配料北京高校工程研究中心,北京 100048)
我国是西瓜生产大国,产量和消费量均居世界首位。鲜榨西瓜汁以其清爽的口感、诱人的颜色以及显著的功能性越来越受到消费者的欢迎,消费量快速增长[1]。但由于西瓜属于热敏性水果,加热灭菌会使其产生强烈的“煮熟味”,严重影响感官品质,因此目前西瓜汁仍未实现工业化生产。目前对西瓜汁的研究仍处于实验室阶段,且加工方式的研究偏多,如采用高压二氧化碳和高压脉冲电场处理来进行杀菌[2-3]。
固相微萃取法(solid phase microextraction,SPME)是20世纪90年代兴起的一项新技术,属于非溶剂型选择性萃取法,具有很高的萃取效率,已被广泛的接受,并大量用于分析研究中[4]。张红艳等人用SPME结合GC-MS优化了其对厚皮甜瓜的萃取效果,结果表明,厚皮甜瓜中以非极性酯类为主,同时还有醛类和醇类,且Carboxen/PDMS的萃取效果较好[5]。Riu-Aumatell等采用 SPME 结合 GC-MS 从梨汁、杏汁和桃汁中分析得到包括酯类、醛类、醇类、萜烯类和酮类在内的97种化合物[5]。吹扫捕集法(purge&trap,P&T)是将气体连续通过样品,将其中的挥发组分萃取后在吸附剂或冷肼中捕集,再进行分析测定,是一种非平衡态的连续萃取,因此又被称为动态顶空浓缩法。1974年,Baller和 Lichtcnherg首次发表了有关吹扫捕集色谱法测定水中挥发性有机物的文章以来,一直受到环境科学与分析化学界的重视,此法也在以后水的研究得到了广泛的应用[6]。苑金鹏等用吹扫捕集法研究了木瓜金宝萝青101中的香气成分,共鉴定出56种化合物,其中包括酯类、醇类、醛类及少量的烃类和其他化合物,且酯类物质占重要的地位[7]。
SPME和P&T两种方法在进行测定时,其萃取效果会受到萃取时间、温度等因素的影响。为了更加充分的萃取西瓜汁香气成分,避免萃取方法及条件对西瓜汁香气分析的影响,本研究优化了SPME和P&T的萃取条件,并比较了两种方法对西瓜汁香气成分的萃取效果,为进一步开展西瓜汁香气活性化合物的分析提供依据。
1 材料与方法
1.1 材料与仪器
京欣西瓜 北京市永辉超市;系列烷烃(C7-C22)色谱纯 西格玛-奥德里奇公司(中国)。
7890A-7000型气质联机 配有EI离子源和NIST2.0数据处理系统,国Agilent公司;ODP2嗅闻检测仪 德国Gerstal公司;DB-5型毛细管柱30m×0.25mm,0.25μm 美国 J&W 公司;HH-1型超级恒温水浴锅 金坛市至翔科教仪器厂;40mL萃取瓶北京玻璃仪器厂;HP1858型榨汁机 飞利浦公司;手动固相微萃取进样器50/30μmDVB/CAR/PDMS、CAR/PDMS、PDMS/DVB 美国Supelco公司;吹扫捕集自动进样装置 美国Teledyne Tekmar公司。
1.2 实验方法
1.2.1 西瓜汁的制备 西瓜经清洗后取瓤,用料理机破碎,过滤后的西瓜汁在4℃冷藏备用。
1.2.2 SPME操作方法 本实验所用的萃取瓶为40mL,准确量取西瓜汁5mL,加盖密封置于水浴锅中,调节平衡时间和吸附时间,然后插入气相色谱进样口250℃条件下解析5min。
将三种纤维按照表1所示的老化时间以及老化温度进行老化,固定萃取时间(30min)、萃取温度(40℃),对西瓜汁样品进行萃取。

表1 萃取纤维操作参数Table 1 Instruction for SPME fibers
平衡时间设定为:5、10、20、30、40 和 50min;萃取温度设定为:30、40、50、60、70 和80℃。
P&T操作方法:该方法所用的萃取瓶为40mL,准确量取西瓜汁5mL,加盖密封,氮吹流量50mL/min,调节平衡温度和吹扫时间,优化出最佳条件。平衡温度设定为:30、40、50、60和 70℃;吹扫时间设定为:10,20,30,40 和 50min。
1.2.3 挥发性香气成分分析 采用 Gas Chromatography-Olfactometry-Mass Spectrometry(GC-O-MS)系统对西瓜汁挥发性香气成分进行分析。GC-O-MS是由7890AGC装置、质谱和嗅闻装置组成。样品经进样口解析后,经GC分离后分别进入质谱检测器和嗅闻检测器,分流比为1∶1。实验人员在嗅闻口记录所闻到的香味特征和强度。
1.2.3.1 GC条件 DB-5毛细管柱(30m×0.25mm,0.25μm),程序升温:初始温度,40℃,保持 3min,以5℃/min升温到200℃,保持0min,再以10℃/min升温到250℃,保持3min。后运行3min。载气(He),恒定流速为1.2mL/min,进样口温度250℃,分流比10∶1。
1.2.3.2 质谱条件 电子轰击(electron impact,EI)离子源,电子能量70eV,传输线温度280℃,离子源温度为230℃,四极杆温度为150℃,质量扫描范围m/z 40~250。
1.2.3.3 嗅觉检测器 接口温度为220℃。检测时为了防止实验员鼻腔干燥通入湿润的空气。用预处理后的样品及标准香味化合物对3位评价员培训后进行实验,评价员在嗅觉检测口记录下闻到气味的时间,香味特性及香气强度。
2 结果与分析
2.1 吹扫捕集法(Purge&Trap)萃取条件的优化
2.1.1 吹扫温度的选择 通过图1中的5组数据的对比可以看出,吹扫平衡的温度从30~70℃过程中,西瓜汁香气成分总峰面积共经历了2个阶段:30~50℃区间,峰面积呈稳定上升区,吸附量随着温度的升高呈现缓慢增加的趋势,这是由于温度的升高,香气物质从基质中析出的速度也增加;50~70℃区间,峰面积呈缓慢下降趋势,这可能由于温度的升高,也加速了一些化合物在纤维头中解析的速度。

图1 P&T不同加热温度对西瓜汁萃取结果的影响Fig.1 Effect of Purge&Trap fiber incubation temperature on watermelon juice
由于西瓜汁是“热敏性”水果,其香气物质易受到温度的影响,随着温度的升高,可能带来香气化合物分解等不利影响。因此,确保SPME纤维吸附更多的香气物质,同时也保持系统分析的稳定性,最终选取了峰面积最大的50℃作为吹扫平衡的最优温度。
2.1.2 吹扫时间的选择 通过图2中五组数据的比较,得到萃取物的总峰面积随时间变化的趋势:10~20min之间,峰面积缓慢增加;20~30min之间,峰面积增加的速度上升,随着时间的延长,在萃取纤维达到饱和之前,香气成分的吸附量也随之增加;在30min时,峰面积达到最大值;30~40min之间,峰面积又有下降的趋势;40~50min之间,峰面积又随时间的延长而增加,这可能是由于基质中挥发性较差的物质也逐渐开始吸附的原因。30~50min之间峰面积有波动的现象,在保证实验效率和实验稳定性的基础上,最终选取了30min作为吹扫的最佳时间。

图2 P&T不同吹扫时间对西瓜汁萃取结果的影响Fig.2 Effect of Purge&Trap fiber incubation on time on watermelon juice
2.2 固相微萃取法萃取条件的优化
2.2.1 萃取纤维的选择 从表2可以看出,西瓜汁中的主要香气化合物多是醇类、烯醛类、醛类、酮类等物质。而且纤维CAR/DVB/PDMS萃取的化合物有32种,PDMD/DVB萃取出22种,CAR/PDMS萃取出21种,则CAR/DVB/PDMS纤维萃取的化合物明显多于PDMD/DVB和CAR/PDMS。
从图3可以看出,CAR/DVB/PDMS比 PDMD/DVB和CAR/PDMS萃取得到的化合物总峰面积数大。PDMD/DVB和CAR/PDMS对烯醇类物质,如顺-3-壬烯醇和反,顺-3,6-壬二烯醇的吸附明显小于CAR/DVB/PDMS对这两种物质的吸附,但是有研究表明,顺-3-壬烯醇和反,顺-3,6-壬二烯醇对西瓜中的青香有较大的贡献度[8]。这可能和纤维图层对物质的选择性有关。PDMD/DVB对相对分子量为50~300的挥发性胺类和硝基芳香类化合物的吸附能力较强,CAR/PDMS对气体和相对分子质量为30~225的小分子吸附能力较强,而CAR/DVB/PDMS则对相对分子质量为40~275的挥发性和半挥发性的香气物质的吸附能力较强[9]。CAR/DVB/PDMS对反-2-壬烯醛的吸附也大于PDMD/DVB和CAR/PDMS对该物质的吸附。此外,因在黄瓜中浓度较高而有“黄瓜醛”之称的反,顺-2,6-壬二烯醛,只在CAR/DVB/PDMS上面有吸附。这些C9系列的醇类和醛类是西瓜汁的重要香气物质[8-10]。因此,综合考虑对萃取西瓜汁香气化合物的种类、数量以及峰面积来看,选择CAR/DVB/PDMS纤维作为西瓜汁前处理较优纤维,被用于优化萃取条件的研究。
2.2.2 萃取时间的选择 通过图4可以看出,在5~50min的萃取时间内,峰面积呈稳定增加趋势,但增加速率逐渐下降,40min后峰面积增加速率接近0,即峰面积几乎不增加,这是由于达到一定的点位后吸附的峰面积上升就会缓慢,直至达到饱和状态,峰面积不再增加。
此前Frank和Majcher等人分别用SPME对奶酪香气和薯片香气的实验结论指出,萃取时间在20min时,固相微萃取有可能没有达到萃取平衡[11-12]。为了减少系统误差,提高分析精度,最终选取了40min为优化萃取时间。
2.2.3 萃取温度的选择 通过图5中6组数据的对比,得到香气化合物总峰面积的变化趋势。可以看出,30~50℃之间峰面积呈稳定增加,在一定的范围内,香气成分的析出增加;在50~60℃之间,峰面积突跃上升,峰面积的增加速率先大后小,最终在60℃时,速率为零,峰面积达到最大值;在60~80℃之间,峰面积又呈下降趋势。在50~60℃范围内,香气化合物的吸附量急剧增加,但增加的速率先大后小,呈不稳定现象。随着温度的升高,峰面积下降,这可能有以下两种解释:一方面,温度升高会引起部分“热敏性”物质的分解和促进香气化合物的解析;另一方面可能是由于随着温度的升高,西瓜汁中的水分蒸发,水蒸气也吸附在萃取头的纤维上,萃取头在气相进样口250℃的高温下解析,水分瞬间化成蒸汽,随载气进入柱子中,影响气相的性能,并且会引起基线上浮。因此,最终选取了峰面积稳定上升的最高温度50℃作为优化的平衡温度。

表2 固相微萃取/气相色谱-质谱分析西瓜汁中的挥发性化合物Table 2 Compounds identified in watermelon juice by SPME/GC-MS

图3 SPME纤维对西瓜汁中香气化合物萃取结果的影响Fig.3 Effect of SPME fibers on flavor compounds in watermelon juice
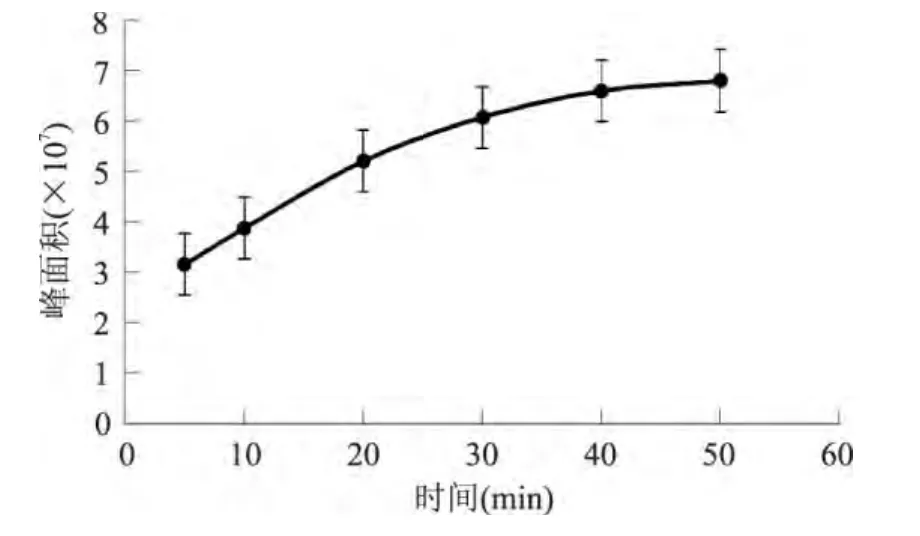
图4 SPME不同萃取时间对西瓜汁萃取结果的影响Fig.4 Effect of SPME fiber incubation on time on watermelon juice
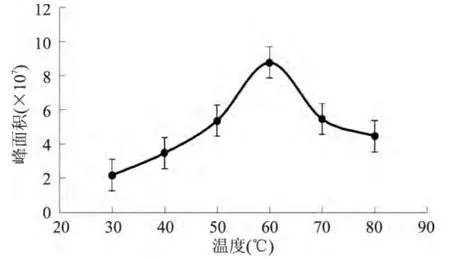
图5 SPME不同萃取温度对西瓜汁萃取结果的影响Fig.5 Effect of SPME fiber incubation temperature on watermelon juice
2.3 固相微萃取法和吹扫捕集法的比较
P&T和SPME是香气化合物分析中两种常用的顶空方法,不同的是前者是动态的,后者是静态的。对于不同的物质,两者有不同的萃取效果,所以对于复杂基质的样品也是一样的。对于众多的食品样品,并不是某一种方法可以通用。对于鲜榨西瓜汁样品,P&T和SPME(萃取条件用上文中优化的条件)的萃取效果如表3。
通过表3可以看出,P&T和SPME检测到的香气化合物包括醇类、醛类、烯醛类、酮类、呋喃等物质。之前有研究表明,西瓜汁中的主要香气是C6和C9系列的醇类和醛类(包含烯醛类和醛类)[8,10,13]。P&T检测到28种香气化合物,SPME检测到37种香气物质。此外,P&T法检测到顺-3-壬烯醇(清香、动物脂味)和反-2-壬烯醛(瓜味、清香)的峰面积比SPME的低很多,P&T中的6-甲基-5-庚烯-2-酮的峰面积几乎是SPME中的一半。但P&T中的壬醛、反,顺-3,6-壬二烯醇和己醛的峰面积略高于SPME的。两种方法对醇类、烯醛类、醛类、酮类以及其他化合物萃取的峰面积之和的对比见图6。
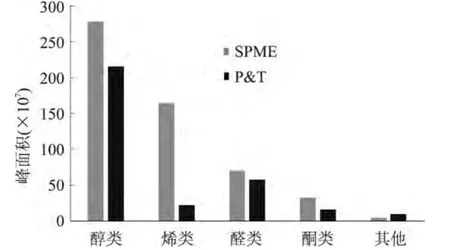
图6 两种前处理方法分析得到的西瓜汁中香气化合物的种类和百分含量Fig.6 The categories and percentages of the aroma volatiles in the watermelon juice identified using two different pretreatment methods
通过图6可以看出,SPME对西瓜汁中的香气物质的萃取效果优于P&T,尤其是烯醛类的峰面积,SPME明显高于P&T。这可能与P&T中的吸附材料有关。因此,从二者检测到香气化合物的种类、数量以及峰面积等综合考虑,SPME更合适用于西瓜汁香气成分的检测。
3 结论
本文对西瓜汁前处理方法中的SPME和P&T的萃取效果进行了优化,为后续西瓜汁香气成分的鉴定奠定了基础。该研究结果表明,西瓜汁醛类(包含烯醛和醛)和醇类,同时还有酮类和呋喃等物质。纤维CAR/DVB/PDMS对萃取的香气化合物数量较多,相对含量最高,且对特征香气化合物的吸附能力强,特征香气化合物的相对含量和峰面积也最高。PDMD/DVB和CAR/PDMS对烯醛和烯醇的吸附能力较弱,峰面积较低,其中PDMD/DVB对醛类的吸附能力也较弱。同时,通过对两种方法萃取效果的比较看出,P&T对烯醛的吸附较弱,且该类化合物对西瓜汁的香气具有重要作用,故SPME对西瓜汁中香气物质的吸附由于P&T。
[1]李菁.西瓜清汁动力非热杀菌工艺研究[D].北京:中国农业大学食品科学与营养工程学院,2006.
[2]刘野,赵晓燕,邹磊,等.高压二氧化碳对鲜榨西瓜汁杀菌效果和风味的影响[J].食品科学,2012,33(03):82-88.
[3]Igual M,García- Martínez E,Camacho M M,et al.Effect of thermal treatment and storage on the stability of organic acids and the functional value of grapefruit juice[J].Food Chemistry,2010,118(2):291-299.
[4]Belardi R P,Pawliszyn J B.The application of chemically modified fused silica fibers in the extraction of organics from water matrix samples and their rapid transfer to capillary columns[J].Water Quality Research Journal of Canada,1989,24(1):179-191.
[5]张红艳,王伟娟,别之龙.三种固相微萃取头对厚皮甜瓜果汁香气成分萃取效果分析[J].热带亚热带植物学报,2012,19(6):571-575.
[6]Bellar T A,Lichtenberg J J.Determining Volatile Organics at Microgram-per-Litre-Levels by Gas Chromatography[J].Journal American Water Works Association,1974,66(12):739-744.
[7]苑金鹏,李圣波,王岱杰,等.吹扫捕集-GC-MS法测定木瓜金宝萝青101中的香气成分[J].光谱实验室,2009,25(6):1257-1260.
[8]Pino J A,Marbot R,Aguero J.Volatile Components of Watermelon(Citrullus Ianatus[Thunb.]Matsum.et Nakai)Fruit[J].Journal of Essential Oil Research,2003,15(6):379-380.
[9]Panliszyn J.Applications of solid phase microextraction[M].Cambridge(UK):The Royal Society of Chemistry,1999,60-67.
[10]TANG Xiaowei,HE Hongju,LIU Ye,et al.Identification of aroma compounds in watermelon juice by SPME-GC-MS[J].InternationalSociety forHorticulturalScience,2012,944:183-191.
[11]Frank D C,Owen C M,Patterson J.Solid phase microextraction(SPME)combined with gas-chromatography and olfactometry-mass spectrometry for characterization of cheese aroma compounds[J].LWT-Food Science and Technology,2004,37(2):139-154.
[12]Majcher M,Jeleń H H.Comparison of suitability of SPME,SAFE and SDE methods for isolation of flavor compounds from extruded potato snacks[J].Journal of Food Composition and Analysis,2009,22(6):606-612.
[13]Beaulieu J C,Lea J M.Characterization and semiquantitative analysis of volatiles in seedless watermelon varieties using solidphase microextraction[J].Journal of Agricultural and Food Chemistry,2006,54(20):7789-7793.

