紫外-可见分光光度法测定火龙果花中总黄酮的含量
罗小艳,郭璇华
(1.华南理工大学化学与化工学院,广东广州510640;2.广东省绿色化学产品技术重点实验室,广东广州510640)
紫外-可见分光光度法测定火龙果花中总黄酮的含量
罗小艳1,2,郭璇华1
(1.华南理工大学化学与化工学院,广东广州510640;2.广东省绿色化学产品技术重点实验室,广东广州510640)
研究火龙果花中黄酮类化合物的分离提取和测定方法。在单因素实验的基础上,利用正交实验对分离提取条件进行优化。结果表明,最佳分离提取条件为:乙醇浓度为70%,固液比为1∶40(g/mL),提取温度为75℃,提取时间为2 h;以芦丁为标准品,采用AlCl3显色-分光光度法测得火龙果花中总黄酮含量为0.747%,样品平均回收率为99.51%,RSD值为2.06%(n=5)。
火龙果花;总黄酮;紫外-可见分光光度法;AlCl3显色法
火龙果(pitaya)又名红龙果、仙蜜果,是蔓藤类仙人掌科(cactaceae)量天尺属(又称三角柱属)(Hylocereusundatus)植物,原产于巴西、墨西哥等中美洲热带沙漠地区,在热带美洲、西印度群岛及其它热带地区均有分布,为多年生攀缘性肉质热带作物[1-2]。火龙果花有光洁巨大的花朵,花冠直径25 cm,全长45 cm,单花重达600 g~800 g,被称为“大花王”;它可以生食或作为煲汤原料,营养价值很高,具有降压、解毒、润肺、明目、养颜、延缓衰老等多种功效。
对火龙果全花和花不同部位的营养成分分析已有报道[3-4],结果表明火龙果花营养丰富,富含糖、有机酸、膳食纤维、蛋白质和多种维生素及人体需要的钾、钙、镁、磷等矿质元素;同时本课题组分析了火龙果花和茎中的化学成分[5-6],对火龙果茎中总黄酮含量也进行了报道[7]。而王晓波等[8]对火龙果皮总黄酮对油脂抗氧化作用进行了研究;易衍等[9]对与火龙果花同种属植物霸王花中的黄酮类成分进行了研究,从霸王花的乙醇提取物中分离并鉴定了13种黄酮醇及其苷类化合物,但是关于火龙果花中黄酮类化合物的提取检测研究未见报道,因此分析火龙果花中总黄酮含量对火龙果花的综合开发利用很有必要,以期为其生物活性评价及药理作用提供参考。
黄酮类化合物是在植物中分布最广的一类物质,几乎每种植物体内都有且存在于植物的所有部分——根、心材、边材、树皮、叶、果实和花中,在花、果实、叶中较多。目前国际上对黄酮类化合物的研究开发十分活跃,分离出来的黄酮类化合物有多种药理作用,具有多种多样的生理活性,如抗氧化、酶抑制剂、消除自由基,抗癌以及抑制肿瘤,改善心血管疾患,抗过敏及抗炎,抗微生物活性(抗真菌以及抗病毒活性)等作用[10]。所以了解火龙果花中的黄酮类化合物含量对于进一步开发利用其资源有很大的意义。
1 材料与仪器
1.1 材料与试剂
火龙果花:市售袋装干货制品。用前将火龙果干花适当剪碎,在食物搅拌机上粉碎,过20目筛,置于干燥器中备用;芦丁(C27H36O16·3H2O,分子量为664.57,BR):国药集团化学试剂有限公司;石油醚(沸程:30℃~60℃)、无水乙醇、NaNO2、NaOH、Al(NO3)3、AlCl3均为分析纯。
芦丁标准溶液(0.343 0mg/mL):准确称取在105℃干燥至恒重的芦丁标准样0.068 6 g,加适量无水乙醇溶解,稍加热溶解,冷却后移入200mL的容量瓶,用50%乙醇定容。
1.2 仪器
DG/20-002台式干燥箱:重庆试验设备厂;BS124S精密电子天平(感量0.1mg):德国赛多利斯天平公司;RE-52CS型旋转蒸发器:上海亚荣生化仪器厂;U3010紫外可见分光光度计:日本HITACHI公司;索氏提取装置。

式中:c为由回归方程计算得到的待测液的浓度,(10-2mg/mL);V1为提取液体积,mL;V2为稀释后提取液体积,mL;V3为移取样液的体积,mL;W为火龙果干花的重量,g。
2 方法
2.1 火龙果花样品的预处理
将火龙果干花用滤纸包好,放入索氏提取器中用石油醚加热提取6 h后置于通风处晾干溶剂。
2.2 火龙果花中总黄酮的提取
称取1.50 g经石油醚抽提后的火龙果花干品,置于100mL圆底烧瓶中,按不同的料液比加入一定浓度的乙醇溶液,在一定的温度下加热回流提取一定的时间,将提取液过滤后定容于100mL。
2.3 标准曲线的制作
准确移取0、0.40、0.80、1.20、1.60、2.00、2.20mL芦丁标准溶液于7个25mL容量瓶中,各加入3.00mL 1%AlCl3溶液,用10%的乙醇定容,显色20min后在417nm处测定吸光度,同时以未加标准芦丁的溶液作空白参比;以吸光度A为纵坐标,芦丁浓度c(10-2mg/mL)为横坐标作图,回归方程为:A=0.277 3c+0.0678 4,R=0.999 3。
2.4 样品中总黄酮含量的测定
取4.00mL样液于25mL容量瓶中,按照测定芦丁标准液吸光度的步骤,同时做试剂空白,以试剂空白为对照,于417 nm处测定吸光度A;计算火龙果花中总黄酮的含量(%),重复5次,取平均值。按下列公式计算:
3 结果与分析
3.1 显色方法的选择
采用两种显色方法:在碱性条件下的NaNO2-Al(NO3)3-NaOH显色法和在酸性条件下的AlCl3显色法分别试验。两种方法显色机理不同,前者显色后溶液为橙红色,而AlCl3显色法得黄色溶液。在200 nm~600 nm的波长范围内进行扫描分别得图谱1和2(见图1、图2)。

图1 NaNO2-A l(NO3)3-NaOH显色法的光谱图Fig.1 Spectrogram of NaNO2-Al(NO3)3-NaOH coloration

图2 AlCl3显色法的光谱图Fig.2 Spectrogram of A lCl3coloration
由图2可见,芦丁标准品经AlCl3显色后在417nm有较明显的吸收峰,而NaNO2-Al(NO3)3-NaOH显色法中芦丁与Al3+配合物的峰在502.5 nm左右,但该处的吸收峰相对于AlCl3显色法较弱。考虑到火龙果花的黄酮提取液样品中可能含有较多的杂质(如花青素、鞣酸及其它酚类成分),且在碱性条件下,有些非黄酮类物质会在502.5 nm附近有最大或较强吸收[11],因而选用AlCl3显色法测定火龙果花中黄酮类化合物具有更好的专属性。
3.2 溶剂的选择及样品预处理
黄酮类物质水溶性较差,醇溶性较好,常用甲醇和乙醇作提取溶剂,但考虑到甲醇的毒性,而且乙醇不仅可以去除一部分亲水性蛋白质,果胶及其他水溶性杂质,而且毒性小,价格低廉,可以回收利用,因此采用乙醇作为提取溶剂。但直接将火龙果干花用乙醇提取,会不可避免地将脂溶性色素一起提取出来,为了消除叶绿素等物质的影响,本文采用30℃~60℃沸程石油醚索氏提取6 h的方法进行简单的提纯,排除部分干扰物质。样品经石油醚脱脂、脱色脱蜡处理可提高总黄酮的提取率。这可能是由于蜡质的破坏及脂类的消除,有利于极性提取剂的渗透和黄酮类物质的渗出。
3.3 正交试验
在单因素试验的基础上,选取影响火龙果花总黄酮提取效果各因素中有意义的水平做正交试验,选择乙醇的浓度(A)、料液比(B)、提取温度(C)、提取时间(D)4个因素,采用四因素三水平L9(34)正交试验表安排试验,确定最佳提取工艺,因素水平见表1,试验分析结果见表2,方差分析结果见表3。

表1 L9(34)正交试验因素水平设计Table1 Factorsand levels for L9(34)orthogonalarray design

表2 正交试验结果分析Table2 Resu ltsof orthogonalexperiments
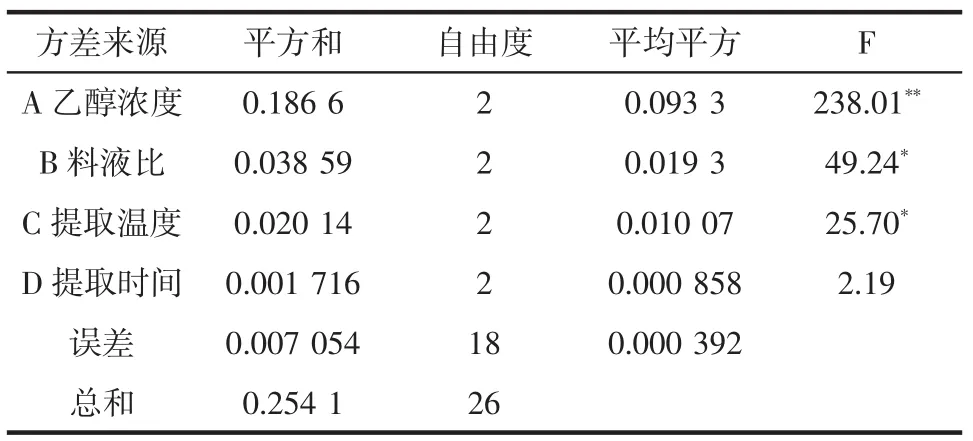
表3 方差分析表Table3 Resultsof varianceanalysis
查表得F0.01(2,18)=6.01,F0.05(2,18)=3.55。因素A高度显著,因素B、C显著,因素D不显著。由表2极差分析和表3方差分析结果可知,影响火龙果花中黄酮提取的各因素主次顺序为:乙醇浓度>料液比>提取温度>提取时间。从平均值可见因素A和B的第3水平较好,C的第一水平较好,D因素的3个水平都差不多。从节约能源出发取提取时间较短的D1,于是选出来的最优提取条件是A3B3C1D1。即火龙果花中总黄酮的最佳提取分离条件是:乙醇浓度为70%,固液比为1∶40(g/mL),提取温度为75℃,提取时间为2 h。
3.4 火龙果花中总黄酮含量的测定
在最佳提取条件下,用AlCl3显色法测得火龙果花中总黄酮含量为0.747%,结果如表4所示。

表4 样品测定结果Table4 Determ ination resultsof sam ples
3.5 回收率实验
称取已知含量经石油醚抽提后的火龙果花干品5份,每份1.5 g(准确至0.001 g),分别加入10.00mL芦丁标准溶液,按照前述操作进行处理,测定吸光度,计算回收率,结果见表5。
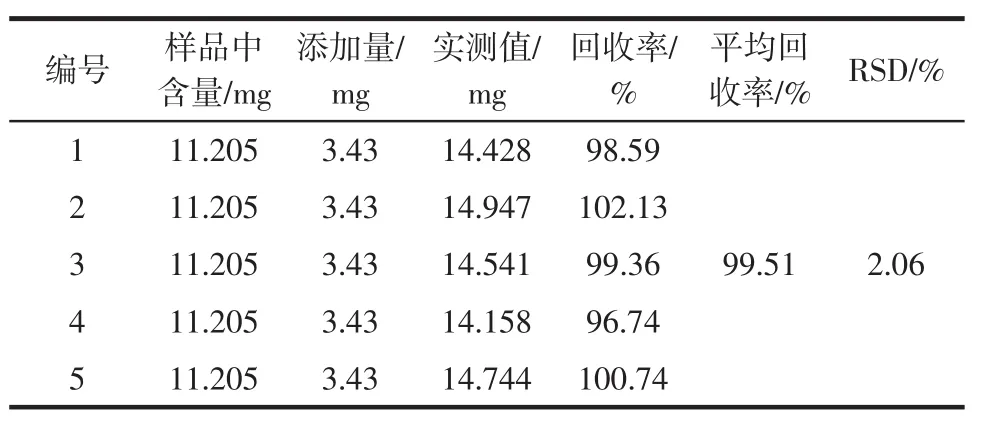
表5 样品加标回收率实验结果Table5 Determ ination resultsof recovery in samples
由结果可知,该方法准确度良好。
4 小结
实验结果表明:火龙果花中黄酮类化合物的最佳分离提取条件为:乙醇浓度为70%,固液比为1∶40(g/mL),提取温度为75℃,提取时间为2 h。用AlCl3显色法测得火龙果花中总黄酮的含量为0.747%,其含量是火龙果茎中总黄酮含量(0.494%)的1.5倍多,样品平均回收率为99.51%,RSD值为2.06%。
[1]许伟东,廖剑锹,刘加健,等.火龙果引种初报[J].中国南方果树, 2002,31(1):33-34
[2]Nerd A,Sitrit Y,Kaushik R A,etal.High summer temperatures inhibit flowering in vine pitaya crops(Hylocereus spp.)[J].Scientia Horticulturae,2002(96):343-350
[3]罗小艳,郭璇华.火龙果花的营养成分分析[J].食品研究与开发, 2008,29(1):147-149
[4]蔡永强,郑伟,王彬.火龙果花营养成分分析[J].西南农业学报, 2010,23(1):283-286
[5]郭璇华,罗小艳.GC-MS联用分析火龙果花提取液的化学成分[J].分析试验室,2008,27(12):84-87
[6]郭璇华,周丽屏.火龙果茎化学成分的GC-MS/ICP-MS分析[J].分析试验室,2007,26(11):104-107
[7]郭璇华,戴文娟,梁博,等.分光光度法测定火龙果茎中黄酮类化合物的含量[J].中国食品添加剂,2010(2):210-213
[8]王晓波,钟婵君,刘冬英,等.火龙果皮总黄酮对油脂抗氧化作用的研究[J].食品研究与开发,2012,33(3):19-23
[9]易衍,巫鑫,王英,等.霸王花黄酮类成分研究[J]中草药,2011,34(5): 712-716
[10]唐传核.植物生物活性物质[M].北京:化学工业出版社,2005:34-35
[11]郭亚健,范莉,王晓强,等.关于NaNO2-Al(NO3)3-NaOH比色法测定总黄酮方法的探讨[J].药物分析杂志,2002,22(2):97-99
Determ ination of Total Flavonoids in Pitaya Flower by UV-Vis Spectrophotom etry
LUOXiao-yan1,2,GUOXuan-hua1
(1.School of Chemistry and Chemical Engineering,South China University of Technology,Guangzhou 510640,Guangdong,China;2.The Guangdong Provincial Key Lab of Green Chemical Product Technology,Guangzhou 510640,Guangdong,China)
In thispaper,theextractionand separationof the total flavones from pitaya flowerwerestudied.Based on single-factorexperiment,the extraction processconditionswereoptimized by using orthogonal test.Results showed thattheoptimalextraction conditionswereas follows:ethanolconcentration70%,ratioof rawmaterial to ethanolsolution1∶40(g/mL),extraction temperature75℃and extraction time2 h.Under theabove conditions,the contentof total flavones from dry pitaya flowerwas0.747%.Theaverage recovery rateand RSDwere99.51% and 2.06%respectively(n=5).
pitaya flower;total flavonoids;UV-Visspectrophotometry;AlCl3coloration
2013-05-20
10.3969/j.issn.1005-6521.2014.23.029
罗小艳(1982—),女(汉),助理实验师,硕士,研究方向:食品与天然物分析。

