合成聚丁二酸丁二醇酯的热力学分析
马 莹,杨 琴,蒋文伟
(1. 四川大学 化学工程学院,四川 成都 610065;2. 成都惠恩精细化工有限责任公司,四川 成都 610000)
合成聚丁二酸丁二醇酯的热力学分析
马 莹1,杨 琴2,蒋文伟1
(1. 四川大学 化学工程学院,四川 成都 610065;2. 成都惠恩精细化工有限责任公司,四川 成都 610000)
采用基团贡献法分别对丁二醇与丁二酸(反应(1))、丁二醇与丁二酸酐(反应(2))和丁二醇与丁二酸二甲酯(反应(3))合成聚丁二酸丁二醇酯的反应进行了热力学计算与分析,得到了298.15~498.15 K内的反应摩尔焓变、摩尔Gibbs自由能变以及平衡常数与温度的关系。分析结果表明,反应(1)~(3)均可自发进行;反应(2)放热,反应(1)和(3)在液态时放热,在气态时吸热;反应(1)~(3)的平衡常数较大,表明反应进行的可行性;反应(2)的摩尔Gibbs自由能变更小,平衡常数更大,表明该反应更容易发生。
聚丁二酸丁二醇酯;丁二醇;丁二酸;热力学分析;基团贡献法
聚丁二酸丁二醇酯(PBS)是一种半晶质线型的可生物降解高分子材料,广泛应用于农业、林业、渔业、医药等领域,工业上多采用丁二醇(BDO)与丁二酸经逐步缩聚而得。目前,BDO存在降解速率慢、结晶度高以及合成条件苛刻等缺陷[1-2]。因此,选择活性更高的反应原料、更温和的反应条件以及更高效的催化剂等成为合成BDO亟待解决的问题。
Kricheldorf[3]以丁二酸酐和BDO为单体、铋盐为催化剂,在低温条件下合成了一定相对分子质量的PBS。王中仁等[4]以钛酸四正丁酯-磷酸铝催化丁二酸和BDO,合成了结晶性能改善的PBS。张昌辉等[5]考察了各催化剂对溶液-熔融结合法合成PBS反应的催化性能,结果发现SnCl2/P-TS复合催化剂的催化效果最佳。经过前人不断的努力,纯PBS的性能在一定程度上得到了改善,但瓶颈依然存在。热力学分析是化学反应进行的可能性和反应程度的重要判据,可为反应原料、操作条件、催化剂等的选择提供理论指导[6],而有关合成PBS反应体系的热力学分析鲜见报道。
本工作以丁二酸、丁二酸酐、丁二酸二甲酯(DMS)与BDO合成PBS的反应物系为研究对象,应用基团贡献法对物系中缺乏的热力学数据进行估算;对各反应摩尔焓变(ΔrHm)、摩尔Gibbs自由能变(ΔrGm)、平衡常数(K)与温度的关系进行对比分析,以期对实验研究和工业化生产提供一定的参考,并为相关物质提供新的热力学基础数据。
1 热力学数据的估算
BDO与丁二酸、丁二酸酐、DMS合成PBS反应的化学计量式见式(1)~(3),为便于计算,选择化学计量数n=5。

1.1 气态条件下的摩尔生成焓和熵的估算
采用Benson基团贡献法估算各物质在标准状态下呈理想气态时的标准摩尔生成焓(ΔfHm⊖(g))和标准摩尔熵(Sm⊖(g)),计算式见式(4)~(5)。计算中涉及到的Benson基团贡献法的基团贡献值见表1。计算得到的各物质的ΔfHm⊖(g)和Sm⊖(g)见表2。
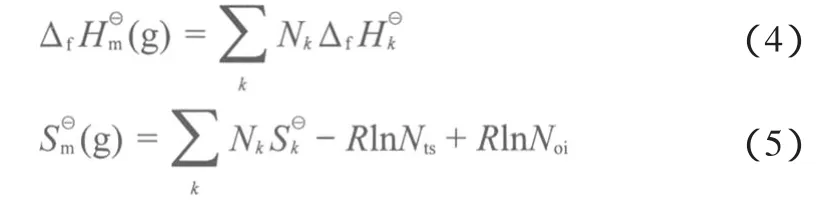
式中,Nk为k型基团的数目;Nts为分子对称数;Noi为对映异构体的数目。丁二酸、丁二酸酐、DMS、PBS的Nts分别为2,2,18,1;Noi均为1。
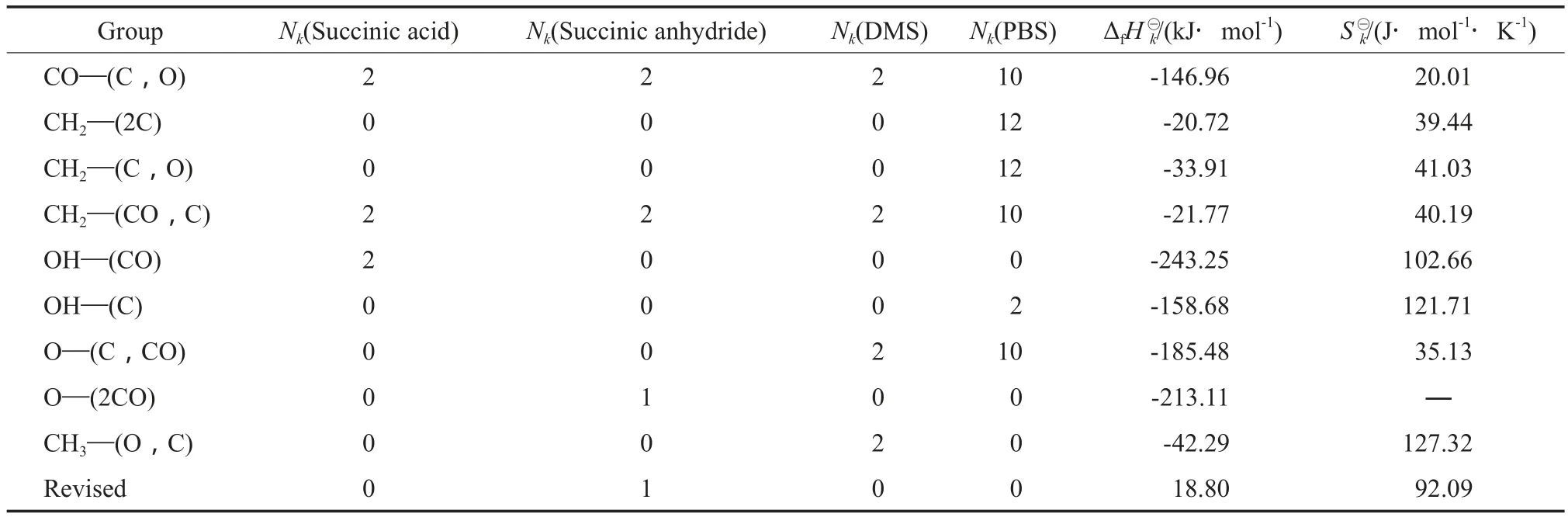
表1 Benson基团贡献法的基团贡献值[7]Table 1 Group contribution values of Benson’s method[7]
表2 各物质的和Table 2 Standard molar enthalpy of formation() and standard molar entropy() of compounds

表2 各物质的和Table 2 Standard molar enthalpy of formation() and standard molar entropy() of compounds
CompoundΔfH⊖m(g)/(kJ·mol-1)S⊖m(g)/(J·mol-1·K-1) Succinic acid -823.96319.96 Succinic anhydride -527.90[7]206.73 DMS -793.00421.07 Butanediol(BDO) -428.70[7]404.36 PBS-4 515.02 2 162.36 Water[7]-241.82188.83 Methanol[7]-201.50239.88
1.2 液态条件下组分热力学数据估算
反应物系中的各物质均以液态形式参与酯化反应,故需对其进行液相热力学估算,液态标准摩尔生成焓(ΔfHm⊖(l))和标准摩尔熵()的计算式见式(6)~(7)。

1.2.1 标准摩尔蒸发焓的估算
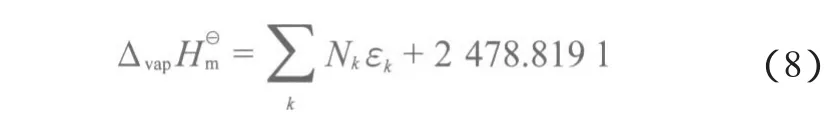
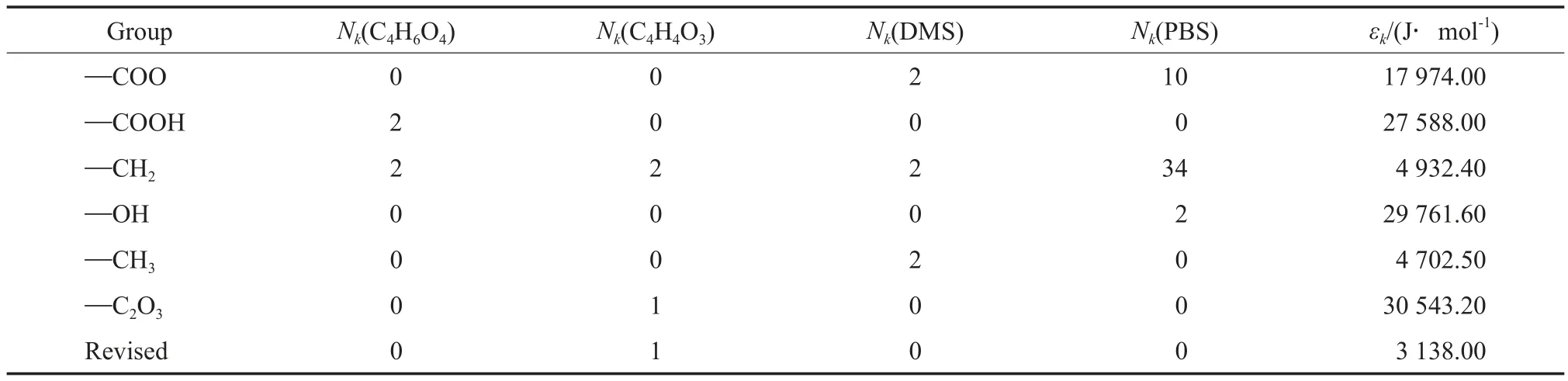
表3 Fedors基团贡献法的基团贡献值[7]Table 3 Group contribution values of Fedors’ method[7]
1.2.2 标准摩尔蒸发熵的估算
采用 Ma-Zhao基团贡献法估算各物质的标准摩尔蒸发熵(),其基团贡献值见表4。由式(9)计算得到丁二酸、丁二酸酐、DMS和PBS的分别为42.61, 129.37,98.18,230.08 J/(mol·K)。

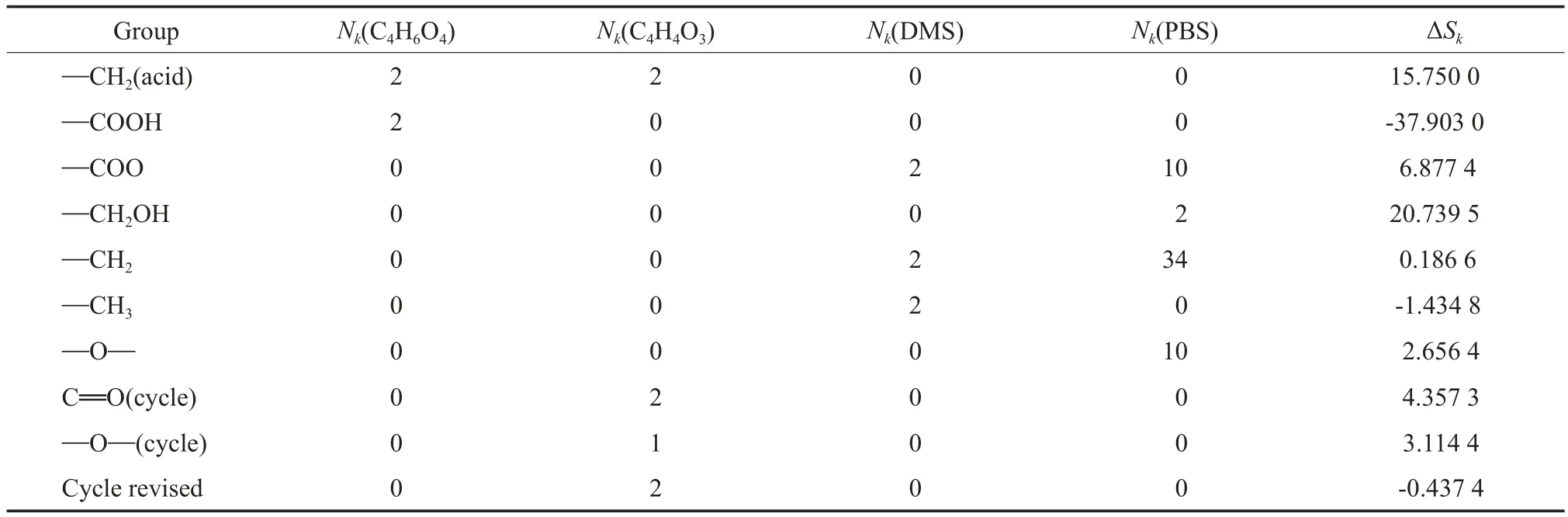
表4 Ma-Zhao基团贡献法的基团贡献值[8]Table 4 Group contribution values of Ma-Zhao’s method[8]
1.2.3 液态摩尔定压热容的估算
采用Rozicka-Domalski基团贡献法[9]估算各组分的液态摩尔定压热容(Cpl),Rozicka-Domalski基团贡献法的基团贡献值见表5。Cpl由式(10)计算,计算结果见表6。
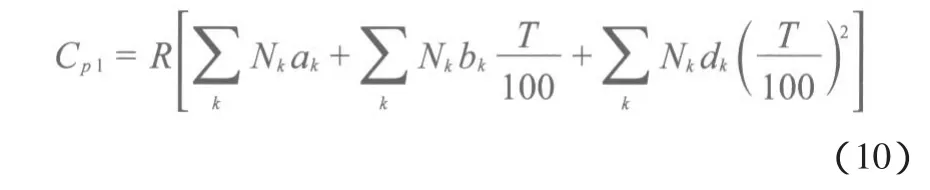
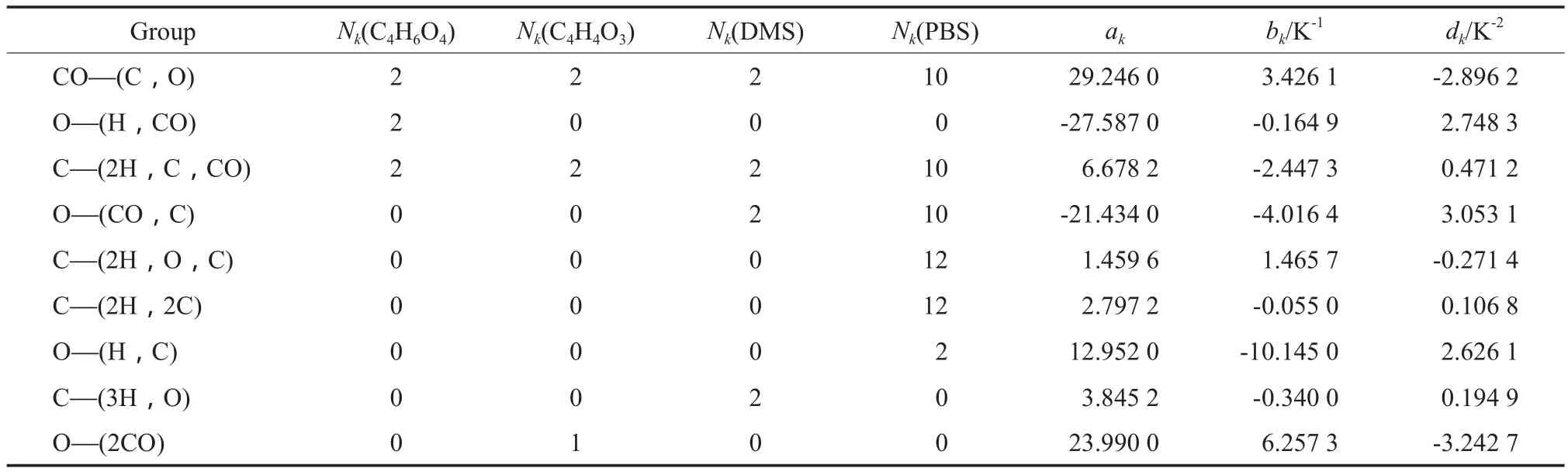
表5 Rozicka-Domalski基团贡献法的基团贡献值[9]Table 5 Group contribution values of Rozicka-Domalski’s method[9]
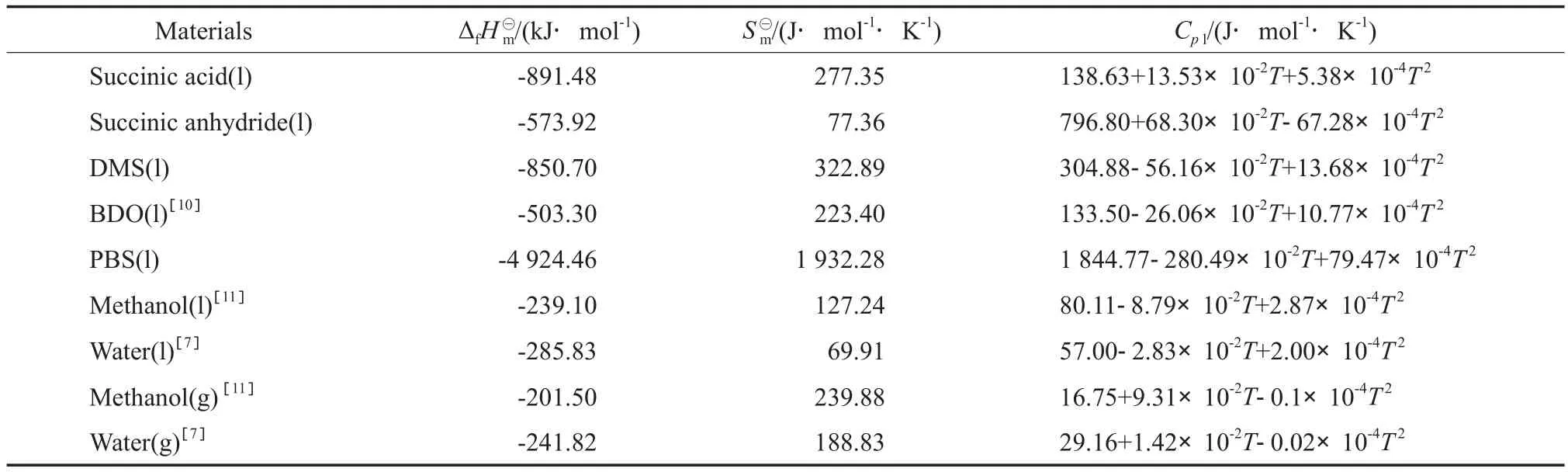
表6 各物质的热力学数据Table 6 Thermodynamic data of the compounds
2 热力学数据的计算与分析
分析BDO与丁二酸、丁二酸酐、DMS的反应,生成水(373.15 K,0.1 MPa)和甲醇(337.7 K,0.1 MPa)的反应存在着液相和气相之别,所以对ΔrHm,ΔrGm,K随温度的变化进行分段描述。
2.1 标态下反应的Gibbs自由能变和平衡常数

将表6中各物质的热力学数据代入式(11)~(14)中,并结合各反应的化学计量式,即可得液相和气相条件下反应式(1)~(3)的结果见表7。

表7 合成PBS反应物系的热力学数据Table 7 Thermodynamic data of the three reaction systems for the synthesis of PBS
2.2 反应焓变与温度的关系
ΔrHm与温度的关系可由Kirchhoff方程得到。首先,根据表6中Cpl~T的关系,结合反应(1)~(3)的化学计量式,可得到各反应的热容(ΔrCp)与温度的关系式,之后代入式(15),即得ΔrHm~T的关系,见图1。由图1可见,反应(2)的ΔrHm在298.15~498.15 K内均小于零,说明BDO与丁二酸酐的反应放热。从热力学角度分析,升高温度对正向反应的进行不利。
在小于水、甲醇的相变点温度范围内,反应(1)和(3)的ΔrHm小于零,体系放热;而在气相温度范围内,反应(1)和(3)的ΔrHm均大于零,为吸热反应。实际上反应(1)和(3)通常是在水、甲醇沸点以上进行的,因此,从热力学角度分析,升高温度有利于正向反应的进行。
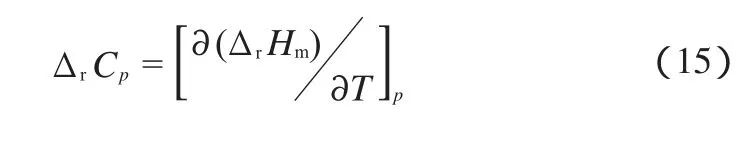
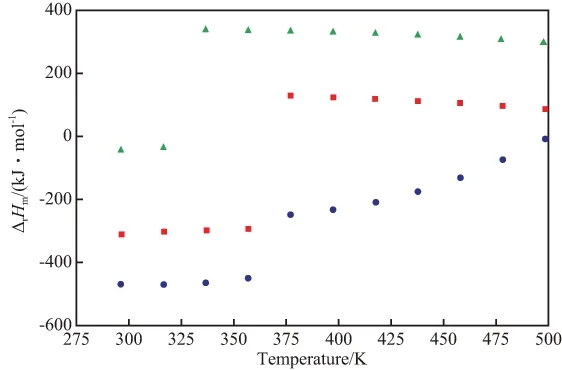
图1 ΔrHm~T的关系Fig.1 Relationships between of the enthalpy changes of the reactions(ΔrHm) and temperature.
2.3 Gibbs自由能变与温度的关系
将各反应的ΔrHm~T的关系式代入到Gibbs-Helmholtz方程,并结合反应的ΔrGm⊖,即得ΔrGm与温度的关系,见图2。由图2可见,反应(1)~(3)的ΔrGm均小于零,说明反应(1)~(3)均可自发进行;反应(1)和(3)在相变点之前,ΔrGm随温度的升高而增大,在相变点之后的温度范围内,则出现负增长,说明这两个反应的ΔrGm对温度的敏感性很大。反应(2)对温度的敏感性较小。整体来说,反应(2)比反应(1)和(3)更容易进行。
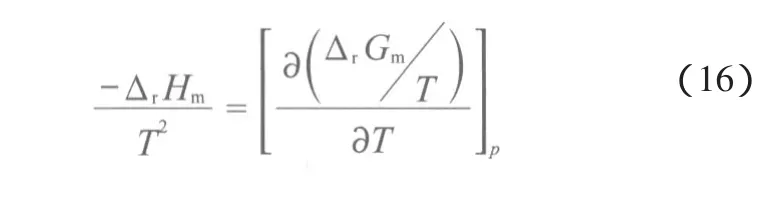
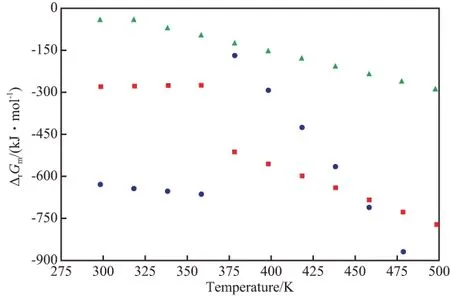
图2 ΔrGm~T的关系Fig.2 Relationships between the Gibbs free energy changes of the reactions(ΔrGm) and temperature.
2.4 平衡常数与温度的关系
根据各反应的ΔrGm~T关系,结合式(17),即可得K与温度的关系,见图3。由图3可看出,反应(1)~(3)的K较大,表明其反应进行的可行性。其中,反应(1)和(3)的K分别在水、甲醇的相变点之前随温度的升高而减小,但无数量级差别;在相变点之后,则随温度的升高而增大,表明升温对反应有利;在298.15~498.15 K内,反应(2)的K均随温度的升高而增大,但在低温段整体较大。


图3 K~T的关系Fig.3 Relationships between the equilibrium constants(K) and temperature.
3 结论
1)对BDO与丁二酸、丁二酸酐、DMS反应生成PBS的物系利用Benson,Fedors,Ma-Zhao、Rozicka-Domalski等基团贡献法估算了丁二酸、丁二酸酐、DMS以及PBS的和值。
2)在298.15~498.15 K内,反应(1)~(3)的ΔrGm均为负值,反应可自发进行;反应(2)的ΔrHm小于零,为放热反应,反应(1)和(3)在水、甲醇的沸点以下的温度范围内为放热反应,在水、甲醇沸点以上的温度范围内为吸热反应。
3)反应(1)和(3)的K分别在水、甲醇的相变点之前随温度的升高而减小,在相变点之后,则随温度的升高而增大;在298.15~498.15 K内,反应(2)的K均随温度的升高而增大。
4)反应(2)的ΔrGm最小,可自发进行的程度更大;反应(2)的ΔrHm始终小于零,且在低温时K更大,适宜低温反应。
符 号 说 明


[1]Xu Jun,Guo Baohua. Microbial Succinic Acid,Its Polymer Poly(Butylene Succinate),and Applications[J]. Microbiology Monographs,2010,14:347 - 389.
[2]王宁,于九皋,马骁飞. 生物降解热塑性材料的研究进展[J]. 石油化工,2007,36(1):1 - 8.
[3]Kricheldorf H R. Syntheses of Biodegradable and Biocompatible Polymers by Means of Bismuth Catalysts[J]. Chem Rev,2009,109(11):5579 - 5594.
[4]王中仁,王洪涛,祝桂香. 钛酸正四丁酯-磷酸铝催化合成聚丁二酸丁二醇酯的研究[J]. 石油化工,2013,42(11):1278 - 1282.
[5]张昌辉,张敏,赵霞. 高相对分子质量可生物降解聚丁二酸丁二醇酯的合成[J]. 石油化工,2009,38(2):185 - 189.
[6]张红彦,马沛生. 临界参数的估算方法[J]. 化学工业与工程,2000,17(3):149 - 156.
[7]马沛生. 化工数据[M]. 北京:中国石化出版社,2003:144 - 156.
[8]刘光启,马连湘,刘杰. 化学化工物性数据手册[M]. 北京:化学工业出版社,2002:425 - 493.
[9]张宇英,张克武. 分子热力学性质手册-计算方法与最新实验数据[M]. 北京:化学工业出版社,2009:31 - 41.
[10]王丽苹,萧斌,王公应. 碳酸酯与1,4-丁二醇酯交换合成聚碳酸酯二醇的热力学分析[J]. 石油化工,2009,38(9):961 - 966.
[11]张继龙,赵志仝,乔燕. 酯交换制油酸甲酯的基团贡献法热力学分析[J]. 化工学报,2012,63(6):1684 - 1691.
(编辑 李治泉)
Thermodynamic Analysis on Synthesis of Poly(Butylene Succinate)
Ma Ying1,Yang Qin2,Jiang Wenwei1
(1. Department of Chemical Engineering,Sichuan University,Chengdu Sichuan 610065,China;2. Chengdu Huien Fine Chemical Co.,Ltd. ,Chengdu Sichuan 610000,China)
Thermodynamic analysis for the synthesis of poly(butylene succinate) from 1,4-butanediol and succinic acid (reaction (1)),1,4-butanediol and succinic anhydride (reaction (2)),or 1,4-butanediol and dimethyl succinate(reaction (3)) were conducted by group contribution methods. The relationships between the molar enthalpy changes,molar Gibbs free energy changes and equilibrium constants of the reactions,and temperature in the range of 298.15-498.15 K were established. The results showed that reactions (1)-(3) could take place spontaneously;reaction (2) was exothermic,and reactions (1),(3) were exothermic in liquid state and endothermic in gas state;all the equilibrium constants of reaction (1)-(3) were large,which indicated that the reactions were feasible. Moreover,reaction (2) was the easiest due to its small molar Gibbs free energy change and large equilibrium constant.
poly(butylene succinate);butanediol;succinic acid;thermodynamic analysis;group contribution
1000 - 8144(2014)03 - 0293 - 06
TQ 013.1
A
2013 - 09 - 13;[修改稿日期]2013 - 12 - 24。
马莹(1989—),女,甘肃省华亭县人,硕士生,电话 13699483479,电邮 maying07huagong@163.com。联系人:蒋文伟,电话 13608017506,电邮 jdw0958@sina.com。

