DAPK1在弥漫性轴索损伤后大鼠脑组织中的表达及其与神经元凋亡的关系
黄廷钦,宋锦宁,李 宇,胡明军,赵雅慧,郑锋伟,郭小叶,金 涛
(西安交通大学医学院第一附属医院神经外科,陕西西安 710061)
◇专题研究◇
DAPK1在弥漫性轴索损伤后大鼠脑组织中的表达及其与神经元凋亡的关系
黄廷钦,宋锦宁,李 宇,胡明军,赵雅慧,郑锋伟,郭小叶,金 涛
(西安交通大学医学院第一附属医院神经外科,陕西西安 710061)
目的 探讨大鼠弥漫性轴索损伤(diffuse axonal injury, DAI)后神经元凋亡及死亡相关蛋白激酶1(DAPK1)表达变化,为临床治疗提供新的靶点及治疗时间窗。方法 40只SD成年雄性大鼠随机分为对照组(n=8)和DAI组(n=32)。DAI组选用大鼠头颅瞬间旋转装置制备DAI模型,分为6 h、24 h、72 h、7 d组共4个亚组(n=8)。各组在造模前及处死前采用改良神经功能缺损评分(mNSS)对大鼠神经功能进行评分;同时将各组大鼠一半用于Western bolt检测大鼠胼胝体、脑干组织内DAPK1表达情况;另一半用于TUNEL检测大鼠脑组织内神经元细胞凋亡情况。结果 DAI后大鼠均出现明显体质量下降、神经功能缺失;DAI后6 h组大鼠胼胝体、脑干组织可见DAPK1蛋白表达明显升高,并出现明显神经元细胞凋亡,DAI后24 h组DAPK1表达及神经元细胞凋亡均到达高峰值,DAI后72 h、7 d组表达开始下降,仍明显高于对照组。结论 DAI后出现神经功能缺失、体质量下降,可能与损伤后DAPK1表达及神经元细胞凋亡有关,二者在损伤后24 h一致性达到高峰;提示DAPK1抑制剂药物治疗时间窗为伤后24 h。
弥漫性轴索损伤;死亡相关蛋白激酶1(DAPK1);神经元凋亡
弥漫性轴索损伤(diffuse axonal injury, DAI)是一种常见的特殊类型的脑外伤(traumatic brain injury, TBI),典型表现为长时间意识障碍,临床诊断较困难且预后差。目前,已在动物模型、临床患者中证实急性颅脑创伤后存在神经元凋亡[1];创伤后神经元凋亡的机制复杂,尽管目前国内外的研究对脑损伤后神经元凋亡有了进一步的认识,发现其涉及钙超载[2]、Mdm2/p53[3]、亚硝化应激(nitrosative stress)[4]、氧化应激(oxidative stress)[5]、线粒体功能障碍[2,6]等多个方面,但是尚未完全阐明其病理演变过程及发生机制。在治疗方面,CLARK等[7]发现向颅脑外伤模型大鼠鞘内注射Caspase-3抑制肽能够明显降低颅脑外伤后的神经元凋亡及脑组织损失;但长期神经功能未见明显改善。
死亡相关蛋白激酶(death-associated protein kinase, DAPK)家族是一簇具有促细胞凋亡作用的丝/苏氨酸蛋白激酶,在机体中广泛参与由多种信号介导的细胞死亡过程;DAPK1作为细胞凋亡正调控因子,可通过上调p53基因的表达而促使细胞进入Ⅰ型细胞凋亡程序,也可与非p53依赖的经典凋亡途径发生关联[8];也有研究发现DAPK1亦可诱导一种不需要半胱天冬酶参与的Ⅱ型细胞死亡或称自体吞噬性细胞死亡[9]。近年研究发现DAPK1与BimEL、ERK1/2、NMDA-NR2b及JNK1/2等下游分子共同介导脑缺血后神经元死亡的新的信号转导通路[10-12]。本实验通过观察DAI后不同时间段大鼠脑组织内DAPK1蛋白表达的变化情况及脑神经元细胞凋亡情况,探讨DAPK1对大鼠DAI损伤后神经元凋亡的影响,旨在为DAI的临床治疗提供新的靶点。
1 材料与方法
1.1 实验动物与材料 成年健康雄性SD大鼠40只,体质量(300±20)g(由西安交通大学医学院实验动物中心提供);DAPK1兔单克隆抗体(美国Abcom公司);β-actin鼠单克隆抗体(美国Santa Cruz公司);DeadEnd TUNEL比色法检测系统(美国Promega公司);Western blot试剂盒(美国Cybrdi公司);图像采集及分析系统(德国Leica-Q550CW)。
1.2 分组及DAI模型制作 健康大鼠随机分为2组:DAI组(n=32)、对照组(n=8);DAI组又分为:损伤后6 h组、24 h组、72 h组、7 d组(各组n=8)。本实验动物伦理经西安交通大学医学部生物伦理委员会批准。
采用刘晓斌等[13]研制的大鼠头颅瞬间旋转损伤装置制备大鼠DAI模型,步骤简述如下:大鼠称重后给予浅麻醉(100 g/L水合氯醛,按2.0 mL/kg腹腔内注射),头部固定于头颅瞬间旋转损伤装置,并调整躯干位置使之与实验台面间夹角保持约30°,按动扳机,使大鼠头颅瞬间旋转90°后又瞬间停止,随后复位装置,重复8次。对照组给予麻醉并固定于装置,但不打击损伤。损伤后大鼠置于单独笼子内,保持室温18~26 ℃,室内相对湿度40%~70%。造模后制作脑组织切片并行镀银染色判断造模是否成功。
1.3 大鼠体质量变化及神经功能的评估 观察各组大鼠的体质量变化情况;体质量变化以手术当天(第0天)体质量为初始基础体质量,连续记录每天体质量变化至各组大鼠结束实验处死取脑(最长为术后第7天)。
采用改良神经功能缺损程度评分(modified neurological severity scores, mNSS)[14],在对照组及DAI组大鼠造模前及处死前,对大鼠神经功能进行评分。mNSS评分包括:运动、感觉、反射及平衡木4项 测试,其中运动试验包括提尾试验及平地运动试验,感觉试验包括放置试验和本体感觉试验,反射消失或不正常运动包括耳廓反射、角膜反射、惊恐反射消失及出现抽搐、肌阵挛、肌张力障碍。记分在0~18分之间(0分正常,最大神经功能缺损18分)。评分人员为两位未知分组情况的实验员。
1.4 Western blot检测大鼠脑组织DAPK1表达 大鼠用水合氯醛麻醉后,用生理盐水250 mL经心脏充分灌注,断头取脑,冰上分离双侧大脑半球、脑干、小脑组织,收集脑干组织;双侧大脑半球OCT包埋、―80 ℃冰冻后,冠状方向连续1 mm切片后,将包含胼胝体脑组织切片沿胼胝体边界切取胼胝体,收集胼胝体标本;脑干、胼胝体组织用RIPA细胞裂解液冰上裂解、离心,取上清液―20 ℃冻存,备用。
将提取的大鼠脑组织蛋白定量分析、蛋白质变性后,按每泳道加20 μg进行SDS-PAGE凝胶电泳,然后经半干转印迹法转移至硝酸纤维素膜上,用50 g/L脱脂牛奶(TBST液配制)封闭1 h后加入1∶1 000稀释DAPK1一抗,4 ℃孵育过夜。TBST液洗膜3次×10 min后加入辣根过氧化物酶标记二抗室温孵育2 h,再次TBST液洗膜4次×10 min后与显色剂(A液∶B液=1∶1)于暗盒内反应5 min,后经胶片显影成像、自动凝胶图像分析仪拍照(上海培清科技JS-380A),以MediaCybernetics公司Image-Pro Plus v6.0分析软件系统进行蛋白条带的灰度值分析。以目的蛋白DAPK1与内参β-actin比值作为目的蛋白的相对表达量。
1.5 Gless-Marsland镀银染色及TUNEL检测大鼠神经元细胞凋亡情况 大鼠用水合氯醛麻醉后依次用生理盐水、40 g/L多聚甲醛各250 mL经心脏灌注,断头取脑,再经后固定、漂洗、脱水并透明后石蜡包埋。每个脑组织块在大脑脚水平离断脑干与间脑部分,去除小脑组织。将大脑沿正中分为左右半球,随机选取一侧半球,分别在中线位置外2 mm连续纵切5 μm厚脑片4片;沿大脑脚水平下1 mm连续横切5 μm厚脑片4片,各切片经脱腊、脱水后用于Gless-Marsland镀银染色及TUNEL染色。
TUNEL染色方法:切片经二甲苯脱腊、乙醇水化、PBS水洗后用蛋白酶K溶液(20 μg/mL)去除组织蛋白,加100 μL TUNEL反应混合液(处理组用1 μL rTdT+1 μL生物素标记的dUTP+98 μL平衡液混匀)于标本上,加盖玻片或封口膜在暗湿盒中反应37 ℃×1h,而阴性对照组不加rTdT,改为三蒸水,阳性对照组先加入100 μL DNase 1缓冲液孵育5 min,甩掉液体后再加100 μL DNase 1(10 U/mL)酶切10 min,用去离子水冲洗4次,PBS浸洗5 min;浸入2×SSC 15 min终止反应;切片用PBS洗3次后滴加内源性过氧化物酶POD封闭,浸入3 mL/L H2O23~5 min;PBS 洗涤3次后滴加100 μL streptavidin标记HRP(按1:500 PBS稀释)30 min;PBS 洗涤3次后DAB显色(避光),加100 μL DAB混合液[(50 μL DAB+50 μL DAB底物缓冲液+50 μL H2O2(20×)+950 μL三蒸水)]10 min左右,镜下出现浅棕色背景时,用苏木素复染,梯度酒精脱水、二甲苯透明、中性树胶封片。加一滴PBS或甘油在视野下,用光学显微镜观察凋亡细胞(共计200~500个细胞)并拍照。
可结合凋亡细胞形态特征进行综合判断。每张切片在高倍镜下选取胼胝体、皮层或脑干位置各5个不重复的视野计数阳性细胞,10(胼胝体+皮层)或5(脑干)个视野总数相加为该切片阳性细胞数,同一组织部位3张切片平均值为该位置阳性细胞数,3个位置相加为该动物总阳性细胞数,最后取每组4只动物的平均值。
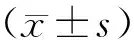
2 结 果
2.1 Gless-Marsland镀银染色 镀银染色能够很好显示神经轴突的病理改变。对照组大鼠脑组织光镜下镀银染色可见脑白质、脑干区域神经轴索走行自然、光滑、粗细均匀及排列紧密。而DAI组在大鼠胼胝体、脑干、小脑等脑白质区域可见迂曲肿胀的轴突,甚至出现轴索断裂、轴索球的形成(图1)。出现以上结果提示DAI模型造模成功,可进行后续实验。

图1 DAI组大鼠神经轴索迂曲肿胀、轴索球(黑色箭头)形成
Fig.1 The axon became varicose and swollen and axonal retraction ball (black arrow) formed in DAI group (×200)
2.2 神经功能缺损评分 DAI组大鼠在造模后均出现不同程度的意识障碍。少数大鼠原发性深昏迷,表现为刺痛反射、惊恐反射、羽翼反射、复位反射均消失、瞳孔直接或间接对光反射迟钝。时间持续约45 min~2 h后意识状态明显改善。其他大鼠昏迷较浅,表现为复位反射较损伤前减慢,刺痛反射、惊恐反射、羽翼反射均有减弱或消失,瞳孔直接或间接对光反射迟钝,持续时间约几分钟至数十分钟之后,表现明显恢复。所有大鼠清醒后行为表现活动减少,反应迟缓,行走不稳,不能抓住横木,易掉下,平衡能力减弱持续数小时至数日。对照组大鼠假损伤后6 h部分大鼠平衡受损,表现为走路不稳,抓住横木不久后掉下,但感觉及反射检测均正常,数小时或数天后恢复。评分结果显示:DAI组在损伤后6 h mNSS评分明显升高,神经功能缺损到达峰值;损伤后24 h、72 h、7 d神经功能有所恢复,仍未到达对照组水平。DAI各组与对照组神经功能缺损评分值比较,差异有统计学意义(P<0.01,表1)。
2.3 DAI后大鼠体质量的变化 DAI后可由于脑水肿、胃肠功能减低、运动功能障碍等原因导致食物及饮水需求或摄入减少,体质量出现不同程度下降,DAI组在损伤后出现了显著的体质量下降且持续至第7天,与对照组相比差异有统计学意义(P<0.01,图2)。
表1 各组大鼠mNSS评分

Tab.1 The results of mNSS in each group (±s)
与对应时间点的对照组比较,**P<0.01。

图2 各组损伤前后大鼠体质量的变化
Fig.2 Weight records before or after injury
对照组假损伤后体质量随时间逐渐增高,#P<0.05;DAI组与对照组比较体质量明显减低,**P<0.01。
2.4 各组脑组织的细胞凋亡情况 TUNEL染色可见凋亡细胞形态特征:未染色细胞变小,胞膜完整但出现发泡现象,晚期出现凋亡小体;而染色细胞呈现染色质浓缩、边缘化,核膜裂解,染色质分割成块状;结果显示胼胝体、皮层、脑干组织在对照组中未见明显阳性细胞或仅有少量;DAI组在损伤后6 h阳性细胞开始明显增多,24 h可见阳性细胞数量达到高峰值;一直持续到第7天,与对照组比较差异有统计学意义(P<0.05)。同时,可见损伤后各时间点脑干组织阳性细胞数较胼胝体组织多,可能与胼胝体内神经元数目较少有关(图3、图4)。
2.5 DAPK1蛋白表达及相关因素分析 大鼠DAI损伤后胼胝体组织内DAPK1的表达量在伤后6 h开始明显增多,24 h达到高峰,一直持续到第7天,与对照组比较差异有统计学意义(P<0.05,图5)。而脑干组织内DAPK1表达量亦在伤后6 h开始明显增多,在伤后24 h达到高峰并一直持续到第7天,与对照组比较差异有统计学意义(P<0.05,图5)。
DAI各组相关性分析结果显示,TUNEL阳性细胞计数、神经功能缺损评分与DAPK1表达呈正相关(图5)。
3 讨 论
DAI是指在头部遭受特殊钝性外力作用下,颅内脑组织在不均一的加速、减速或旋转运动下,由于剪切力的影响,脑内广泛发生的以神经轴索变性、断裂、轴索回缩球形成为主要病理特征改变的颅脑外伤[15]。相关病理学研究发现DAI损伤后轴索易损伤,尤其是轴索密集区域,如胼胝体、脑干,其次为皮层、海马等区域[16]。脑干网状结构具有维持生物醒觉的功能,因而轴索损伤的程度将严重影响着意识障碍的程度,与临床严重的意识障碍相一致。刘晓斌等[13]研制的大鼠头颅瞬间旋转损伤模型致伤稳定,可控性与可重复性高,动物致死率低,特异性强,颅脑损伤多呈弥漫性分布,造模后更贴近临床DAI患者病理生理机制。本实验采用该方法进行DAI打击后,大鼠均出现明显的神经功能缺失,能够较正确反映DAI后继发性神经元损伤导致的脑功能障碍。
急性颅脑创伤造成的应激反应,颅脑外伤后大鼠处于高代谢、高分解及激素水平异常的代谢病理状态,而且颅脑外伤后脑组织水肿、低灌注状态及胃肠道功能损害等因素,以及损伤后不同程度的神经功能缺失(行为、感觉、平衡及反射异常),导致大鼠伤后营养摄入不足,机体处于负氮平衡状态,出现不同程度体质量下降,有研究者认为脑外伤后体质量变化及恢复时间可作为判断颅脑损伤后脑功能恢复状态的指标[17]。本实验发现损伤后急性期体质量下降明显,而损伤后7 d仍未见明显恢复,结合观察DAI损伤后大鼠mNSS评分发现,该阶段仍具有明显的神经功能缺失,因此体质量继续下降的原因可能与颅脑损伤后神经功能缺失导致的摄入不足有关,且神经功能缺失越严重,体质量下降越多,机体的负氮平衡状态越重,进而加重神经功能损害,进入恶性循环。本实验提示DAI后体质量变化指标及恢复情况可作为判断脑损伤后脑功能恢复状况的指标,加强颅脑损伤患者的营养支持、维持正常机体内环境有助于损伤后神经功能的恢复。但明确损伤后长期神经功能恢复程度及体质量能否恢复正常生理水平,还需进一步延长观察时间。
DAI造成外伤后的脑功能障碍不仅由于最初的机械外力等作用所致的原发性损伤,很大程度上与损伤后发生的复杂的神经元“二次打击”(继发性神经元损伤、死亡)有关[18]。机械性颅脑损伤后造成脑组织缺血、坏死及脑血管的损伤,造成继发性神经元损伤(水肿、低灌注状态)[19],如果在一定时间内不能改善,将逐渐发展为继发性神经元死亡[20];继发性神经元死亡是影响患者病情及预后的重要因素,如何预防、降低继发性脑损伤的程度是整个DAI治疗过程十分关键的步骤。以往认为坏死是造成脑损伤继发性细胞死亡的主要原因,目前已有动物实验证实急性颅脑创伤后存在神经元细胞凋亡,本研究TUNEL染色显示DAI后神经细胞于伤后6 h开始出现细胞凋亡,在伤后24 h达到神经细胞凋亡高峰,随后下降,直至损伤后7 d仍高于对照组。

图3 各组大鼠胼胝体、脑干、皮质TUNEL染色
Fig.3 The TUNEL staining of the corpus callosum, brain cortex and brain stem in each group
A:大脑随机半球中线旁纵切面,可见越靠近胼胝体位置,凋亡阳性细胞表达越多,三角形示胼胝体(B),正方形示皮层(C);B:胼胝体;C:脑皮层;D:脑干中脑水平横断面,于圆圈处观察脑干(E);E:脑干区域(A、D: ×40,B、C、E:×400)。
正常状态下DAPK1没有活性,当细胞受到各种“死亡信号”的刺激时,首先DAPK1去磷酸化激活,然后将与其高度同源性蛋白ZIPK磷酸化,从而使得磷酸化ZIPK滞留在细胞质内,通过p53途径或非p53途径以及自体吞噬性作用、膜出泡作用促细胞凋亡。DAPK1多在细胞凋亡信号转导途径中位于Caspase-3及p53上游[21];在脑缺血脑损伤中证实与DAPK1密切相关,DAPK1与谷氨酸受体NMDA-NR2b亚单位结合介导神经兴奋毒性及钙超载损伤,同时DAPK1还可以通过介导自噬、膜出泡、DNA链断裂等最终导致神经细胞的死亡[22]。本研究结果显示DAI组大鼠的胼胝体、脑干组织内DAPK1表达在损伤后6 h开始明显增多,伤后24 h达到高峰,随后缓慢下降,直至损伤后7 d仍高于对照组。其表达变化规律与TUNEL染色呈直线相关关系。提示DAPK1与DAI后神经元凋亡相关,可能是调控颅脑损伤后神经细胞凋亡新的调节分子或催化因子,对其催化功能的抑制性药物的研究可能成为DAI后神经功能保护的治疗靶点,且最佳治疗时间可能为损伤后24 h以内。因此,选用抑制DAPK1的活性药物,将有效逆转DAI后神经细胞死亡,利于神经功能恢复。

图4 各组胼胝体、脑干、皮层部位的TUNEL染色阳性细胞(A)及脑组织总阳性细胞(B)的变化情况
Fig.4 The number of TUNEL staining positive cells (A) in the corpus callosum, brain cortex and brain stem and the total positive cells (B) in brain tissues in each group
与对照组比较,*P<0.05。

图5 各组大鼠脑组织中DAPK1蛋白表达情况及相关性分析
Fig.5 The protein expression of DAPK1 in rat brain in all groups and correlation analysis
A:DAPK1 的Western blot检测结果;B:定量分析各组DAPK1在胼胝体、脑干组织内蛋白表达,与对照组相比较,*P<0.05,**P<0.01,##P<0.01。C:TUNEL阳性细胞计数与脑组织DAPK1表达的相关性;D:神经功能缺损评分与脑组织DAPK1表达的相关性。
[1] MINAMBRES E, BALLESTEROS MA, MAYORGA M, et al. Cerebral apoptosis in severe traumatic brain injury patients: aninvitro,invivo, and postmortem study[J]. J Neurotrauma, 2008, 25(6):581-591.
[2] HANSSON MJ, PERSSON T, FRIBERG H, et al. Powerful cyclosporin inhibition of calcium-induced permeability transition in brain mitochondria[J]. Brain Res, 2003, 960(1-2):99-111.
[3] XU J, JIN W, WU X, et al. Up-regulation of Che-1 relates to neuronal apoptosis after traumatic brain injury in adult rats[J]. Cell Mol Neurobiol, 2013, 33(1):85-97.
[4] AARTS M, IIHARA K, WEI WL, et al. A key role for TRPM7 channels in anoxic neuronal death[J]. Cell, 2003, 115(7):863-877.
[5] UEHARA T, NAKAMURA T, YAO D, et al. S-nitrosylated protein-disulphide isomerase links protein misfolding to neurodegeneration[J]. Nature, 2006, 441(7092):513-517.
[6] 刘健,杨小玉,董健,等. Bcl-2蛋白与细胞凋亡的关系及其在中枢神经损伤修复中作用的研究进展[J]. 吉林大学学报:医学版, 2012, 38(3):603-606.
[7] CLARK RS, KOCHANEK PM, WATKINS SC, et al. Caspase-3 mediated neuronal death after traumatic brain injury in rats[J]. J Neurochem, 2000, 74(2):740-753.
[8] WANG WJ, KUO JC, YAO CC, et al. DAP-kinase induces apoptosis by suppressing integrin activity and disrupting matrix survival signals[J]. J Cell Biol, 2002, 159(1):169-179.
[9] SHANI G, MARASH L, GOZUACIK D, et al. Death-associated protein kinase phosphorylates ZIP kinase, forming a unique kinase hierarchy to activate its cell death functions[J]. Mol Cell Biol, 2004, 24(19):8611-8626.
[10] HE C, STROINK AR, WANG CX. The role of DAPK-BimEL pathway in neuronal death induced by oxygen-glucose deprivation[J]. Neuroscience, 2014, 258:254-262.
[11] PLESNILA N, VON BAUMGARTEN L, RETIOUNSKAIA M, et al. Delayed neuronal death after brain trauma involves p53-dependent inhibition of NF-kappaB transcriptional activity[J]. Cell Death Differ, 2007, 14(8):1529-1541.
[12] TU W, XU X, PENG L, et al. DAPK1 interaction with NMDA receptor NR2B subunits mediates brain damage in stroke[J]. Cell, 2010, 140(2):222-234.
[13] 刘晓斌,宋锦宁,陈景宇,等. 脑弥漫性轴索损伤实验装置的研制及动物模型的建立[J]. 西安交通大学学报:医学版, 2008, 29(5):595-598.
[14] CHEN J, SANBERG PR, LI Y, et al. Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J]. Stroke, 2001, 32(11):2682-2688.
[15] POVLISHOCK JT, KATZ DI. Update of neuropathology and neurological recovery after traumatic brain injury[J]. J Head Trauma Rehabil, 2005, 20(1):76-94.
[16] YAMAKI T, MURAKAMI N, IWAMOTO Y, et al. Pathological study of diffuse axonal injury patients who died shortly after impact[J]. Acta Neurochir (Wien), 1992, 119(1-4):153-158.
[17] HAMM RJ. Neurobehavioral assessment of outcome following traumatic brain injury in rats: an evaluation of selected measures[J]. J Neurotrauma, 2001, 18(11):1207-1216.
[18] 周卫京. 早期高压氧治疗弥漫性轴索损伤临床分析[J]. 吉林大学学报:医学版, 2012, 38(2):381-381.
[19] STRUFFERT T, AXMANN C, REITH W. Craniocerebral trauma. 2: Intra-axial injuries, secondary injuries[J]. Radiologe, 2003, 43(11):1001-1014, 1015-1016.
[20] WANG YQ, WANG L, ZHANG MY, et al. Necrostatin-1 suppresses autophagy and apoptosis in mice traumatic brain injury model[J]. Neurochem Res, 2012, 37(9):1849-1858.
[21] SHAMLOO M, SORIANO L, WIELOCH T, et al. Death-associated protein kinase is activated by dephosphorylation in response to cerebral ischemia[J]. J Biol Chem, 2005, 280(51):42290-42299.
[22] NAIR S, HAGBERG H, KRISHNAMURTHY R, et al. Death associated protein kinases: molecular structure and brain injury[J]. Int J Mol Sci, 2013, 14(7):13858-13872.
(编辑 国 荣)
Expression of death-associated protein kinase 1 and its relationshipwith neuron apoptosis following diffuse axonal injury in rats
HUANG Ting-qin, SONG Jin-ning, LI Yu, HU Ming-jun,ZHAO Ya-hui, ZHENG Feng-wei, GUO Xiao-ye, JIN Tao
(Department of Neurosurgery, the First Affiliated Hospital, Medical School ofXi’an Jiaotong University, Xi’an 710061, China)
Objective To explore the change of death-associated protein kinase 1 (DAPK1) expression and neuron apoptosis so as to provide a therapeutic time window for diffuse axonal injury in rats. Methods Totally 40 adult male SD rats were randomly divided into control group (n=8) and DAI groups (n=32). The model of DAI was produced by instant head rotation, and the model group was further divided into 4 subgroups, with 8 rats in each: 6 h, 24 h, 72 h and 7 d. Rats in each group were evaluated for the modified neurological severity score (mNSS) before injury and before sacrifice. Meanwhile half of the rats in each group were used to assay the expression of DAPK1 in the corpus callosum and the brain stem after DAI by Western blot, while the other half were used to detect the brain neuron apoptosis after DAI. Results There were obvious weight loss and neurological deficit in the rats after DAI. At 6 h after brain injury, the expression of DAPK 1 increased obviously and obvious neuron apoptosis was observed. At 24 h after injury, both the expression of DAPK1 and neuron apoptosis reached the peak. However, they began to decrease at 72 h and 7d after injury, but were still higher than those in control group. Conclusion Weight decrease and neurological deficit in the rats after DAI may be related to the expression of DAPK1 and neuron apoptosis after DAI, both of which reached the peak at 24 h after injury. It suggested that the optimum therapeutic time window of DAPK1 inhibitors was 24 h after DAI.
diffuse axonal injury; death-associated protein kinase 1; neuron apoptosis
2014-04-21
2014-08-25
国家自然科学基金资助项目(No.30471774);教育部新世纪优秀人才支持计划资助项目(No.NCET-05-0831);陕西省自然科学基金资助项目(No.2003C1-16) Supported by the National Natural Science Foundation of China (No.30471774), the New-Century Excellent Talents Program of Ministry of Education (No.NCET-05-0831), and the Natural Science Foundation of Shaanxi Province (No.2003C1-16)
宋锦宁,博士,教授,主任医师,博士生导师. E-mail: jinnings@126.com
黄廷钦(1988-),男(汉族),博士研究生在读,研究方向:脑血管病、脑外伤基础及临床. E-mail: htqno.1@stu.xjtu.edu.cn
时间:2014-10-15 14∶31 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20141015.1431.001.html
R651.1
A
10.7652/jdyxb201406008

