替硝唑栓微生物限度检查方法学研究
蒋彦洁 凌明 张笑颜
·实验研究·
替硝唑栓微生物限度检查方法学研究
蒋彦洁 凌明 张笑颜
目的对替硝唑栓的微生物限度检查方法进行研究。方法按照《中华人民共和国药典》2010年版附录的要求进行方法学验证, 细菌计数采用低速离心-薄膜过滤法, 真菌及酵母菌计数采用薄膜过滤法, 控制菌检查采用薄膜过滤法与低速离心-薄膜过滤法。结果细菌、真菌及酵母菌的回收率均>70.0%, 控制菌检查中, 各阳性试验菌均检出, 阴性对照无菌生长。结论薄膜过滤法与低速离心-薄膜过滤法可消除替硝唑栓的抑菌作用, 适用于该制剂的微生物限度检查。
替硝唑栓;微生物限度检查
替硝唑栓属于妇科常用药, 有抗滴虫和抗厌氧菌效果,常用于滴虫性和细菌性阴道炎治疗。由于替硝唑栓有较强的抑菌效果, 并且《中华人民共和国药典》[1](2010年版)对药品微生物限度检验方法做了相应的要求, 作者结合栓剂的微生物检查法[2]对其微生物检验方法进行验证以考察其检验标准是否科学合理。
1 材料与方法
1.1材料 无菌十四烷酸异丙酯、pH7.0氯化钠-蛋白胨缓冲液、玫瑰红钠琼脂培养基、营养琼脂培养基、胆盐乳糖培养基、营养肉汤培养基、沙氏葡萄糖液体培养基、甘露醇氯化钠琼脂培养基、沙氏葡萄糖琼脂培养基、溴化十六烷三甲基三甲铵琼脂培养基。
1.2菌种 铜绿假单胞菌[ CMCC(B)10104](菌种1)、枯草芽孢杆菌[CMCC(B)63501](菌种2)、金黄色葡萄球菌[CMCC(B)26003](菌种3)、大肠埃希菌[CMCC(B) 44102](菌种4)、白色念珠菌[CMCC(F)98001](菌种5)、黑曲霉菌[CMCC(F)98003](菌种6)。
1.3样品 替硝唑栓(广州白云山制药股份有限公司, 批号:X1002, 规格:1g)。
1.4实验仪器 MLS-3750高压灭菌锅(三洋工业株式会社);XW-80A涡旋混合仪(上海沪西分析仪器厂);SWCJ-2F0超级洁净工作台(苏州市安泰空气技术有限公司);DHP-9279恒温细菌培养箱(上海一恒科技有限公司);Microfil全自动微生物限度过滤系统(美国默克-密理博公司);SE601F电子天平(奥豪斯仪器公司)。
1.5方法
1.5.1制备菌液 在营养肉汤培养基中接种菌种1-4的新鲜斜面培养物并在30~35℃培养24 h;在改良马丁培养基中接种菌种5的新鲜斜面培养物并在23~28℃培养24 h;培养结束后, 用0.9%无菌氯化钠溶液将这些培养液稀释至10-5、10-6、10-7, 制成50~100 cfu/ml的菌液备用。用含0.05%(ml/ml)聚山梨酯80的无菌氯化钠溶液[2]加入菌种6的新鲜斜面培养物以清洗孢子, 并用含0.05%(ml/ml)聚山梨酯80的无菌氯化钠溶液10倍稀释至10-4, 制成50~100 cfu/ml的孢子悬液以备用。
1.5.2制备供试液 取10 g供试品于含无菌玻璃珠的锥形瓶中, 并加入无菌十四烷酸异丙酯5 ml, 摇动使其充分溶解,然后加入100 ml 45℃氯化钠-蛋白胨缓冲液(pH7.0)并摇动5~10 min, 萃取, 静置, 取水层为供试液(1∶10)。
1.5.3验证酵母菌、真菌和细菌计数方法
1.5.3.1常规法验证菌落计数方法 ①试验组:取1 ml供试液分别注入10个平皿中, 分别加入1 ml含50~100 cfu/ml的菌种2-6的菌悬液(每种菌平行制备2个平皿), 分别加入营养琼脂培养基和玫瑰红钠琼脂培养基, 然后分别培养3 d (30~35℃)和5 d(23~28℃)。②菌液组:分别取1 ml制备好的菌液加入两个平皿内(平行制备), 测定所加实验菌数。③供试品对照组:取1 ml供试液(1:10)分别注入5个平皿并立即加入营养琼脂培养基和玫瑰红钠琼脂培养基, 分别培养3 d(30~35℃)和5 d(23~28℃)。测定供试品本底菌数。
1.5.3.2培养基稀释法 ①试验组:取1 ml供试液(1:10)分别注入5个平皿中(均分), 分别加入1ml含50~100 cfu/ml的菌种2-6的菌悬液(每种平行制备2个平皿), 分别加入营养琼脂培养基和玫瑰红钠琼脂培养基(立即), 然后分别培养3 d(30~35℃)和5 d(23~28℃)。②菌液组:取1ml上述制备好的各种菌液分别注入两个平皿内(平行制备), 测定所加实验菌数。③供试品对照组:取1 ml供试液分别注入5个平皿中(均分), 平行制备两组并立即加入20 ml左右营养琼脂培养基, 培养后计数。④稀释剂对照组:取1 ml氯化钠-蛋白胨缓冲液(pH7.0)替代供试液, 方法同试验组。
1.5.3.3薄膜过滤法与低速离心-薄膜过滤法 ①试验组:取10 ml供试液(1:10), 于无菌条件下离心3 min(500 r/min), 取 1 ml上清液并加稀释剂, 薄膜法过滤(800 ml冲洗量), 最后一次冲洗液中加入1 ml相应阳性细菌试验菌, 取出滤膜并贴于营养琼脂平板上(菌面朝上), 培养后测定细菌数;因《中国药典》(二部)规定离心沉淀法不能用于霉菌及酵母菌计数检查, 故采用薄膜过滤法, 取1 ml供试液(1:10), 加稀释剂并用薄膜法过滤(800 ml冲洗量), 最后一次冲洗液中加入1 ml相应真菌及酵母菌试验菌, 取出滤膜并贴于玫瑰红钠琼脂平板上(菌面朝上), 培养后测定真菌及酵母菌数。②菌液组:取1 ml上述稀释的阳性菌菌液至平皿中并立刻加入相应的培养基, 规定条件培养后测定各阳性菌的菌落数。③供试品对照组:方法同试验组, 但不加阳性对照菌以测定样品本底的菌数。④稀释剂对照组:方法同试验组, 但用稀释剂代替供试液测定。
1.5.3.4回收率公式 试验组菌回收率(%)=( 试验组平均菌落数-供试品对照组平均菌落数)/菌液组平均菌落数×100%。稀释剂对照组菌回收率(%)=稀释剂对照组平均菌落数/菌液组平均菌落数×100%。
2 结果
2.1常规法菌落计数的结果见表1。
2.2培养基稀释法菌落计数的结果见表2。
2.3薄膜过滤法与低速离心-薄膜过滤法菌落计数的结果见表3。

表1常规法测定细菌、霉菌和酵母菌回收率(cfu, %)
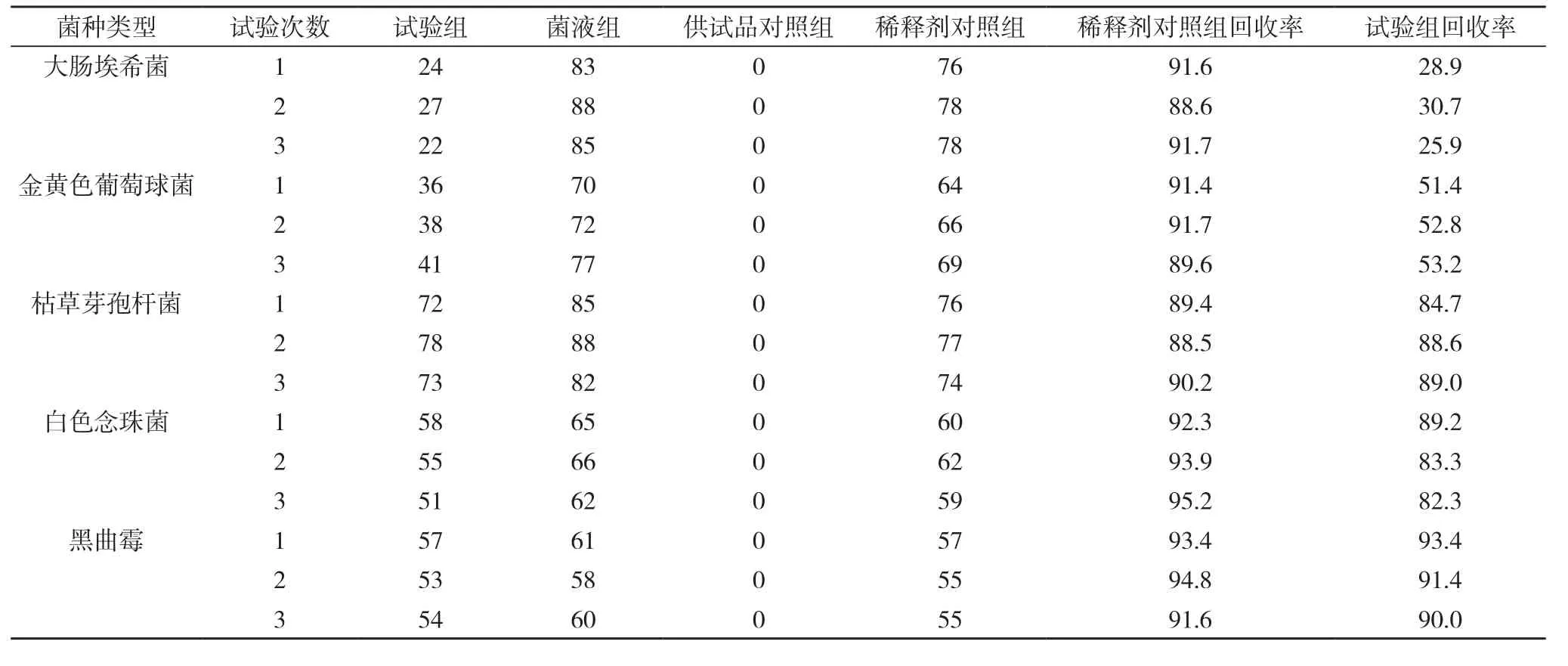
表2培养基稀释法测定细菌、霉菌和酵母菌回收率的测定(cfu, %)
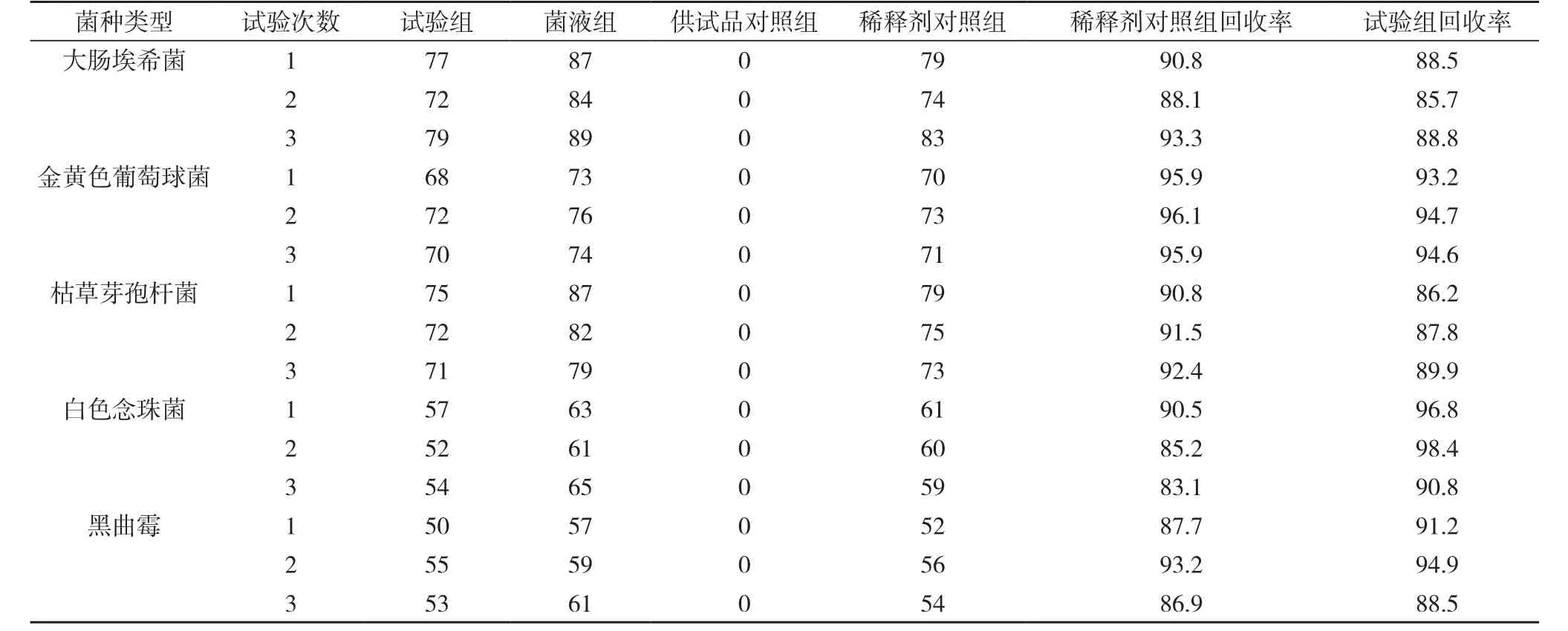
表3薄膜过滤法与低速离心-薄膜过滤法测定细菌、霉菌和酵母菌回收率(cfu, %)
结果判断:对替硝唑栓进行3次独立平行微生物限度检查方法回收率试验, 5株试验菌的试验组菌回收率>70%, 且稀释剂对照组的菌回收率也>70%, 说明运用本方法可以消除供试品的抑菌性, 且受试微生物的活性并未受供试液制备过程的影响, 故可采用该法进行样品中的细菌、真菌及酵母菌数的测定。
2.4验证控制菌检查方法
2.4.1试验组 取2份10 ml的供试液(1:10), 方法同“1.5.3.3”,使用600 ml冲洗液冲洗, 并于最后一次冲洗液中加入阳性对照菌菌种1和菌种3菌液各1 ml, 取出滤膜, 分别接种于胆盐乳糖培养基(100 ml)和营养肉汤培养基(100 ml)中, 摇匀, 培养18~24 h(30~35℃);另10 ml的供试液(1:10), 加稀释剂适量,依薄膜过滤法过滤(冲洗液为800 ml), 并加入阳性对照菌菌种5菌液1 ml于最后一次冲洗液中, 取出滤膜, 接种至沙氏葡萄糖液体培养基(100 ml)中, 培养24~48 h(23~28℃)。
2.4.2阴性对照组 取等量稀释剂, 方法与试验组相同(不加阳性对照菌菌液)。
2.4.3验证结果 试验组检出阳性试验菌, 且阴性对照组无菌生长, 结果见表4。试验组检出阳性实验菌, 而阴性对照组无菌检出, 故可使用该供试液制备法与控制菌检查法进行控制菌的检查。
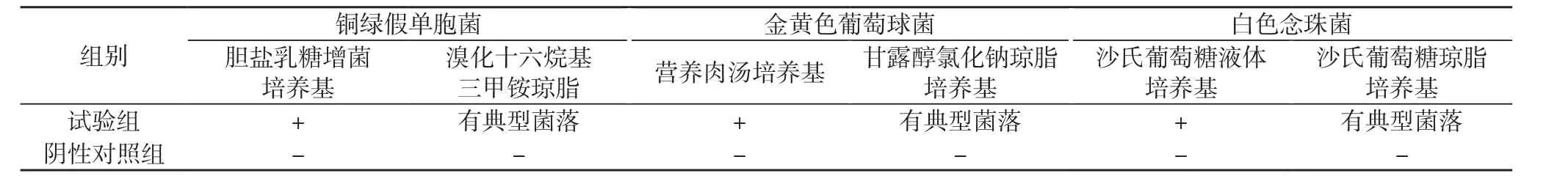
表4控制菌检查方法学的验证结果
3 讨论
因为替硝唑栓具有较强的抑菌作用, 所以, 微生物限度检查可采用低速离心-薄膜过滤法与薄膜过滤法联合的方法进行测定, 以确保样品的抑菌作用能够被有效去除。并且依照《中华人民共和国药典》2010年版附录中对微生物限度检查方法的要求, 将离心时间由5 min缩短至3 min。
替硝唑栓为阴道用药, 《中华人民共和国药典》2010年版附录中微生物限度检查法明确规定, 阴道、尿道给药制剂应增加对白念珠菌的检查, 且控制菌检查中取消对阴性对照菌的检查, 增加测定稀释剂作为阴性对照, 结果应无菌生长。
对替硝唑栓微生物限度检查方法3次独立的的回收率试验结果表明:替硝唑栓采用薄膜过滤法与低速离心-薄膜过滤法测定其微生物限度, 回收率均>70%, 符合微生物限度检查方法适用性测定中可靠性[3,4]的要求。此后对替硝唑栓微生物限度的检测可采用该方法。
[1] 国家药典委员会.中华人民共和国药典( 二部).北京:中国医药科技出版社, 2010:107-116.
[2] 陆蓓.几种栓剂的微生物限度检查法的验证.西北药学杂志, 2006, 21(3):121-122.
[3] 李云龙.中国药品检验标准操作规范.北京:中国医药科技出版社, 2010:400.
[4] 苑思坤, 李玉芝, 王红云.微生物限度检查薄膜过滤法供试液预处理方法探讨.药物鉴定, 2010, 19(18):42-43.
Methodological study on microbial limit test of tinidazole suppositories
JIANG Yan-jie, LING Ming, ZHANG Xiao-yan.
Zhejiang Jinhua Institute for Food and Drug Control, Jinhua 321000, China
ObjectiveTo study the method of microbial limit test of tinidazole suppositories.MethodsAccording to the appendix of Chinese Pharmacopoeia (2010 edition), methodology validation was taken in the test.Low-speed centrifugal-membrane filtration method was applied for bacteria counting, and membrane filtration method was used for fungus and saccharomycetes counting.Both the above methods were used in control bacteria check.ResultsThe recovery rates of bacteria, fungus, and saccharomycetes were all >70.0%.The results of control bacteria check showed that all positive test bacteria were detected, and no negative control bacteria occurred.ConclusionBoth of membrane filtration method and low-speed centrifugal-membrane filtration method can eliminate the bacteriostasis of tinidazole suppositories, and they are applicable to the microbial limit test of tinidazole suppositories.
Tinidazole suppositories; Microbial limit test
2014-08-22]
321000 浙江省金华市食品药品检验所

