螯合剂和AM菌根对玉米吸收重金属及重金属化学形态的影响
李瑞,刘晓娜,赵中秋,
1. 中国地质大学(北京)土地科学技术学院,北京 100083;2. 国土资源部土地整治重点实验室, 北京 100035
土壤重金属污染已成为全球普遍关注的环境问题之一。土壤―植物系统是地圈及生物圈基本构成单位,重金属污染不仅对农作物的收成与质量有重要影响,而且还影响到大气及水环境质量,甚至通过食物链危及人类健康(Chen等,2000;Cunningham等,1995;Khan等,2000;Karenlampi等,2000)。较之传统的物理、化学修复技术,植物修复因其效果好、投资省、易于管理和操作、不产生二次污染等优点日益受到人们的重视(Baker和 Brooks,1989;Salt等,1995),被学术界公认为生态友好型原位绿色修复技术,成为污染土壤修复研究的热点(Salt等,1998;Garbisu和Alkorta,2001)。近年来,国内外对金属螯合剂在化学―植物联合修复和菌根菌在微生物―植物联合修复中的应用开展了大量的研究。
螯合剂能够促进重金属从土壤固相解吸,增加重金属离子的生物有效性,促进植物对重金属元素的吸收。但螯合剂和金属螯合物会抑制植物的生长,使其生物量减少,甚至死亡(Blaylock等,1997),大大影响植物提取的效率。AM菌根菌是一类能与绝大多数陆生植物形成互惠共生关系的土壤真菌,能积极促进宿主植物吸收矿质营养和抵抗逆境胁迫(Powell和Bagyaraj,1984)。研究表明,AM真菌能够显著增强植物对许多重金属的耐受能力,在重金属污染土壤的植物修复中表现出积极的意义(Hildebrandt等,2007)。若螯合剂和菌根组合应用,理论上应该可以发挥二者的优势,大大提高植物提取效率。根际是受植物根系活动影响的部分土壤,是一种微生态系统。根际土壤环境影响着重金属在土壤―植物系统中的迁移和转化(Marschner,1986;Yossefu等,1997),而重金属形态与其迁移、转化和生物有效性有着密切的关系。了解菌根对根际土壤中重金属形态变化的影响,对发展重金属污染修复技术有着重要的意义,目前相关研究很少。本文通过土培实验,比较研究EDTA、EDDS、AES、IDSA和AM菌根单一或复合添加对玉米Zea maysL.生物量及土壤中重金属质量分数的影响,阐明新型螯合剂在修复重金属污染土壤方面的潜力及AM和螯合剂联合能否达到理论上的强化效果,并分析玉米菌根根际重金属的形态变化,以了解AM菌根对根际和非根际土壤中重金属化学形态的影响,为重金属污染土壤修复提供新的思路。
1 材料与方法
1.1 实验材料
供试土壤采自北京市昌平区农田,实验用玉米品种为鲁单 981,菌根由北京市林业科学院提供,经玉米扩繁后,用含有侵染菌根和菌丝的根际土壤作为菌根接种剂。螯合剂EDDS购于西格玛奥德里奇(上海)贸易有限公司。土壤理化性质的测定参照鲁如坤的方法(鲁如坤,2000),结果见表1。
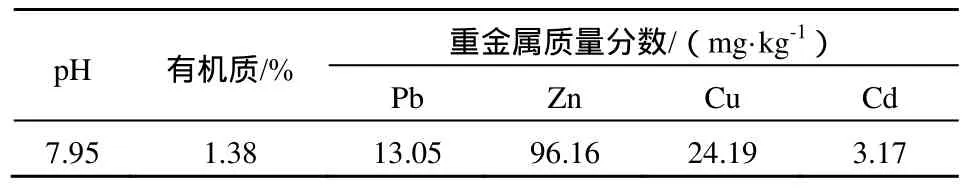
表1 供试土壤基本理化性质Table 1 Basic Physicochemical characteristics of soils
1.2 盆栽实验
实验采用的三室根箱装置宽8 cm,长、高10 cm,中室宽2 cm,2个边室各3 cm,中室和边室用30 μm孔径的尼龙网相隔,把根系限制在中室生长。边室土量250 g,中室土量200 g,将30 g接种剂和170 g灭菌后的土壤混合装入中室,菌种接种率为15%,对照处理加入相应数量的经灭菌处理后的接种剂。保持田间持水量为80%左右,在温室中平衡2周。
土壤自然风干后,将土壤样品磨碎,过1 mm筛,在120 ℃高温灭菌锅中灭菌2 h,杀死土壤中的真菌孢子,待灭菌土壤自然风干后,一次性添加Pb、Cu、Cd、Zn 4 种重金属:2000 mg·kg-1Pb(PbCl2),350 mg·kg-1Cu(CuSO4·5H2O),10 mg·kg-1Cd ( CdCl2·2.5H2O ) , 1500 mg·kg-1Zn(ZnSO4·7H2O),并以磷酸二氢钾(KH2PO4)、尿素(CO(NH2)2)形式一次性施入基肥(氮:100 mg·kg-1;磷:80 mg·kg-1;钾 100 mg·kg-1)。选取籽粒饱满的玉米种子用10%的H2O2溶液消毒10 min,用去离子水洗净后,将种子放于铺有湿润滤纸的培养皿中,将培养皿放在25 ℃左右培养箱约2 d,将发芽的种子播种于三室根箱的中室,待种子萌发后间苗,每箱留2株,生长期间每隔1 d以称质量法加去离子水使土壤保持田间持水量的80%左右。待幼苗生长50 d后进行螯合剂处理,EDTA、EDDS、AES和IDSA分别配成溶液一次性均匀淋溶在土壤表面。实验中所添加的螯合剂质量摩尔浓度为 5 mmol·kg-1。实验共设计 10个处理,分别记为 CK(未添加螯合剂和菌土)、AM(只添加菌土)、EDTA(只添加螯合剂 EDTA)、EDDS(只添加螯合剂EDDS)、AES(只添加螯合剂AES)、IDSA(只添加螯合剂IDSA)、EDTA&AM(同时添加EDTA和AM)、EDDS&AM(同时添加 EDDS和 AM)、AES&AM(同时添加AES和AM)和IDSA&AM(同时添加IDSA和AM),每个处理设置4个重复,随机区组排列。
1.3 测定项目和方法
1.3.1 植物分析
螯合剂处理15 d后收获,用剪刀沿植株基部切取,分为根部和地上部。将根系用去离子水洗干净后,每个处理的每个重复挑选20个1 cm左右长的鲜根,用墨水醋方法测定菌根侵染率(杨亚宁等,2010),菌根侵染率=(被侵染的根段数/总根段数)×100%。剩余根部和地上部用去离子水洗净后80 ℃烘干并称干质量,烘干后的样品研碎后用HNO3微波硝煮,同时加入标准物质对整个消化过程和分析测试过程进行质量控制,用电感耦合等离子体发射光谱仪(ICP-OES,Varian 715-ES Series)测定重金属的质量分数。
1.3.2 重金属化学形态分析
根箱内的土壤分为两部分处理,中室土和边室中距离尼龙网5 mm以内的土作为根际土,边室中剩余土壤作为非根际土,将两部分土自然风干后过(相当于100目)筛待用。采用改进的BCR三步法(Rauret等,1999;Filgueiras等,2002)分析土壤中Pb、Cu、Zn和Cd的形态。
1.4 数据处理
采用Microsoft Excel 2003绘图,SPSS17.0进行数据处理及显著性检验。
2 结果与讨论
2.1 不同处理对菌根侵染率的影响

图1 接种AM处理组间菌根侵染率的比较Fig.1 Mycorrhizal colonization at different chelator treats
由图1可见,对照组无菌根侵染,而接种AM菌根组都有较高的侵染率,表明AM菌根在重金属环境中可以正常地生长,对土壤中重金属的毒害具有一定的耐性,这样AM菌根才有发挥作用的可能。与单一接种AM菌根的对照相比,复合施加螯合剂EDTA和 AES的处理组菌根侵染率明显降低(P<0.05),而复合施加EDDS和IDSA的处理组无显著性变化,这可能与不同种类螯合剂和菌根之间存在不同程度的相互作用有关,EDDS和IDSA均为生物可降解螯合剂,对土壤生物的毒害较小。
2.2 不同处理对玉米地上部生物量的影响
如图2所示(不同字母表示差异显著,P<0.05),与对照相比,添加螯合剂对植物的生长有一定的限制,地上部生物量都有所下降,其中,添加EDDS和IDSA的处理组与对照差异显著(P<0.05),有明显的中毒症状,主要表现为部分叶片萎蔫。螯合剂提高了土壤中重金属的生物有效性,促进了植物对重金属的吸收,过量的重金属对植物生长产生抑制作用。
单独添加AM菌根的处理组与对照相比玉米地上部生物量显著增加(P<0.05),玉米地上部生物量分别为3.16 g、2.55 g,前者比后者增加了24%。复合添加螯合剂和AM菌根的处理组与单独添加螯合剂的处理相比较,前者大于后者,但差异不显著。
2.3 不同处理对玉米地上部和根部重金属质量分数的影响

图2 不同处理对玉米地上部生物量的影响Fig.2 Effects of different treats on maize shoot biomass
2.3.1 Cd质量分数变化
如图3所示,对于玉米地上部,对照组与单独接种 AM 处理组玉米地上部 Cd质量分数分别为2.11、17.42 mg·kg-1,后者比前者增加了194.3%,达到显著性差异水平(P<0.05)。对照组与单独添加螯合剂的处理组相比,除EDDS处理外,EDTA、AES和IDSA处理的玉米地上部Cd质量分数分别是对照的3.6倍、6.2倍和6.3倍,说明接种AM菌根和添加螯合剂均促进了玉米地上部对Cd的吸收。AM&EDDS处理较之 EDDS处理,前者是后者的6.4倍,较之单独接种 AM 处理增加了 120.7%。AM&IDSA处理较之IDSA处理和单独接种AM处理也得到类似结果,表明复合添加螯合剂和AM增强了玉米地上部吸收积累Cd的效果。
对于玉米根部,单一接种AM菌根的处理组玉米根部Cd质量分数达到43.88 mg·kg-1,是对照的5.9倍,达到显著性差异水平(P<0.05)。单一添加EDTA、EDDS的处理组,玉米根部Cd质量分数分别为 40.89 mg·kg-1和 30.22 mg·kg-1,是对照的 5.5倍和4.0倍,差异显著(P<0.05),说明接种AM菌根和螯合剂的添加促进了玉米根部对Cd的吸收。单一接种AM处理的玉米根部和地上部Cd质量分数均显著大于对照(P<0.05);EDTA与AM&EDTA比较,玉米根部 Cd质量分数前者显著大于后者(P<0.05),而地上部 Cd质量分数无显著差异;EDDS较之AM&EDDS,玉米根部Cd质量分数前者大于后者,地上部Cd质量分数则相反;IDSA和AM&IDSA比较,玉米根部Cd质量分数无明显差异,但地上部Cd质量分数后者显著大于前者,这些表明接种AM菌根促进了Cd由根部向地上部的转移。

图3 不同处理对玉米根部和地上部Cd质量分数的影响Fig.3 Cd concentrations in the shoots and roots of maize at different treats
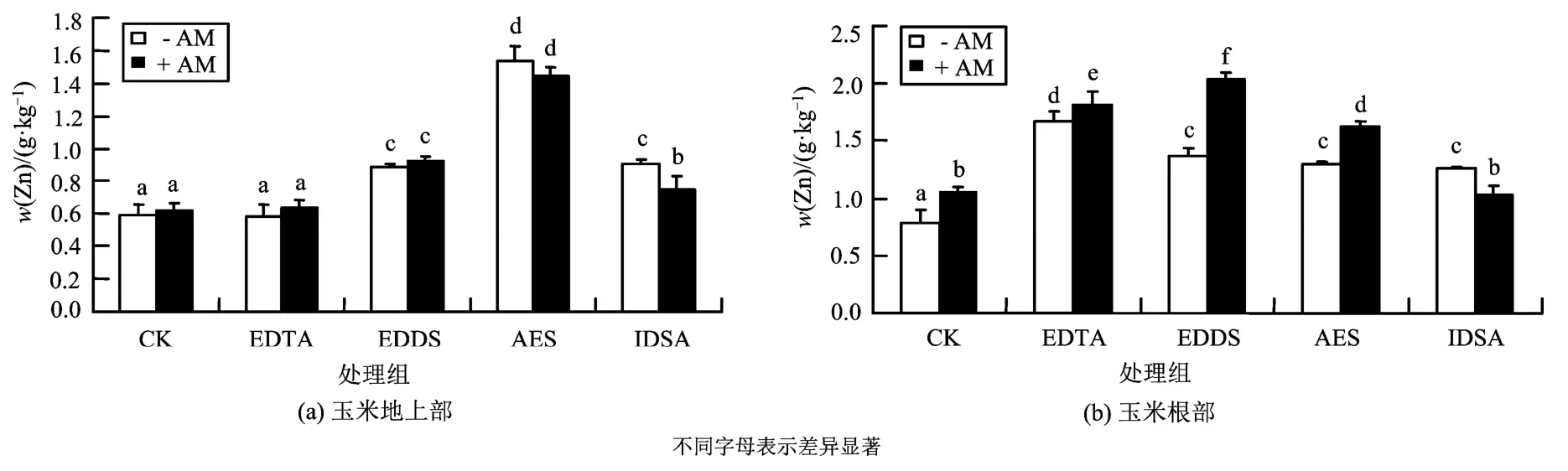
图4 不同处理对玉米根部和地上部Zn质量分数的影响Fig.4 Zn concentrations in the shoots and roots of maize at different treats
2.3.2 Zn质量分数变化
如图4所示,对于玉米地上部Zn的质量分数,单独接种AM处理与对照无显著性差异。除EDTA外,单独添加EDDS、AES和IDSA处理的玉米地上部 Zn质量分数较之对照分别增加了 49.7%、159.1%和53.4%,表明添加螯合剂促进了植物地上部对Zn的吸收,且AES影响最大。复合添加螯合剂和 AM 的处理较之单一添加螯合剂的处理组相比,除AM&IDSA相对IDSA显著降低外(P<0.05),其他组处理无显著性差异;除 AM&EDTA外,AM&EDDS、AM&AES和AM&IDSA处理组显著高于单一接种 AM 菌根处理(P<0.05),分别增加了49.4%、134.1%和21.8%,表明螯合剂和AM的复合添加增强了单一接种AM菌根对玉米地上部吸收Zn的效果。
对于玉米根部,单独接种AM菌根处理的玉米根部Zn质量分数显著大于对照(P<0.05),增加了34.9%。单独添加EDTA、EDDS、AES和IDSA的处理与对照相比,分别增加了110.0%、73.3%、63.8%和60.0%,说明接种AM菌根和添加螯合剂都促进了玉米根部对 Zn的吸收。AM&EDDS处理较之EDDS处理,前者比后者增加了48.6%,AM&AES处理较之 AES处理玉米根部 Zn质量分数增加了24.6%。复合添加螯合剂和AM处理与单一接种AM处理相比,AM&IDSA与 AM 无显著性差异。AM&EDTA、AM&EDDS和AM&AES较之AM处理分别增加了 70.0%、90.9%和 51.3%,差异显著(P<0.05)。以上表明复合添加螯合剂和AM菌根增强了单一添加AM或者螯合剂对玉米根部吸收积累Zn的效果。
2.3.3 Cu质量分数变化
如图5所示,对于玉米地上部,单独接种AM处理的玉米地上部Cu质量分数相对于对照增加但差异性不显著。除EDTA外,单独添加EDDS、AES和IDSA处理组玉米地上部Cu质量分数均显著大于对照(P<0.05),分别是对照的9.4倍、21.8倍和7.7倍,表明螯合剂增加了玉米地上部对Cu的吸收。复合添加螯合剂和 AM 菌根处理,除 AM&EDTA外,AM&EDDS、AM&AES和AM&IDSA处理玉米地上部Cu质量分数显著大于单独添加AM处理(P<0.05),前者分别是后者的5.4倍、8.4倍和3.3倍。复合添加螯合剂和AM增强了单一接种AM玉米地上部对Cu的吸收。

图5 不同处理对玉米根部和地上部Cu质量分数的影响Fig.5 Cu concentrations in the shoots and roots of maize at different treats
对玉米根部,单独接种AM处理玉米根部Cu质量分数与对照没有显著性差异。单独添加EDTA、EDDS、AES和IDSA的处理玉米根部Cu质量分数与对照相比有显著性差异(P<0.05),前者分别比对照增加了102.3%、91.3%、229.1%和131.0%,表明螯合剂增加了玉米根部对Cu的吸收。复合添加螯合剂和AM处理较之单独接种AM处理,前者玉米根部Cu质量分数显著大于后者(P<0.05),分别是后者的2.6倍、1.8倍、4.0倍和1.6倍,说明复合添加螯合剂和AM促进了单一接种AM对玉米根部吸收Cu的效果。
2.3.4 Pb质量分数变化
如图6所示,对于玉米地上部Pb的质量分数,单一接种AM处理与对照无显著性差异。单独添加EDTA、EDDS、AES和IDSA处理组显著大于对照(P<0.05),分别是对照的3.4倍、9.1倍、8.6倍和8.1倍,表明螯合剂促进了玉米地上部对Pb的吸收。复合添加螯合剂和AM处理与单一接种AM处理比较,前者显著大于后者(P<0.05),分别是后者的3.3倍、5.5倍、11.9倍和8.7倍。AM&AES处理较之AES处理,前者比后者增加了71.5%。AM&IDSA处理较之IDSA处理,前者比后者增加了32.0%。AM&EDTA处理与EDTA处理差异不显著。这些说明,复合添加螯合剂和菌根增强了单一接种AM或单一添加螯合剂玉米地上部对Pb的吸收效果。
对于玉米根部 Pb的质量分数,单独接种 AM处理组与对照没有显著性差异。单独添加EDTA、EDDS、AES和 IDSA处理组都显著大于对照(P<0.05),分别是对照的5.0倍、4.7倍、2.8倍和1.9倍,表明螯合剂促进了玉米根部对Pb的吸收。复合添加螯合剂和AM处理组与单独接种AM处理组相比,AM&IDSA与单一接种AM处理无显著性差异,AM&EDTA、AM&EDDS和AM&AES与单独接种AM处理相比,前者显著大于后者(P<0.05),分别是后者的4.5倍、4.2倍和2.8倍。以上表明复合添加螯合剂和AM增强了单一接种AM玉米根部对Pb的吸收效果。
2.4 AM 菌根对根际和非根际土壤重金属化学形态的影响
重金属的生物毒性不仅由其总量决定,更大程度上由其形态分布决定,不同的形态产生不同的环境效应(张旭红等,2012)。在研究菌根能够提高宿主植物对重金属抗性的影响机理时,有些研究认为菌根真菌的菌丝在植物根的表皮形成一个很大的网络(哈蒂氏网),这些哈蒂氏网带可以吸收过滤重金属,阻止重金属向根部运输,从而减轻重金属对植物的毒害(Turnau等,2001);研究认为菌根侵染的根系改变了土壤中重金属的形态,影响了重金属的生物有效性(黄艺等,2000)。以根际土壤中重金属的不同形态相对于非根际土壤中重金属形态的增加百分率为相对改变量,其中Cd的相对变化由于仪器的限制没有检测出来。图7显示了Zn、Cu和Pb在菌根根际土壤和非菌根根际土壤中重金属形态的不同变化情况。
在菌根根际土壤与非菌根根际土壤中,菌根根际相对于非根际Zn的Fe-Mn氧化物结合态的减少量显著小于非菌根根际相对于非根际土壤的相对减少量(P<0.05),表明菌根根际中Zn的Fe-Mn氧化态较非菌根根际显著增加。菌根根际中 Zn的有机物结合态显著高于非菌根根际(P<0.05),Zn的Fe-Mn氧化态和有机物结合态呈现增加的趋势,降低了 Zn的生物有效性,减少了过量重金属对植物的毒害。在前文中提到单一接种AM处理的玉米根部Zn质量分数显著大于对照,虽然接种AM降低了 Zn的生物有效性,但促进了植物的生长,植物吸收的Zn总量仍会大于非菌根,可能与Zn是植物必需的微量元素有关。相对于非根际土壤,Cu的酸可提取态在菌根根际中减少,在非菌根根际中增加,表示菌根根际中酸可提取态的Cu小于非菌根根际。菌根根际中Cu的有机物结合态大于非菌根根际,Cu的生物有效性小于非菌根根际,菌根降低了重金属Cu的生物可利用性,缓解了过量重金属对植物的负作用。在前文中提到单一接种AM处理的玉米根部Cu质量分数与对照无显著性差异,这种情况可能与Cu是植物必需的微量元素有关。菌根根际土壤中 Pb的酸可提取态大于非菌根根际,Fe-Mn有机物结合态和有机结合态大于非菌根根际,但菌根根际中的 Pb由松结合态向紧结合态转移的趋势大,使得菌根根际中 Pb的有效性下降,降低了重金属对植物的毒害。
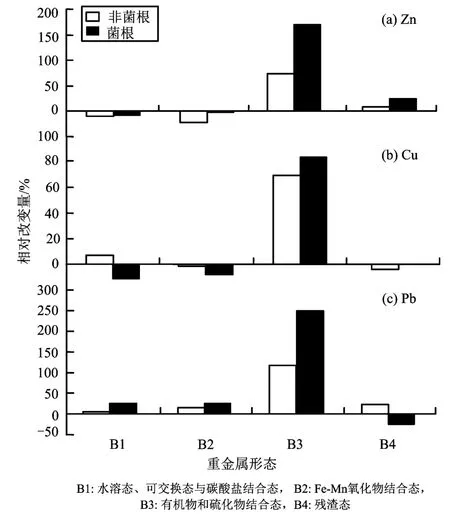
图7 不同形态重金属在菌根和非菌根根际中的相对变化Fig. 7 Relative change of different speciation of heavy metals in mycorrhizal and non-mycorrhizal rhizosphere
3 结论与展望
3.1 研究结论
通过不同种类螯合剂和菌根对植物吸收重金属的影响实验、菌根对根际和非根际土壤中重金属存在形态的影响实验,可以得到以下结论:
(1)螯合剂EDTA、EDDS、AES和IDSA促进了植物对重金属的吸收,但螯合剂及重金属螯合物对植物的生长产生抑制作用。AM菌根可以促进植物的生长,增强植物对重金属环境的抗性,并且一定程度上促进了植物对Cd和Zn的吸收。复合添加螯合剂和接种AM菌根能够提高单一接种AM菌根或者添加螯合剂时玉米对重金属的吸收积累量,两者联合强化了单一应用AM或螯合剂诱导植物提取的效果。
(2)新型螯合剂AES和IDSA处理的玉米地上部 Cd质量分数显著大于对照、EDTA和 EDDS(P<0.05)。AES处理玉米地上部Zn、Cu和Pb的质量分数均显著大于对照及其他螯合剂处理,但EDTA处理的玉米根部Pb质量分数最大。IDSA处理玉米地上部Zn质量分数,地上部和根部Cu质量分数均显著大于对照和EDTA,玉米地上部Pb质量分数显著大于对照。
(3)接种AM菌根改变了根际土壤中重金属的形态,菌根的存在使得重金属的形态由松结合态向紧结合态转移,降低了重金属的生物有效性,降低了过量重金属对宿主植物的毒害。但是,可能由于菌根对植物的生长有促进作用,提高了植物对重金属的吸收效率,接种AM菌根的植物积累的重金属总量大于非菌根,AM菌根增强了植物提取的效果。
3.2 研究展望
首先,新型螯合剂AES和IDSA对Pb的作用不及EDTA,有待继续寻找对Pb解吸能力更强的新型生物可降解螯合剂。其次,对于螯合剂和AM菌根强化植物提取的研究还需要大量的田间试验分析,得出对实际应用价值更高的组合配比。再次,在应用螯合剂诱导植物提取时,植物收割后土壤中重金属的质量分数还是比较高,要综合考虑植物种类和种植制度。最后,不是所有的植物都能形成菌根,这就使得菌根植物对重金属污染土壤的修复受到限制,菌根修复技术还需与生物学、植物学、微生物学等学科相互渗透,提高植物−微生物修复技术的应用价值。
致谢:本实验在中国科学院生态环境研究中心中澳土壤环境研究室完成,感谢朱永官研究员、黄益宗副研究员在实验过程中给予的指导和帮助。
BAKER A J M, BROOKS R R. Terrestrial higher plants which hyper-accumulate metallic elements: a review of their distribution, ecology and phytochemistry[J]. Biorecovery, 1989(1): 81-126.
BLAYLOCK M J, SALT D E, DUSHENKOV S, et a1. Enhanced accumulation of Pb in Indian mustard by soil applied chelating agents[J]. Environmental Science and Technology, 1997, 31(3): 860-865.
CHEN H M, ZHENG C R, TU C, et al. Chemical methods and phytoremediation of soil contaminated with heavy metals[J]. Chemosphere, 2000,41(1-2): 229-234.
CUNNINGHAM S D, BERTI W R, HUANG J W. Phytoremediation of contaminated soils[J]. Trends in Biotechnology, 1995, 13(9): 393-397.
FILGUEIRAS A V, LAVILLA I, BENDICHO C. Chemical sequential extraction for metal partitioning in environmental solid samples[J].Journal of Environmental Monitoring, 2002, 4(6): 823-857.
GARBISU C, ALKORTA I. Phytoextraction: a cost-efective plant-based technology for the removal of metals from the environment[J]. Bioresource Technology, 2001, 77(3): 229-236.
HILDEBRANDT U, REGVAR M, BOTHE H. Arbuscular mycorrhiza and heavy metal tolerance[J]. Phytochemistry, 2007, 68(1): 139-146.
KARENLAMPI S, SCHAT H, VANGRONSVELD J, et al. Genetic engineering in the improvement of plants for phytoremediation of metal polluted soils[J]. Environmental Pollution, 2000, 107(2): 225-231.
KHAN A G, KNEK C, CHAUDHRY T M, et a1. Role of plants, mycorrhizae and phytochelators in heavy metal contaminated land remediation[J]. Chemosphere, 2000, 41(1-2): 197-207.
MARSCHNER H. Mineral nutrition in higher plants[M]. London: Academic Press, 1986: 447- 461.
POWELL C L, BAGYARAJ D J. VA mycorrhiza[M]. Florida, USA: CRC Press, 1984: 24-113.
RAURET G, LOPEZ-SANCHEZ J F, SAHUQUILLO A, et al. Improvement of the BCR three step sequential extraction procedure prior to the certification of new sediment and soil reference materials[J]. Journal of Environmental Monitoring. 1999(1): 57-61.
SALT D E, BLAYLOCK M, KUMAR N P B A, et a1. Phytoremediation: a
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国科学技术出版社, 2000:12-24.
杨亚宁, 巴雷, 白晓楠, 等. 一种改进的丛枝菌根染色方法[J]. 生态学novel strategy for the removal of toxic metals from the environment using plants[J]. Nature Biotechnology, 1995, 13(5): 468-474.
SALT D E, SMITH R D, RASKIN I. Phytoremediation[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1998, 49(1): 643-668.
TURNAU K, PRZYBYLOWICZ W J, MESJASZ-PRZYBYLOWICZ J.Heavy metal distribution in suillus luteus myocrrhizas as revealed by micro-PIXE analysis[J]. Nuclear Instruments and Methods in Physics Research.Section B:Beam Interactions with Materials and Atoms,2001, 181(1): 649-658.
YOSSEFU R A, FATTAN E F A, HILAL M H. Studies on the movement of Ni in wheat rhizosphere using rhizobox technique[J]. Egyptian Journal of Soil Science, 1997, 37(2): 175-187.
黄艺, 陈有键, 陶澍. 菌根植物根际环境对污染土壤中Cu, Zn, Pb, Cd形态的影响[J]. 应用生态学报, 2000, 11(3): 431-434.报, 2010, 30(3): 774-779.
张旭红, 林爱军, 张莘, 等. 丛枝茵根真菌对旱稻根际Pb形态分布的影响[J]. 中国农学通报, 2012, 28(6): 24-29.

