短梗大参扦插生根特性及相关生理生化分析
梁文斌,聂东伶,吴思政*,柏文富,沈素贞
(1.中南林业科技大学生命科学与技术学院,湖南 长沙 410004;2.湖南省森林植物园,湖南 长沙 410116)
短梗大参(Macropanax rosthornii)为五加科大参属常绿灌木或小乔木,树形和叶形优美,抗寒性和耐荫性较强,为四川、贵州、湖南、湖北等南方地区狭域分布的野生观赏植物,可用于城市园林观赏和室内盆栽。短梗大参野生资源分布有限,蕴藏量少,人工繁育是合理开发利用该野生观赏植物资源的有效途径。关于短梗大参人工繁育方式有种子繁殖和扦插繁殖的研究报道[1–2],但未见关于其生根过程中生理生化变化的报道。扦插繁殖作为一种简便、实用和经济的无性繁殖技术适用于苗木的规模化生产。笔者研究其扦插生根过程中生理生化指标的变化,探索其扦插生根的内在机制,旨在为短梗大参的扦插繁殖提供参考。
1 材料与方法
1.1 材 料
生理生化测定扦插试验用插穗采自湖南省森林植物园短梗大参(Macropanax rosthornii)的3年生硬枝,长10~15 cm,具 2个以上腋芽。为方便显微制片,扦插生根解剖试验用插穗选择1年生嫩枝。从母树上随机采集健康无病虫害枝条作为插穗,上端剪成平口,下端剪成约45°的斜切口,将剪好的插穗扎成小捆放在水中保湿待用。
1.2 扦插方法
于2012年4月15日在湖南省森林植物园苗圃扦插床进行扦插试验。扦插前1 d 用800 倍多菌灵药液对扦插床进行消毒。插床基质为纯黄土。将剪好的3年生硬枝插穗分成2组:处理组(IBA)和对照组(CK)。通过试验筛选,用500mg/L 的IBA 浸泡处理组插穗基部30min,对照组插穗基部用清水浸泡。在插床上采用随机区组设计,每区组分别扦插处理组和对照组的插穗各150 条,每处理重复3次。将剪好的30 条1年生嫩枝插穗基部用清水浸泡后扦插在插床上的一区组内,扦插深度5~6 cm,扦插后搭小拱棚覆盖薄膜保湿,再在其上搭建遮阴棚遮阳,进行常规扦插管理。在2012年6月5日统计生根率、平均根数和平均根长。
1.3 生理生化指标的测定
3年生硬枝在扦插前(0 d)采样1次,扦插后每8 d采样1次,采样后洗净吸干,取插穗基部2 cm的皮层测定生理生化指标。多酚氧化酶(PPO)活性测定参照文献[3]中的方法适当加以改进;过氧化物酶(POD)活性、可溶性糖含量、可溶性蛋白含量、吲哚乙酸氧化酶(IAAO)活性采用比色方法[4]测定。
1.4 扦插生根的解剖学观察
1年生嫩枝从扦插10 d 后每隔5 d 取样,直至不定根出现时为止。每次取5 条插穗,在其基部截取约1.0 cm 的小段,立即投入FAA 固定液中。采用石蜡制片法,切片经番红、固绿染色后用加拿大胶封片,在Motic B5 数码显微镜下观察,并拍照。
1.5 数据分析
利用Excel 2003 处理数据和绘制图表,用SPSS 13.0 进行方差分析和差异显著性检验(LSD 法)。
2 结果与分析
2.1 短梗大参扦插的生根特性
短梗大参从开始扦插至不定根完全形成约需45 d 时间。生根分析结果(表1)表明,IBA 处理的插穗生根率为84.4%,平均不定根条数为34.74,平均根长为3.28 cm;对照插穗生根率为97.0%,平均不定根条数为20.63,平均根长为3.66 cm,因此,IBA处理插穗可以提高插穗生根数量。对生根过程的观察结果表明,插穗切口不形成愈伤组织,而是在离插穗切口约1.5 cm 处产生不定根(图1–A,B)。从插穗生根解剖来看,不定根原基起源于皮层(图1–C),故生根类型为皮部生根型。根据短梗大参不定根形成特点,大致可划分为3个阶段,即根的诱导阶段( 0~16 d) 、表达阶段( 17~24 d) 和生长阶段(25~45 d)。
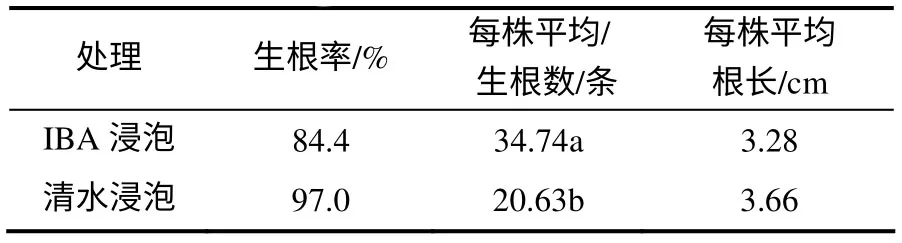
表1 短梗大参扦插生根特性 Table 1 Rooting characters of Macropanax rosthornii
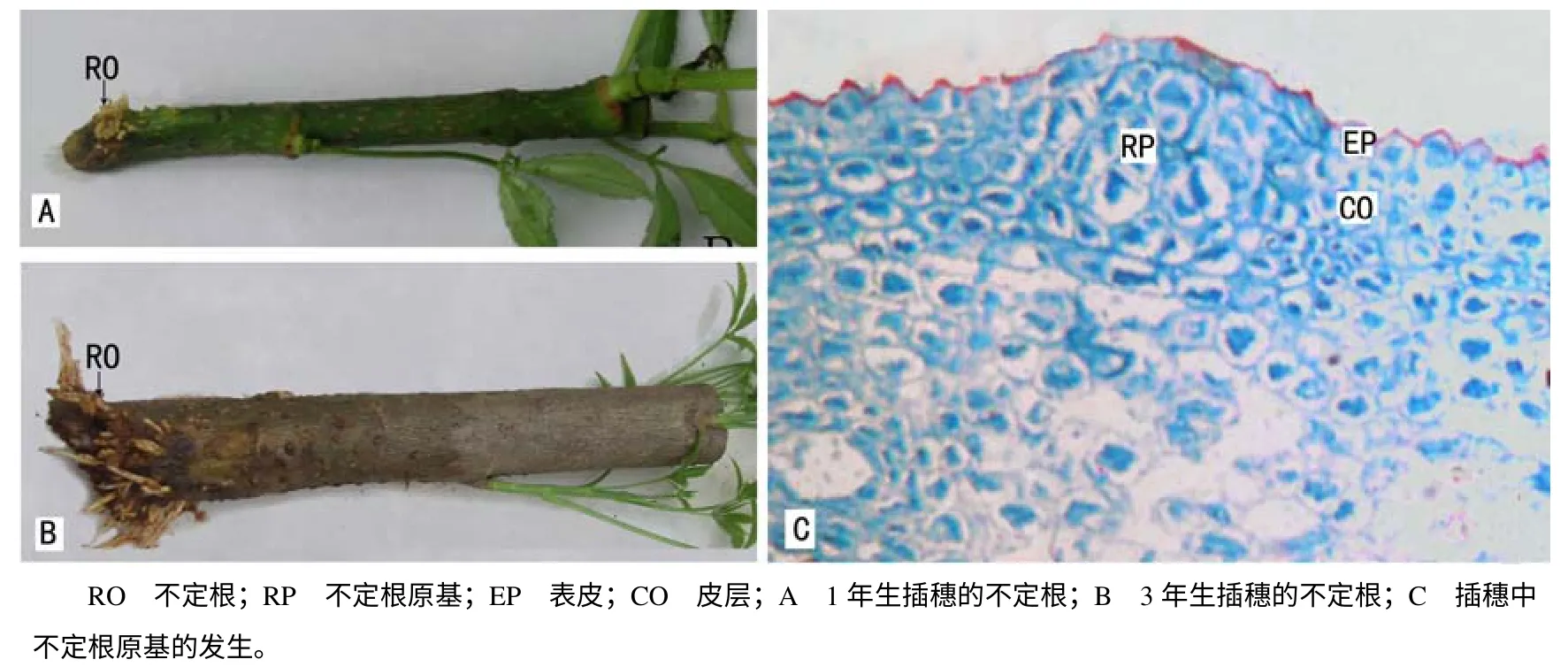
图1 短梗大参的插穗不定根和不定根原基 Fig.1 Adventitious root and their primordium in Macropanax rosthornii cutting
2.2 短梗大参扦插生根过程中营养物质的含量
2.2.1 可溶性糖含量
由图2可见,对照(CK)和IBA处理插穗40 d生根过程中的可溶性糖含量变化趋势基本一致,均为先降后升。在扦插前,CK和和IBA处理插穗的可溶性糖含量分别为6.95、6.68mg/g,在扦插后8 d内两者的可溶性糖含量基本保持稳定,在8 d后开始下降。消耗的糖类一方面用于维持插穗的生活力和物质转换所需要的能量等;另一方面用于不定根原基的诱导。在24 d时CK和IBA处理插穗可溶性糖的含量均下降至最低,分别为2.45、3.02mg/g,比扦插前分别下降了64.75%和54.79%。这个阶段正是短梗大 参插穗不定根开始形成的时期。不定根发生以后,插穗上的芽开始萌发形成枝叶,插穗体内因自身合成糖类,可溶性糖含量又呈现上升趋势,其中IBA处理后的插穗可溶性糖含量高于CK。扦插后40 d根生长量增加,根的吸收能力增强,CK和IBA处理的插穗可溶性糖含量分别上升至5.97、8.38mg/g。

图2 扦插生根过程中短梗大参插穗的可溶性糖含量 Fig.2 Content of soluble sugar during cutting rooting within 40 d
2.2.2 可溶性蛋白质含量
由图3可见,对照(CK)和IBA处理插穗生根过程中的可溶性蛋白质含量均呈先降后升的趋势变化。CK和IBA处理插穗的可溶性蛋白质含量在扦插前分别为4.25、4.45mg/g,在扦插后开始下降,至8 d 时降至最低值,分别为1.31、2.10mg/g,比扦插前分别下降了69.18%和52.81%。显然,在扦插后0~8 d蛋白质含量下降幅度大,在此阶段蛋白质分解为氨基酸,为插穗不定根的诱导和形成提供了物质基础。扦插后8 d插穗中可溶性蛋白质含量开始上升,伴随着不定根的发生,插穗上的芽开始萌发,并逐渐形成枝叶,叶片内合成的蛋白质部分转运到插穗中,致使插穗内的蛋白质含量有所增加,为不定根的生长提供物质基础。扦插后32 d,CK和IBA处理插穗的可溶性蛋白质含量达到最高,分别为6.48 、6.92mg/g,比扦插前提高了52.47%和55.51%。扦插后40 d,CK和IBA处理的可溶性蛋白质含量仍较高,且均高于扦插前的水平。由图3还可以看出,IBA处理有利于插穗中蛋白质的积累。
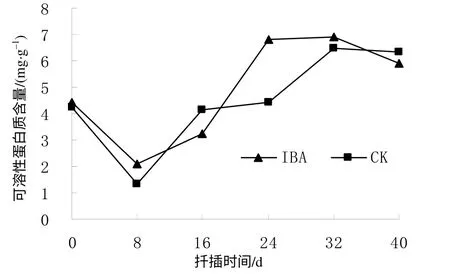
图3 扦插生根过程中短梗大参插穗的可溶性蛋白质含量 Fig. 3 Content of soluble protein during cutting rooting within 40 d
2.3 扦插生根过程中短梗大参插穗的相关酶活性
2.3.1 PPO 活性
从图4可知,在短梗大参硬枝扦插生根过程中,对照(CK)和IBA处理的插穗基部皮层的 PPO活性变化趋势基本一致。在扦插后8 d,CK和IBA处理的插穗PPO活性均处于较低水平,其平均值分别为4.14、3.83 U/(g·min),说明催化生成的生根辅助因子“IAA-酚酸复合物”较少,随扦插时间的延长,PPO活性快速升高,至扦插后16 d达到峰值,CK处理的为19.60 U/(g·min),IBA处理的为25.25 U/(g·min),分别比扦插前增加了372.29%和515.85%,即相应的“IAA-酚酸复合物”大量增加,有利于不定根的诱导。扦插后24 d时为根的表达期,此时细胞数量增多,PPO活性下降至最低点。在根的生长期,PPO活性开始回升,至扦插后40 d,CK和IBA处理分别上升至25.07、28.30 U/(g·min),比扦插前分别增加了504.10%和590.24%。
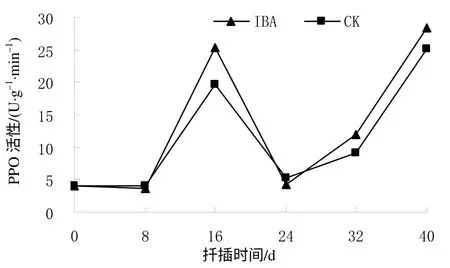
图 4 扦插生根过程中短梗大参插穗的PPO 活性 Fig. 4 Changes of PPO activity during cutting rooting within 40 d
2.3.2 POD 活性
无论是对照(CK)还是IBA处理的插穗基部皮层的 POD 活性随插穗生根的不同阶段而发生规律性变化(图5),两者变化趋势基本一致。在插穗不定根的诱导阶段,CK和IBA处理插穗的POD活性增加,在扦插后8 d分别达到最大值1 487.23、1 611.11 U/(g·min),比扦插前分别提高了47.10%和59.20%,然后急剧大幅度下降,至16 d时降至最低,分别为146、205 U/(g·min),比最大值分别下降了90.18%和87.28%。在不定根的表达阶段,POD活性处于较低水平。在不定根的生长阶段,CK和IBA处理的插穗POD活性逐渐上升,至扦插后32 d出现第2个峰值,其值分别为990、1 100 U/(g·min),均明显低于第一个峰值,然后POD活性开始下降,在扦插后40 d处于较低水平。
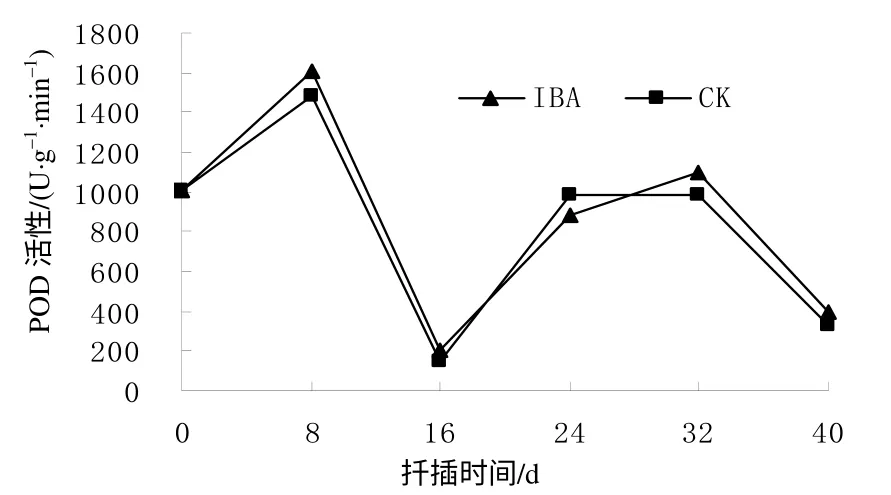
图 5 扦插生根过程中短梗大参插穗的POD 活性 Fig. 5 Changes of POD activity during cutting rooting within 40 d
2.3.3 IAAO 活性
从图6可以看出,对照(CK)和IBA处理的插穗基部皮层的IAAO活性在扦插后均逐渐上升,至扦插后24 d达到最高,分别为589.53、613.45 U/(g·h),比扦插前分别提高了8.83%和14.84%,此阶段插穗中的IAA含量最低,有利于不定根原基的诱导和表达。之后插穗IAAO活性开始缓慢下降,导致插穗中IAA 含量升高,有利于不定根的生长。扦插后40 d时不定根大量发生,IAAO活性降至扦插前的水平。IBA处理插穗的IAAO活性变化趋势与对照的变化基本一致,两者差异不明显,说明IBA处理对短梗大参插穗生根过程中的IAAO活性影响不明显。
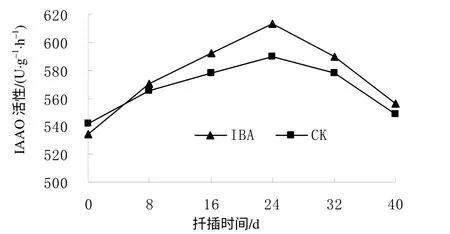
图 6 扦插生根过程中短梗大参插穗的IAAO 活性 Fig. 6 Changes of IAAO activity during cutting rooting within 40 d
3 结论与讨论
短梗大参在黄土中的扦插生根率较高,最高可达97%,IBA处理插穗可以提高其不定根数量;扦插生根过程中不产生愈伤组织,生根类型为皮部生根型。
糖类在扦插生根过程中为插穗不定根的诱导、形成和生长提供所需的能量,而蛋白质是植物细胞结构的组成物质,在调节体内代谢等方面有重要作用,因此,可溶性糖含量和蛋白质含量与插穗生根有一定的相关性。在生根诱导期插穗可溶性糖含量和可溶性蛋白质含量均下降明显,消耗的糖类和蛋白质一方面用于维持插穗的生活力和物质转换所需要的能量等,另一方面用于根原基的发生。在不定根发生以后,插穗上的芽开始萌发形成枝叶,根的吸收能力也开始增强,插穗体内因自身合成糖类,可溶性糖含量和可溶性蛋白质含量则呈现上升趋势。不少研究[5–8]也表明,插穗生根时需要足够的营养物质,特别是要消耗大量碳水化合物和含氮化合物。另外,本研究中发现IBA处理的插穗在生根过程中可溶性糖含量和蛋白质含量均高于对照,说明IBA处理有利于插穗中可溶性糖和可溶性蛋白质的积累,这与柚木嫩枝扦插研究中IBA处理插穗的可溶性糖含量显著增加[9]相符合。
POD、PPO和IAAO的活性与短梗大参扦插生根密切相关,在插穗不定根的诱导、表达和生长的3个阶段中呈现各自的变化特点,表明它们可能通过相互作用来影响生根。POD 作用的某些产物可能是不定根发生和发展所必需的辅助因子,能促进不定根的形成[10]。在短梗大参扦插生根过程中,POD活性在根诱导早期较高,在根表达阶段较低,在根生长阶段较高,出现2个POD活性高峰,可能与POD分别参与根的诱导和表达有关[11–14]。因为POD能氧化IAA,消除体内过多的内源IAA,有利于根原基的诱导[15],所以,可以认为本研究中根表达期POD活性低有利于IAA免受分解,促进根原基不定根的形成。也有扦插生根中POD活性仅出现1个峰的报道[10]。
扦插切口易受到外界物质侵染而在插穗体内生成大量自由基,对机体产生伤害,而多酚氧化酶(PPO)活性的增强可以消除自由基对机体的影响,同时,PPO催化酚类物质和IAA-酚酸复合物能促进不定根的发生与发育[16]。此外,PPO影响细胞分裂、分化及根原基的形成和生长,被认为参与了“生根素”的合成,从而刺激植物离体材料扦插生根[17],因此,插穗不定根的发生与PPO活性的升高密切相关。在本研究中,PPO在生根诱导期维持较高的活性,有利于插穗生根的诱导和生长,这与曹邦华等[18]的研究结论一致。在根的表达期PPO活性下降,这可能是因为在此阶段短梗大参不定根开始大量形成,细胞数量增多,PPO参与细胞分裂、分化。这与闫绍鹏等[19]的研究结果基本一致。
IAA具有多种生理功能,能促进不定根的发生与发育,而IAAO可以氧化IAA,因此,IAAO活性的大小与根的发生有重要关系[10,15]。试验结果表明,离体生根过程中高活性的IAAO使内源IAA水平降低是生根诱导期的特点之一[20–21]。宋金耀等[11]认为, 在生根诱导期高IAAO活性降低了IAA浓度,有利于根的诱导,而在根诱导后期IAAO 活性降低,使IAA免受破坏,以促进根的萌发和生长。这与本研究中不定根的诱导和表达期插穗表现出高的IAAO活性,而在不定根的生长期插穗IAAO活性下降的结论基本一致。
本研究中IBA处理插穗对扦插生根中PPO、POD和IAAO活性的影响不明显,表明这3种酶活性的大小可能只与扦插生根有关。这与勒栋梁等[17]在杂交榛绿枝扦插试验中的研究结果有类似之处,但也有关于IBA处理明显提高了插穗内POD活性和PPO活性,而IAAO活性下降且维持在较低水平的报道[22]。
[1] 柏文富,聂东伶,吴思政,等.短梗大参扦插繁殖试验[J].湖南林业科技,2012,39(6):20–27.
[2] 沈素贞,梁文斌,宋雷.野生观赏植物短梗大参种子萌发特性的研究[J].中南林业科技大学学报,2013,33(8):57–62.
[3] 李忠光,龚明.植物多酚氧化酶活性测定方法的改进[J].云南师范大学学报:自然科学版,2005,25(1):44–49.
[4] 张志良,瞿伟菁.植物生理学实验指导[M].3版.北京:高等教育出版社,2003.
[5] 王新建,何威,张秋娟,等.豫楸1 号扦插生根过程中营养物质含量及氧化酶类活性的变化[J].林业科学,2009,45(4):156–160.
[6] 徐丽萍,上官新晨,喻方圆.秤锤树嫩枝扦插过程中营养物质含量的变化[J].江西农业大学学报,2012,34(1):50–53.
[7] 张雪,李隆云,杨宪灰.毡毛忍冬扦插繁殖过程中营养物质含量的变化研究[J].中国中药杂志,2010,35(11):1378–1381.
[8] 敖红,王昆,陈一菱,等.长白落叶松插穗内的营养物质及其对扦插生根的影响[J].植物研究,2002,22(3):301–304.
[9] 曾炳山,黄永芳,杨懋勋,等.柚木嫩枝扦插生根过程中营养物质的研究[J].中南林业科技大学学报,2013,33(2):1–4.
[10] 宋丽红,曹帮华.光叶楮扦插生根的吲哚乙酸氧化酶、多酚氧化酶、过氧化物酶活性变化研究[J].武汉植物学研究,2005,23(4):347–350.
[11] 宋金耀,何文林,李松波,等.毛白杨嵌合体扦插生根相关理化特性分析[J].林业科学,2001,37(5):64–67.
[12] 扈红军,曹帮华,尹伟伦,等.不同处理对欧榛硬枝扦插生根的影响及生根过程中相关氧化酶活性的变化[J].林业科学,2007,43(12):70–75.
[13] Calderón Baltierra X V.Changes in peroxidase activity during root formation by Eucalyptusglobulus shoots raised in vitro[J].Plant Perox Newslett,1994,4:27–29.
[14] 扈红军,曹帮华,尹伟伦,等.榛子嫩枝扦插生根相关氧化酶活性变化及繁殖技术[J].林业科学,2008,44(6):60–65.
[15] 刘玉民,刘亚敏,马明.马尾松扦插生根过程相关生理生化分析[J].林业科学,2010,46(9):28–33.
[16] 曹玉翠,曹帮华倡,王兵,等.不同生长素对蔷薇硬枝扦插生根的影响[J].江西农业大学学报,2009,31(4):655–658.
[17] 勒栋梁,董凤祥,李宝,等.杂交榛不同枝段绿枝扦插生根特性及相关氧化酶活性变化[J].林业科学研究,2009,22(4):526–532.
[18] 曹帮华,扈红军,张大鹏,等.桑树硬枝扦插生根能力及其生根关联酶活性的研究[J].蚕业科学,2008,34(1):96–100.
[19] 闫绍鹏,武晓东,王秋玉,等.欧美山杨杂种嫩枝微扦插生根相关氧化酶活性变化及繁殖技术[J].东北林业大学学报,2011,39(11):5–11.
[20] Nag S,Saha K,Choudhuri M A.Role of auxin and polyamines in adventitious root formation in relation to changes in compounds involved in rooting[J].J Plant Growth Regul,2001,20:182–194.
[21] Gyana R R.Effects of auxins on adventitious root development from single node cuttings of Camellia sinensis (L.) Kuntze and associated biochemical changes[J].Plant Growth Regulation,2006,48:111–117.
[22] 付喜玲,郭先锋,康晓飞,等.IBA对芍药扦插生根的影响及生根过程中相关酶活性的变化[J].园艺学报,2009,36(6):849–854.

