HPV16 E6/E7对凋亡调控基因表达影响的研究
沙亚哈提·别尔克哈之, 李 卉, 吉别克·瓦提别克, 刘伊宁, 李晓苗, 来雯婷,美丽吾尔提·达吾列提汗, 谌宏鸣, 李惠武
(新疆医科大学基础医学院, 乌鲁木齐 830011)
目前,越来越多的证据表明人乳头状癌病毒(Human papilloma virus,HPV)的感染与食管鳞癌的发生有关。Guo等[1]对安阳300例食管癌患者和900例正常人的食管组织进行研究,结果表明HPV的感染与食管癌的发生关系非常密切,这为HPV感染是中国食管癌高发区病因提供了有力的证据,并且指出HPV16的感染与食管癌的关系最为密切。Lu等[2]将HPV16 E6E7蛋白融合疫苗注入HPV16 E7表达的食管鳞癌细胞株中,结果明显降低了食管癌细胞的生长增殖。这一结果从另一方面证明HPV16 在食管癌的发生、发展中起到重要作用。但尚无HPV E6/E7与凋亡调控因子关系的研究报道。
HPV16 是一类小型无胞膜的环状双链DNA病毒,具有高度的宿主特异性,其早期表达的2个蛋白E6和E7扰乱正常细胞周期活动和信号通路。Longworth等[3-4]报道,高风险E7通过锌指状区域蛋白序列与组蛋白脱乙酰酶(HDACs)结合并直接调节病毒复制。作为促凋亡基因Bad 含有BH3结构域的前凋亡蛋白,与Bcl-2抗凋亡蛋白形成二聚体,调控细胞凋亡。Bcl-2基因主要通过抑制后者发挥抗凋亡作用,是Bcl-2家族抗凋亡蛋白中的一员。本实验通过用课题组前期构建的 HPV16 E6 及E6E7 融合基因的真核表达载体,转染食管癌细胞 KYSE450细胞,过表达E6 及E6E7,检测转录水平上Bcl-2和Bad 的表达变化,进一步探讨HPV16 E6/E7对凋亡调控因子Bcl-2和Bad表达的影响,以及凋亡调控因子与HPV的联系。
1 材料和方法
1.1细胞株和培养基食管癌细胞株KYSE450购自中国科学院细胞中心,小牛血清购自杭州四季青生物工程材料有限公司,RPMI1640 培养基和胰蛋白酶购自美国GIBCO公司,DMSO(二甲基亚砜)购自SIGMA公司,HDAC Inhibitor购自美国SIGMA公司。
1.2细胞的培养食管癌细胞株KYSE450使用RPMI1640培养基(含10%胎牛血清及青霉素、链霉素和两性霉素各 100 U/mL),置 37℃、饱和湿度、5%CO2孵育箱内培养,隔天观察。脂质体转染食管癌细胞KYSE450:实验共分正常培养组(C)、空载体pLVX-AcGFP1-N1转染组(P)、空载体pLVX-AcGFP1-N1转染抑制组(iP)、pLVX-AcGFP1-N1-E6转染组(iE6)及pLVX-AcGFP1-N1-E6E7融合基因转染组(E6E7)5组。12孔板内培养细胞至80%融合度时,用低血清培养基洗涤细胞,以 4 μL LipofectamineT M 2000转染 1.6 μg质粒 DNA, 6 h后更换含10%胎牛血清的1640培养基,同时对于转染组用2 nm/L的TSA的培养液培养,孵箱内继续孵育48 h。
1.3试剂和仪器Trizol、异丙醇、溴化乙锭(Sigma公司),M-MLV cDNA合成试剂盒(Promega公司),PCR均用试剂盒、DNA Marker、6×Loading buffer、琼脂糖、50×TAE(上海生工生物技术有限公司),其他试剂为国产分析纯。
opti-MEM®I 低血清培养基(美国 Invitrogen公司),低温高速离心机(Beckman CoulterTM,美国),梯度PCR仪( iCyclerTM Thermal Cycler,美国),凝胶成像系统(Bio-Rad,美国),生物安全柜(HERA safe,德国),电热恒温培养箱(上海华达器材厂)。
1.4RT-PCR检测及结果判定
1.4.1 总RNA提取 按Trizol一步法提取RNA,紫外分光光度计测定各组RNA浓度和A260/280比值,RNA保存于-80℃。
1.4.2 引物设计与合成 根据Genebank查找 Bad与Bcl-2序列,利用Primer 5.0软件设计其引物,引物序列如下:Bad上游引物:5′-CAGAGTTTGAGCCGAGTGAGC-3′,下游引物:5′-CCCATCCCTTCGTCGTCCT-3′,片段长度为247 bp。Bcl-2 上游引物:5′-CGCTGGGAGAACAGGGTA-3,下游引物:5′-GGGCTGGGAGGAGAAGAT-3′,片段长度为151 bp。GAPDH 上游引物:5′-GGGAAACTGTGGCGTGAT-3′,下游引物:5′-AAAGGTGGAGGAGTGGGT-3′,片段长度为309 bp。
1.4.3 反转录合成cDNA 总RNA 1 μL、oligo(dT)引物1 μL、RNase-free Water 9 μL混匀后置于72℃ 10 min,取出后置于冰上逐次加入MgCl24 μL、dNTP 2 μL、10倍反应缓冲液2 μL、RNA酶抑制剂0.5 μL、逆转录酶0.5 μL,最终体积达到20 μL。混匀后置于42℃ 1 h,用95℃ 5 min终止反应。取出后置冰上,加80 μL双蒸水,得到100 μL逆转录产物,于-20℃冰箱保存备用。
1.4.4 RT-PCR扩增反应 逆转录产物cDNA模板2 μL,待扩增的各基因上下引物各1 μL,即用PCR反应试剂盒反应溶液10 μL,ddH2O 6 μL,总体积20 μL。
1.4.5 RT-PCR反应条件 用cDNA为模板,以GAPDH作为内参对照,进行PCR扩增,反应体系20 μL:上下游引物(10 μmol/L)各1.0 μL,模板 cDNA 2.0 μL,ddH2O 6.0 μL,Mg2+0.4 μL,退火温度60℃,35个循环。
目的基因的扩增: 取2×Taq PCR Master Mix 10 μL,向其中加入目的基因正向和反向引物各1 μL、6 μL ddH2O,再加入2 μL的 cDNA模板,最终的PCR反应体系为20 μL,Bcl-2与Bad 的退火温度分别为58℃和60℃。
1.4.6 PCR产物凝胶电泳 10 μL产物加入1 μL 5×Loading Buffer上样缓冲液,经2%的琼脂糖凝胶电泳后,在紫外光凝胶成像分析仪下分析结果,用内参照光密度值标化Bad、Bcl-2的吸光度值,得到目的基因表达的相对含量。

2 结果
2.1Bad和Bcl-2基因的表达Bad mRNA在食管癌细胞KYSE450中表达较低,E6E7过表达对细胞内Bad 基因 mRNA水平无影响,各转染组之间无差异。Bcl-2 mRNA 在正常组(C)和空载体组(P)中均有表达,E6E7融合基因转染组(E6E7)的表达量高于其他各组,E6/E7对Bcl-2有轻度上调作用(表1)。
2.2HDAC抑制剂(TSA)对E6调控Bcl-2基因表达的影响经过HDAC抑制剂TSA处理后,尽管Bcl-2基因的表达水平受到了抑制,但TSA却明显增加了E6对Bcl-2基因表达的诱导调控作用(表1、图1)。

图1 转染KYSE450细胞后目的基因的检测
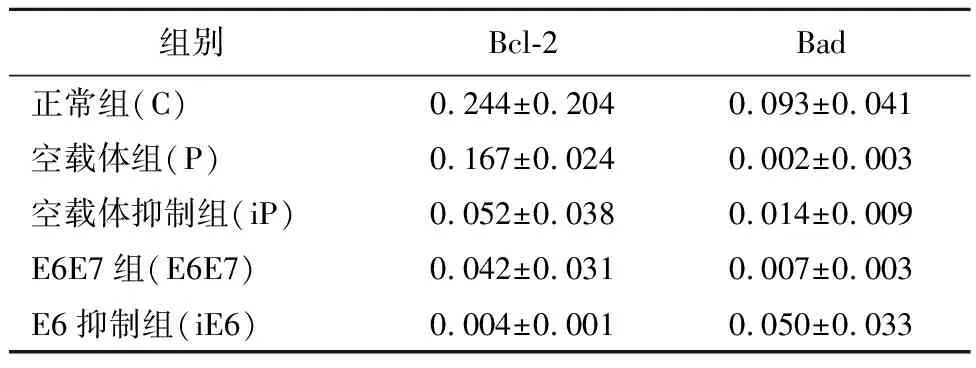
组别Bcl-2Bad正常组(C)0.244±0.2040.093±0.041空载体组(P)0.167±0.0240.002±0.003空载体抑制组(iP)0.052±0.0380.014±0.009E6E7组(E6E7)0.042±0.0310.007±0.003E6抑制组(iE6)0.004±0.0010.050±0.033
3 讨论
肿瘤的发生是一个复杂的过程,伴随多种可能的机制。HPV16早期表达基因可能参与细胞周期的肿瘤发生、发展过程,但对于E6/E7是否对肿瘤细胞凋亡过程进行调控尚未见报道。HPVs 是一类小型无胞膜的环状双链DNA病毒,具有高度的宿主特异性,并对鳞状上皮细胞极具感染力[5-6]。最近的研究发现抑制HPV E6和E7致癌基因可引起细胞凋亡,并激活肿瘤细胞抑制通路[7]。Bad蛋白可能通过与凋亡抑制基因Bcl-2和Bcl-xl等的表达产物形成异源二聚体而达到促凋亡效果[8-9]。Bcl-2基因是Bcl-2基因家族的一个重要成员, Bcl-2可以通过阻止caspase的活化在线粒体细胞色素C释放的上游发挥其抗凋亡的作用[10-11]。研究发现,Bcl-2在肾脏肿瘤、胃肠肿瘤中高表达,细胞凋亡受到抑制,加速肿瘤生长,预后差[12-13]。Schimmer等[14]研究发现,在Bcl-2基因和Bcl-xl基因过表达的情况下,Bad蛋白可直接诱导凋亡,具有治疗意义。Hattori等[15]认为,促凋亡的Bad蛋白与抗凋亡的Bcl-2蛋白竞争性结合形成异二聚体调节凋亡过程。
HDAC抑制剂是一类新型抗肿瘤药物,其通过改变染色质结构而调控基因表达。HDAC抑制剂的主要生物效应包括诱导肿瘤细胞分化、细胞周期阻滞和细胞凋亡、增强化疗和放疗敏感性、逆转转移性肿瘤的恶性表型等抗肿瘤效应[16-17]。本实验对食管癌KYSE450细胞中Bad mRNA水平进行检测,结果显示Bad mRNA水平在 E6 载体转染组、E6E7 融合基因载体转染组、正常培养组和空载体组间没有明显变化。推测该食管癌细胞中,E6、E7 与Bad之间在转录水平上可能不存在调控关系,Bcl-2 mRNA 在正常培养组和空载体转染组中均有表达, E6E7融合基因转染组的表达量高于其他各组,说明E6/E7对Bcl-2有轻度调控作用,使该基因表达增高, 这与目前研究报道一致,本研究中,E6/E7的表达促进Bcl-2 在转录水平上调,但具体机制还有待进一步验证。 HDAC抑制剂 TSA处理后,尽管Bcl-2基因的表达受到了抑制,但TSA却明显增加了E6对Bcl-2基因表达的诱导调控作用,提示HDAC在细胞中E6与Bcl-2在转录水平上存在调控关系。
综上所述,病毒感染后早期表达致癌基因 E6、E7 可能刺激肿瘤转移因子 Bcl-2 在转录水平上的表达,促进了肿瘤的恶性发展。Bcl-2作为主要的调亡调控因子,在肿瘤的生物学行为中起着重要的作用。进一步研究E6、E7调控Bcl-2在肿瘤发生、发展中的作用机制,对肿瘤早期诊断和临床治疗具有有意义的价值。
参考文献:
[1] Guo FC, Liu Y, Wang XE, et al. Human papillomavirus infection and esophageal squamous cell carcinoma:a Case-Control study[J]. Cancer Epidemiol Biomarkers Prev, 2012, 21(5):780-785.
[2] Lu YZ, Zhang ZX, Liu Q, et al. Immunological protection against HPV16 E7-expressing human esophageal Cancer cell challenge by a novel HPV16-E6/E7 fusion protein based-vaccine in a Hu-PBL-SCID mouse model[J]. Biol Pharm Bull, 2007, 30(1):150-156.
[3] Longworth MS, Laimins LA.The binding of histone deacety-lases and integrity of Zinc finger-like motifs of the E7 protein are essential for the Life cycle of human papillomavirus type 31[J]. J Virol, 2004, 78:3533-3541.
[4] Longworth MS. Regina wilson and laimonis a laimins[J]. EMBO J, 2005, 24:1821-1830.
[5] Hausen H.Papillomaviruses in the causation of human cancers-a brief historical account[J]. Virology, 2009, 384(2):260-265.
[6] Moody CA,Laimins LA.Human papillomavirus oncoproteins: pathways to transformation[J]. Nat Rev Cancer, 2010, 10(8):550-560.
[7] Magaldi TG, Almstead LL, Bellone SA, et al. Primary human cervical carcinoma cells require human papillomavirus E6 and E7 expression for ongoing proliferation[J]. Virology, 2012, 422(1):114-124.
[8] Zha J, Harada H, Yang E, et al. Korsmeyer SJ serine phosphorylation of death agonist BAD in response to survival factor results in binding to 14-3-3 not BCL-X(L)[J]. Cell,1996,87:619-628.
[9] Datta SR, Katsov A, Hu L, et al. 14-3-3 proteins and survival kinases cooperate to inactivate BAD by BH3 domain phosphorylation[J]. Mol Cell, 2000, 6:41-51.
[10] Burlacu A. Regulation of apoptosis by Bcl-2 family proteins[J]. Cell Mol Med, 2003, 7:249-257.
[11] Sprick MR, Walczak H. The interplay between the Bcl-2 family and death receptor-mediated apoptosis[J]. Biochim Biophys Acta, 2004, 1644(2/3):125-132.
[12] Kim R, Emi M. Therapeutic potential of antisense Bcl-2 as a chemo sensitizer for patients with gastric carcinoma[J]. J Clin Oncol, 2005,25:40-50.
[13] Molto L, Rayman P. The Bcl-2 transgene protects T cells from renal cell carcinoma-mediated apoptosis[J]. Clin Cancer Res, 2003,45:4060-4068.
[14] Schimmer AD, Hedley DW, Pham NA, et al. BAD induces apoptosis in cells over-expressing Bcl-2 or Bcl-xL without loss of mitochondrial membrane potential[J]. Leuk Lymphoma, 2001, 42(3):429-443.
[15] Hattori T, Ookawa N, Fujita R, et al. Heterodimerizationof bcl-2 and bcl-xl with bax and bad in colorectal Cancer[J]. Aeta Oncol, 2000, 39(4):495-499.
[16] Brown R, Strathdee G. Epigenomics and epigenetic therapy of cancer[J]. Trends Mol Med Suppl, 2002, 8(4):43-48.
[17] Kim YB, Ki SW, Yoshida M, et al. Mechanism of cell cycle arrest caused by histone deacetylase inhibitors in human carcinoma cells[J]. Antibiot(Tokyo), 2000, 53:1191-1200.

